夜香树花提取物对宫颈癌细胞增殖及凋亡的影响
2020-08-28卢红梅覃清霞戴传勇李泰球何欢
卢红梅,覃清霞,戴传勇,李泰球,何欢
(广西农业职业技术学院,广西 南宁)
0 引言
夜香树(Cestrum nocturnum Linn,简写为CN),又名夜来香,为茄科夜香树属植物,广泛种植于热带、亚热带地区,药物资源丰富。流行病学研究调查显示,宫颈癌是妇女最常见的生殖系统恶性肿瘤[1],给患者的身心健康带来严重影响。本研究拟探讨夜香树花提取物在体外对Hela细胞增殖的抑制作用,在此基础上进一步探讨其对Hela细胞周期和细胞凋亡的影响。
1 实验材料
1.1 细胞株
Hela细胞从上海细胞生物研究所细胞库购买。
1.2 仪器
CO2培养箱(美国产,型号381); 倒置显微镜(日本产,型号CK40);倒置荧光显微镜(日本产,型号TE2000-U);酶标仪(奥地利产,型号Sunrise);96孔板(德国产,型号3679);稳压稳流电泳仪(北京市六一仪器厂,型号DYY-6B);旋转蒸发器(上海亚荣生化仪器厂,型号RE-52AA);流式细胞仪(美国产,型号Epricsxl)。
1.3 受试药品与试剂
夜香树花提取物;MTT(德国Sigma公司产);PBS(杭州四季青生物工程材料有限公司产);Trypsin(天津市景洋生物制品有限责任公司产);DMSO(上海润捷化学试剂有限公司产); RNase酶(sigma分装);碘化丙啶(PI,sigma分装);RPMI-1640培养基(美国GIBCO公司产)。
2 实验方法
2.1 受试药品的制备和配制
夜香树花(CN花)晒干,用95%乙醇浸泡3天,水浴回流提取2次,滤液进行常压蒸馏,浓缩得浸膏。浸膏用RPMI-1640培养基溶解,配成五个不同的浓度,分别是5μg/mL、10μg/mL、20μg/mL、40μg/mL、80μg/mL;空白对照为等体积的RPMI-1640培养基。
2.2 体外MTT法及细胞生长观察 [2,3]
Hela细胞用0.5ml 、0.25%的胰蛋白酶消化,用含10%牛血清的RPMI-1640培养液调配成浓度为5×103个/ mL,接种于96孔板,给药组为190 μL细胞悬浮液和10μL药液,即200μL/孔,空白组为190 μL细胞悬浮液和10μL生理盐水,受试药品每种浓度设3个平行孔,37℃、10% CO2培养3d。3d天后,用倒置显微镜(10×10)观察细胞的生长情况及形态学变化。后弃上清液,每孔加入0.2mg/mL、200μL MTT溶液,震荡均匀后继续培养4h。再弃上清液,加入200μL DMSO溶液/孔,振荡和溶解MTT甲臜沉淀,用酶标仪(波长为550nm、参比波长为450nm)测定其OD值。抑瘤率%=(1-实验组平均OD值/对照组平均OD值)×100%。
2.3 体外诱导Hela细胞凋亡的实验研究
2.3.1 流式细胞术法检测Hela的细胞周期及凋亡情况[4,5]
Hela细胞用含10%牛血清的RPMI-1640培养液配成1.5×105个/mL的细胞悬液,培养在放有载玻片的培养瓶中,每瓶6mL,并加入浓度为20ug/mL的受试药液。空白对照组为等体积的RPMI-1640培养液,37℃、10% CO2培养3d,收集培养瓶中的Hela细胞,用PBS洗涤2次,4℃、70%乙醇固定。第2d,离心(1500r/min、4℃)除去固定液,加0.5ml PBS重悬细胞,加(6μl、10mg/mL)RNase酶/管,37℃水浴20min,200目筛过滤除去粘连细胞,加50μg/ml PI染液,室温染色30min,上机。流式细胞仪测定细胞周期各时期细胞的比例和细胞凋亡。
2.3.2 形态学观察:瑞氏-吉姆萨染色法[4]
步骤2.3.1中,Hela细胞培养3d后,取出载玻片用甲醇固定10min,先用瑞氏染液染色5min,再用吉姆萨溶液与Sorensen磷酸缓冲液以1:9配成混合液(现配现用),染色10min。用水冲洗,晾干,镜检(10×40)。
2.4 统计学处理
3 实验结果
3.1 体外对Hela细胞增殖的影响
CN花提取物对人宫颈癌细胞Hela的增殖抑制作用明显,且与剂量相关,五个剂量组对细胞的增殖抑制率分别为8.96% 、16.32% 、41.07% 、68. 74% 、70. 11%,说明在一定浓度内,药物剂量对Hela细胞增殖抑制作用成正相关。见表1。
3.2 Hela细胞的生长情况及形态学变化
①空白组:细胞成集落、个体较大、饱满、折光性好、形态均一、呈多边形;②5μg/mL CN花提取物组:细胞集落渐变小、折光性减弱、形态稍变圆形;③10μg/mL CN花提取物组:细胞集落渐变小、折光性减弱、形态稍变圆形;④20μg/mL CN花提取物组:细胞集落变小、散在、大小不一、折光性弱、变圆形;⑤40μg/mL CN花提取物组:细胞散在、部分胞体变小皱缩、且轮廓消失;⑥80μg/mL CN花提取物组:胞体皱缩、坏死。见图1。
表1 CN花提取物对宫颈癌细胞Hela增殖的抑制作用(±s,n=3)
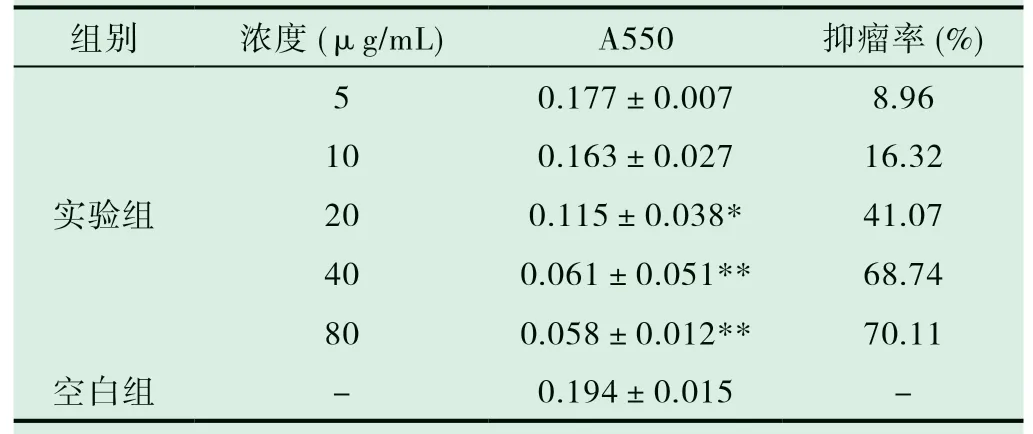
表1 CN花提取物对宫颈癌细胞Hela增殖的抑制作用(±s,n=3)
注:与空白对照组比较,*P<0.05,**P<0.01
?

图1 受试药物作用于Hela细胞3d后细胞的形态学变化及生长情况
3.3 体外诱导Hela细胞凋亡的研究
3.3.1 诱导Hela细胞凋亡的形态学变化
①空白对照组:细胞膜完整、胞质透明、核大且圆;②20ug/mL CN花提取物组:
细胞变小变圆、细胞膜不够完整,核质较皱缩。见图2。
3.3.2 流式细胞术法检测Hela细胞周期变化
流式细胞术法检测结果可知,CN花提取物(20ug/mL)在体外对Hela细胞的细胞周期有较明显作用,G0/G1期细胞从46.8%下降到32.4%,S期细胞从38.7%上升到51.1%,G2/M期细胞变化不明显,其凋亡率为31.2%,较高,与空白组比较有显著性差异。见表2。
4 讨论
宫颈癌是目前临床严重影响妇女健康的最常见恶性肿瘤之一,调查研究显示,我国每年有大约20万妇女死于宫颈癌,其发生率仅次于乳腺癌,位居妇女肿瘤疾患的第2位,且有年轻化的趋势[6,7]。由于宫颈癌恶性程度高,对患者危害巨大,因此探索宫颈癌的防治方案成为当前医学研究的重要课题。

表2 流式细胞术法检测CN花提取物对Hela的调亡率和细胞周期
体外筛选抗肿瘤药物具有用药少、周期短、费用少等优势,且其筛选结果与体内实验的相关性好,因此已被一些研究机构作为常规的抗肿瘤药物初筛手段[8]。本实验通过MTT法证实CN花提取物在体外对人宫颈癌细胞Hela增殖的抑制作用明显,且抑制作用与剂量相关。
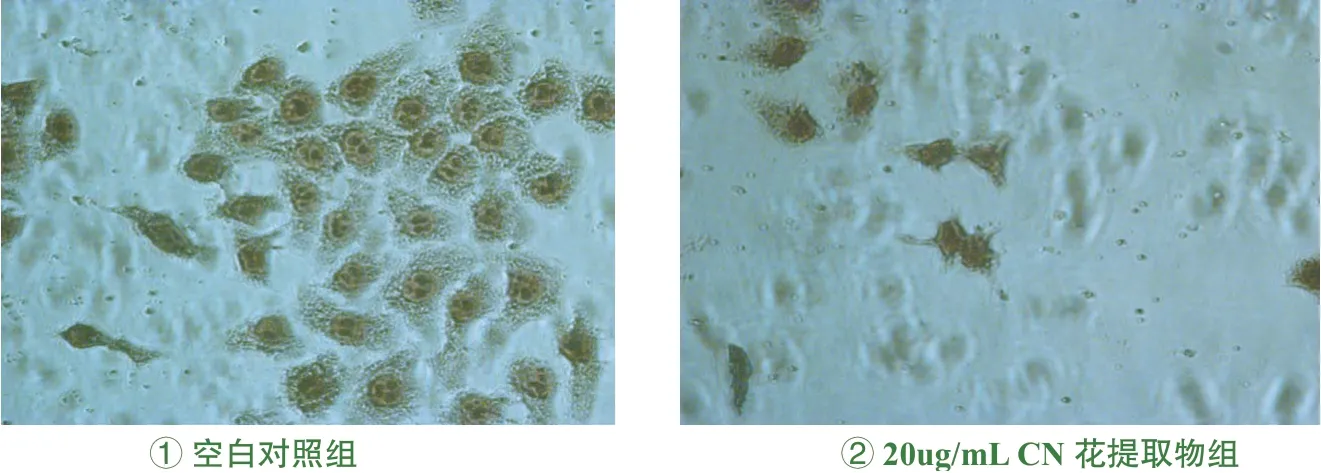
图2 Hela细胞瑞氏-吉姆萨染色后的形态学变化
诱导细胞凋亡是药物抗肿瘤研究的一个重要领域,而观察肿瘤细胞的形态学变化是测定细胞凋亡的一种途径。本实验通过瑞氏-吉姆萨染色法对Hela细胞进行形态学观察,观察到CN花提取物(20μg/mL)与空白组比较,细胞变小变圆,细胞膜不够完整,核质较皱缩。流式细胞术法检测结果进一步表明,CN花提取物(20ug/mL)在体外对Hela细胞的细胞周期有较明显作用,其凋亡率为31.2%,较高,可能是通过阻断细胞由S期进入G2/M期而诱导细胞凋亡。本实验为夜香树花今后的进一步研究和开发提供理论依据。
