动态增强磁共振成像定量参数评估乳腺癌新辅助化疗效果及相关性
2020-08-27佟颖米楠张荣王胜林田春宇丁佩剑
佟颖 米楠 张荣 王胜林 田春宇 丁佩剑
(1承德医学院附属医院,河北 承德 067000;2承德医学院护理学院)
新辅助化疗(NAC)可使乳腺癌原发肿瘤及淋巴结降期,提高患者生存率和生活质量〔1〕,增加保乳手术实施率。然而肿瘤组织对化疗敏感性不同,个体化差异较大,即使同一病理类型、临床分期患者,治疗后肿瘤消退情况也不尽相同,因此如能及早评价化疗效果,能及早发现治疗无效肿瘤,有利于调整治疗策略和方案,合理安排手术时机,减少无谓治疗及过度治疗。定量动态增强磁共振成像(DCE-MRI)通过肿瘤组织血流动力学变化反映血管渗透性〔2,3〕,了解肿瘤生理生化代谢信息等生物学反应及对治疗反应情况,协助临床评价,预测化疗药物的疗效〔4〕。由于目前肿瘤治疗疗效评价标准多样,且缺乏统一标准,DCE-MRI在乳腺癌NAC治疗疗效评价价值尚存有争议,鉴于此,本研究分别以病理完全缓解(pCR)、肿瘤缩退分级(TRG)、肿瘤降期作为乳腺癌NAC疗效评价标准,探讨DCE-MR定量参数预测NAC疗效的价值。
1 资料与方法
1.1一般资料 前瞻性选择2017年4月至2018年12月承德医学院附属医院肿瘤科治疗的189例乳腺癌患者,年龄43~72岁,平均(60.25±8.21)岁;病理类型:原位癌62例,导管癌79例,浸润性小叶癌48例;TNM分期:Ⅲ期85例,Ⅳ期72例,N0 20例,N1 12例。所有患者入院后进行NAC(紫杉醇+卡铂)治疗4 w,然后复查胸部CT或磁共振成像(MRI)判断临床疗效。本研究已经获得医院伦理会批准,并严格遵循伦理学原则,保证患者诊疗安全和隐私,所有患者知情同意本研究并签署同意书。纳入标准:①经病理确诊为乳腺癌;②卡氏功能状态(KPS)≥70分;③患者血常规、肝肾功能、心电图检查符合化疗指征;④预计生存期>3个月;⑤MRI平扫和增强扫描图像质量能满足诊断需求。排除标准:①脑水肿、颅内高压等脑血管病变;②严重器质性心肺疾病;③消化道出血、严重感染、其他部位恶性肿瘤;④妊娠期、经期妇女;⑤恶病质,多脏器衰竭者;⑥严重肝肾功能障碍;⑦治疗中途退出患者。
1.2动态增强扫描方法 仪器为西门子Verio 3.0T高磁场超导型MRI扫描仪,32通道相控阵线圈采集MR信号。患者取俯卧位,双侧乳腺自然悬垂于线圈内。先进行两个不同翻转角度T1-mapping序列扫描,参数设置:重复时间(TR)/回波时间(TE):5.08/1.74 ms值,层厚3.6 mm,间隔:0.72 mm,视野(FOV):260 mm×260 mm,矩阵:192×138,反转角度(Flip angle):2°、15°,采集时间75 s、56 s。应用VIBE序列进行动态增强扫描,参数设置:TR/TE分别为5.08/1.74 ms值,层厚3.6 mm,间隔:0.72 mm,FOV:260 mm×260 mm,矩阵:192×138,Flip angle:15°,共采集35次,第2次采集结束后,用高压注射器经肘前静脉注入对比剂为钆喷替酸葡甲胺,剂量0.2 ml/kg,以2.0 ml/s的速度快速注射,每次采集时间9 s,一次屏气完成。后行常规三维容积内插体部检查(VIBE)常规增强扫描:TR/TE:4.56/2.03 ms,层厚:3 mm,间隔:0.6 mm,层数:72层,FOV:380 mm×315 mm,激励次数:1次,矩阵320×240。
1.3图像处理 所有采集图像资料传输至后台工作站,手动选取异常增强软组织区域为感兴趣区域(ROI),显示病灶最大增强幅度和时间,采用Siemens TISSUE 4D软件包根据增强扫描前采集两个翻转角T1-mapping序列计算获得基线T1值,并计算动态增强扫描后图像T1强化值。在转运常数(Ktrans)图、细胞外血管外空间的体积分数(Ve)图和速率常数(Kep)图上最高信号区域选择含病灶容积ROI,每个病灶选择二个ROI区,取二个区域定量参数Ktrans、Kep、Ve平均值作为该病灶的定量参数。以上均由2名主治以上医师审片,取一致意见作为最终判断结果。所有患者化疗后复查MRI,记录上述指标,并计算Ktrans比值〔化疗前Ktrans值-化疗后Ktrans值)/化疗前Ktrans值〕、Kep比值〔(化疗前Kep值-化疗后Kep值)/化疗前Kep值〕、Ve比值〔(化疗前Ve值-化疗后Ve值)/化疗前Ve值〕,肿瘤缩退率〔肿瘤缩退率=(化疗前体积-化疗后体积)/化疗前体积×100.00%〕。
1.4临床疗效判断 肿瘤T分期〔5〕:依据国际抗癌联盟(UICC)和美国癌症联合会(AJCC)直肠癌第七版TNM分期标准,热化疗前采用MRI影像学分期作为治疗前肿瘤T分期,手术治疗后病理T分期作为治疗后肿瘤T分期,根据前后分期是否降低,将患者分为T分期降期组(术后T分期降至T2期以下)和T未降期组(术后T分期在T2期以上)。
TRG分级〔6〕:0级,完全缓解,无癌细胞残留;1级,中度缓解,残留单个癌细胞或小簇状癌细胞;2级,轻度缓解,残留纤维化肿瘤细胞;3级,广泛残余癌。TRG 0~1级为TRG缓解组,TRG 2~3级为TRG未缓解组。TRG 0级且无阳性淋巴结存在,表示为完全缓解归为pCR组,其余为未pCR组。
1.5统计学分析 采用SPSS25.0软件进行t检验,Pearson相关分析。受试者工作特征(ROC)曲线分析定量参数对食管癌热化疗效果的预测价值,以曲线下面积(AUC)为主要评价指标。
2 结 果
2.1pCR组和未pCR组DCE-MRI定量参数对比 189例乳腺癌患者NAC后pCR 47例(24.87%)。pCR组化疗后Ktrans、Kep值较化疗前显著下降(P<0.05),Ve无明显变化(P>0.05)。pCR组化疗前Ktrans、Ktrans比值、化疗前Kep、Kep比值、肿瘤缩退率明显高于非pCR组(P<0.05),见表1。
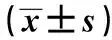
表1 pCR组和非pCR组Ktrans、Kep、Ve的差异
2.2TRG缓解组和TRG未缓解组DCE-MRI定量参数对比 本组TRG缓解74例(39.15%)。TRG缓解组化疗后Ktrans、Kep值较化疗前显著下降(P<0.05),Ve无明显变化(P>0.05)。TRG缓解组化疗前Ktrans、Ktrans比值、化疗前Kep、Kep比值、肿瘤缩退率明显高于TRG未缓解组(P<0.05),见表2。
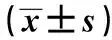
表2 TRG缓解组和TRG未缓解组Ktrans、Kep、Ve的差异
2.3T降期组和T未降期组DCE-MRI定量参数对比 NAC后T降期88例(46.56%)。T降期组化疗后Ktrans、Kep值较化疗前显著下降(P<0.05),Ve无明显变化(P>0.05)。T降期组化疗前Ktrans、Ktrans比值、化疗前Kep、Kep比值、肿瘤缩退率明显高于T未降期组(P<0.05),见表3。
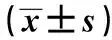
表3 T降期组和T未降期组Ktrans、Kep、Ve的差异
2.4DCE-MRI定量参数与肿瘤缩退率相关性分析 化疗前Ktrans、Ktrans比值与肿瘤缩退率呈高度正相关(r=0.691、0.765,均P<0.05)、化疗前Kep、Kep比值与肿瘤缩退率呈中度正相关(r=0.402、0.312,均P<0.05),化疗前Ve、Ve比值与肿瘤缩退率无关(r=0.075、0.069,均P>0.05)。
2.5DCE-MRI定量参数预测乳腺癌NAC疗效的价值 ROC分析Ktrans比值、化疗前Ktrans预测乳腺癌NAC治疗pCR、TRG、T降期效能高于Kep比值、化疗前Kep,Ktrans比值、化疗前Ktrans预测乳腺癌pCR的效能高于TRG和T降期,见表4,图1。
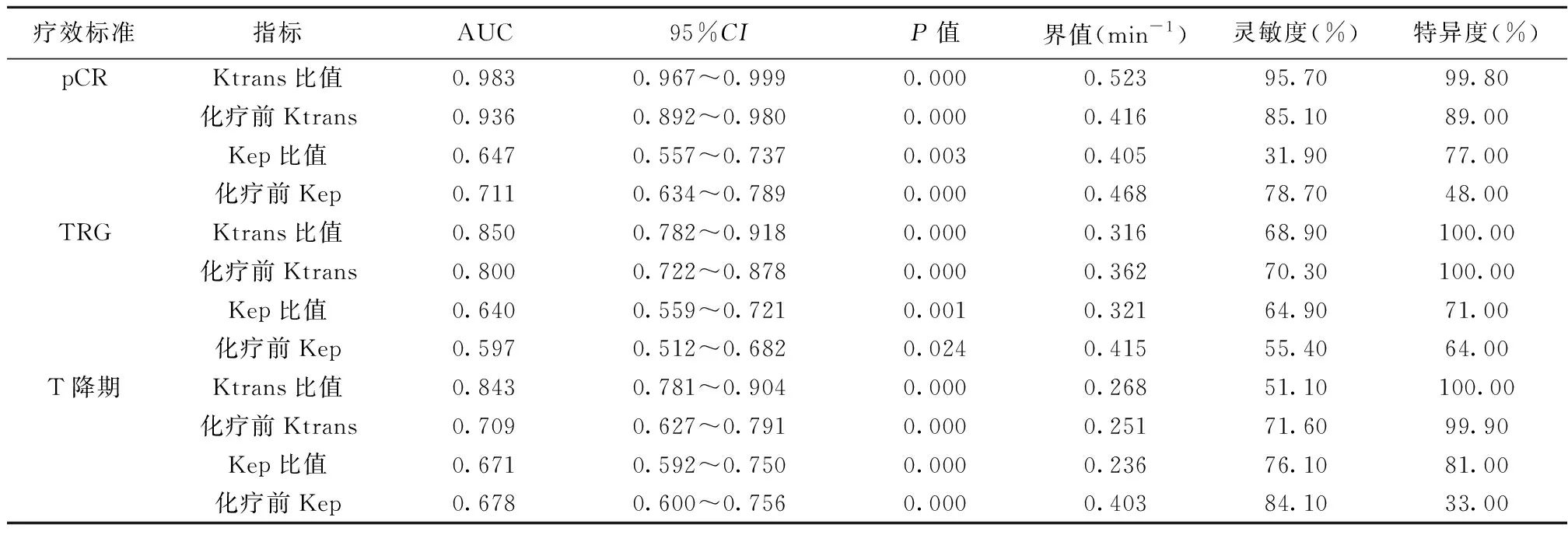
表4 Ktrans、Kep预测乳腺癌NAC疗效的价值
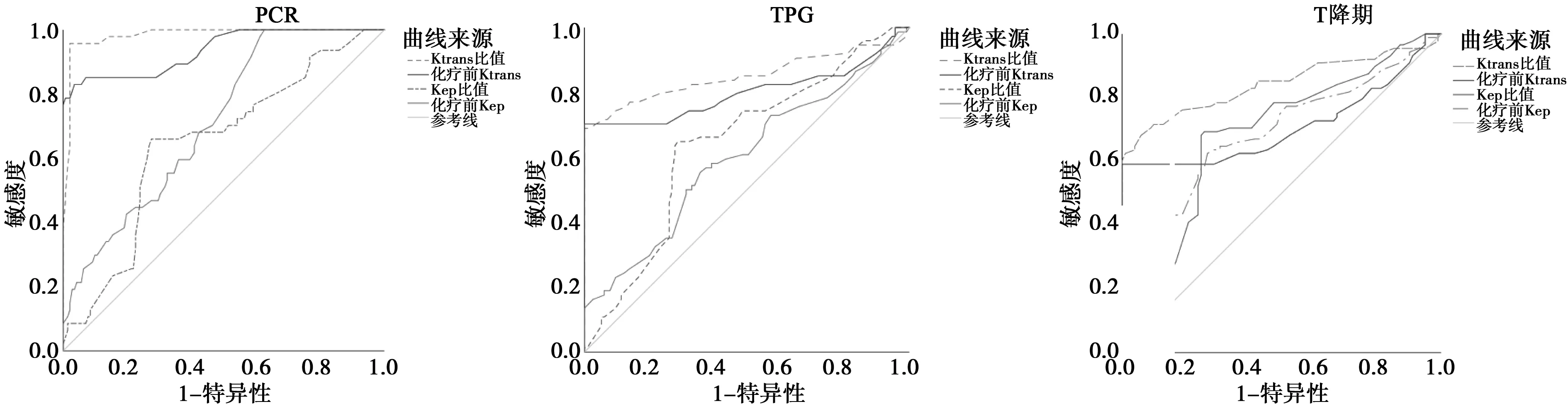
图1 DCE-MRI定量参数预测乳腺癌NAC疗效的ROC
3 讨 论
肿瘤组织的生长取决于新生血管的生成,因此能反映肿瘤组织治疗前后微血管功能变化的指标对于预测肿瘤治疗敏感性及判断预后有重要价值。DCE-MRI作为一种无创、操作简便、能活体测量肿瘤微血管生理学信息的影像手段〔7〕,扫描快速、连续、重复成像方法可获取注入对比剂前后图像及量化参数,可反映肿瘤组织血管分布、药物摄取及滞留功能,对比剂药物动力学定量参数指标与肿瘤治疗反应关系密切〔8〕,目前已经广泛应用于头颈部肿瘤、乳腺肿瘤等临床研究中〔7,9,10〕。
NAC治疗有效在组织病理学表现为癌细胞坏死,血供减少,血管通透性减低,局部组织微血管灌注降低,血管闭塞消退,DCE-MRI可观察到灌注参数降低。Ktrans、Kep、Ve值是DCE-MRI半定量参数,是肿瘤疗效评价中应用较多的指标,其变化与肿瘤治疗反应性存在密切的关系〔11〕。Ktrans值指对比剂从血管转运到组织间隙的能力,反映肿瘤组织毛细血管通透性〔12〕,Kep值指对比剂从组织间隙转移到血管内的能力,恶性肿瘤组织新生血管发育不完全、脆弱〔13〕,新生血管缺乏肌肉外套,通透性高,Ktrans值、Kep值明显增高〔14〕,在化疗过程中肿瘤组织及其血管受到破坏,肿瘤细胞坏死,血管外细胞间隙改变,血供和血氧供给减少,肿瘤组织血管通透性降低,对比剂反流入血量降低,表现为Ktrans值、Kep值降低。目前多数研究以治疗前或治疗过程中Ktrans、Kep、Ve值作为预测NAC治疗反应性的指标,但研究结果尚无一致性结论。童彤等〔15〕报道显示NAC前治疗有效组和无效组的Ktrans、Kep、Ve值即存在明显差异性,NAC前Ktrans、Kep、Ve值可预测NAC治疗反应性。Kim等〔8〕认为放疗过程中Ktrans、Kep值的下降对局部进展期直肠癌患者放化疗疗效的预测具有较高价值。本研究提示化疗前Ktrans值、Ktrans比值、化疗前Kep值、Kep比值可用于判断NAC治疗反应性。但本研究未观察到Ve的变化,Ve比值在不同疗效组间比较均无统计学差异,与相关研究〔16,17〕结果一致。Ve反映ROI组织坏死及组织细胞化程度,Ve值的增高说明肿瘤组织细胞化程度越高〔18〕,因此理论上Ve可反映肿瘤治疗反应性,分析出现上述结果的原因可能与Ve易受病变周围水肿影响,稳定性较差有关,也可能与选择动脉不同有关〔19〕。
本研究结果提示Ktrans比值是反映乳腺癌NAC治疗疗效的潜在可靠指标。Liu等〔20〕观察了151例乳腺癌患者Ktrans、Kep、Ve值与患者预后的相关性,COX风险回归分析发现Ktrans值与乳腺癌患者存活率关系最为密切(HR=5.26,P=0.093),大于Kep值(HR=1.081,P=0.002),Ve值则与乳腺癌患者存活率无关(HR=0.883,P=0.926)。Nakatsukasa等〔21〕也发现Ktrans值的变化与接受贝伐单抗和紫杉醇治疗的乳腺癌患者肿瘤消退明显相关。
pCR、TRG、肿瘤降期均是临床常用的评价肿瘤放化疗疗效的指标,此3项指标评价依据存在明显出入,目前研究采用评价标准不尽相同,导致研究结果差异较大。郑德春等〔22〕研究认为化疗前Ktrans值和治疗过程中Ktrans变化值预测鼻咽癌患者放化疗疗效具有较高的应用价值,与本研究结果一致。本研究结果推测原因为pCR指原发癌症和淋巴结病理检查均无肿瘤细胞,是客观反映病灶退缩、有无肿瘤残存的指标,而TRG1期、T3~4期降至T1~2期患者仍有少量肿瘤残存,本研究乳腺癌患者NAC后TRG缓解率和T降期率高于pCR率,验证了上述推测。建议临床采用pCR作为评价乳腺癌NAC治疗疗效标准,可更真实反映DCE-MRI定量参数预测NAC治疗反应性的价值。
