锶掺杂介孔硅酸镁/聚己内酯复合支架的制备及其性能研究
2020-08-26何贺
何 贺
(上海理工大学材料科学与工程学院,上海 200093)
由于衰老,社会中与骨缺损有关的疾病的发生率急剧增加,近年来,骨骼替代品的需求量增加。骨组织工程学的引入[1],产生了第三代新型生物材料,需要仔细研究材料的选择,以便制造在组织和器官水平上具有最佳生物相容性并同时保持足够机械强度的骨替代物。
镁基生物材料作为潜在的骨修复材料(如含镁生物活性陶瓷[2-3],可降解镁合金)引起了越来越多的关注,这些都是诱导骨骼再生的极好的候选生物材料。因此,开发用于骨修复和替代的新型镁基生物材料是一个重要的追求。
介孔材料是有前途的候选生物活性材料,已被研究用于修复骨[4-5]。据我们所知,很少有先前的研究报道过制备介孔硅酸镁(MMS)用作骨再生材料。因此,合成并表征了MMS,并研究了其体外降解性,生物活性和药物释放活性。另一方面,掺杂具有特定功能的无机组分可以改善硅酸盐生物活性陶瓷的物理化学性质和生物学性质。一些研究人员正在掺杂钛(Ti),锶(Ce)和镁(Mg)金属元素,以改善陶瓷材料的物理化学和生物学特性。例如,Wu等[6]制备含Sr的中孔生物活性玻璃(Sr-MBG)支架,结果表明,将Sr掺入MBG支架中显着刺激牙周膜细胞的ALP活性和成骨相关基因的表达。Young等[7]制备了Sr掺杂的盖琳石(GLN),结果表明随着锶掺入量的增加,可以调节GLN这种生物陶瓷的生物活性和机械强度。研究表明,锶具有促进成骨细胞分化和抑制破骨细胞分化的优势[8]。
本文以聚己内酯为粘接剂,结合三维打印技术成功制备锶掺杂介孔硅酸镁复合支架并研究其理化性能,用于骨缺损的修复治疗,同时详细研究了复合支架的抗压强度、孔隙率、生物活性、可降解性和药物释放等理化性能的影响。
1 实 验
1.1 实验材料
表面活性剂PEO20PPO70PEO20(P123,Mw=5800),BASF;浓硝酸(HNO3,36.0%~38.0%),正硅酸乙酯(TEOS,AR),六水硝酸镁(Mg(NO3)2·6H2O,≥99.0%),硝酸锶(Sr(NO3)2,Mw=211),聚己内酯([C6H10O2]n,Mw=70000),国药集团化学试剂有限公司。
1.2 Sr-MMS/PCL复合支架的制备
采用溶胶-凝胶法合成了含锶的介孔硅酸镁,其中0% Mg、5% Mg、10% Mg、15% Mg被Sr取代的组分分别命名为MMS、5Sr-MMS、10Sr-MMS、15Sr-MMS。使用原硅酸四乙酯(TEOS)作为硅源,聚(乙二醇)-嵌段-聚(丙二醇)的三嵌段共聚物(P123)作为结构导向剂,Mg(NO3)2·6H2O和Sr(NO3)2被用作镁和锶的来源。在此实验中,P123的掺入对于获得有序结构至关重要,以5Sr-MMS的合成为例,简而言之,称取6 g P123和20.83 mL HNO3将其溶于130 mL去离子水中6 h,在磁力搅拌下直至溶液澄清,加入9.12 g TEOS、0.46 g Sr(NO3)2和9.12 g Mg(NO3)2·6H2O于溶液中。在此过程中,温度保持在50 ℃,剧烈搅拌5 h后,将获得的白色悬浮液,在通风橱中放置于室温下。再过24 h,将乳状溶液于80 ℃下放置72 h,使其完全蒸干,离心收集产物,用去离子水洗涤。接下来,将收集的粉末在60 ℃的烘箱中干燥24 h。最后,将干燥后的样品粉末放在马弗炉中于600 ℃下煅烧6 h,以2 ℃/min的速度去除剩余的P123。
本实验使用第四代3-D BioplotterTM(EnvisionTEC GmbH,Germany)打印机打印支架。打印前,如下制备可注射的MMS/PCL浆料。通常,将MMS和Sr-MMS粉末通过400目的分样筛过筛,形成粒径均匀的粉末,粒径小于37 μm。随后,将0.3 g PCL完全溶解在2 mL氯仿中。1.2 g MMS粉末加入PCL溶液中,在室温下快速搅拌至形成可注射浆料。最后,将制得的浆料住入高分子打印管中,该打印管固定在3-D BioplotterTM打印设备上。同时,正方形方块模型(6×6×6 mm3)加载到Bioplotter CAD/CAM软件上,将浆料挤出为一层一层地纤维细丝,最多20层。通过在两个连续的层之间以0和90度绘制纤维来改变结构,其中注射泵的气体压力为2~4 bar,打印速度为5~8 mm/s,针头直径为400 μm。最后,将获得的支架命名为MMS/PCL、5Sr-MMS/PCL、10Sr-MMS/PCL、15Sr-MMS/PCL,将各组支架放在37 ℃烘箱中干燥两天。
1.3 测试与表征手段
利采用BRUKER公司X射线衍射仪(XRD),获得粉体的广角XRD衍射图,小角X射线衍射(XRD)图案是在Bruker AXS Nanostar上使用Cu Ka1辐射测量的。通过Micromeritics Tristar 3020 型比表面仪于-196 ℃下获得N2吸附-脱附等温线,Brunauer-Emmett-Tellwe(BET)和Barrett-Joyner-Halenda(BJH)方法用于确定表面积,孔径分布和孔体积。采用Perkin Elmer 有限公司傅里叶变换红外光谱仪(FTIR)对四组进行红外定性分析,四组Sr-MMS/PCL支架的扫描电镜(SEM)照片在FEI Quanta 450型场发射扫描电镜上获得。支架的抗压强度在2.5 kN的Zwick万能材料试验机上测试,支架的孔隙率运用阿基米德方法测试获得。本实验所用的SBF具体配方测定降解性能。本研究选用牛血清白蛋白(Albumin from bovine serum,BSA)作为模型药物来评价Sr-MMS/PCL复合支架的药物输送性能。
2 结果与讨论
2.1 锶掺杂介孔硅酸镁粉体表征
如图1A所示,在介孔硅酸镁(MMS)和具有不同Sr取代量的Sr-MMS材料的广角XRD图中,四组样品没有特定尖锐的衍射峰,只在2θ=15°~35°时有一个“馒头峰”,这与以前报道的硅酸盐材料类似。表明MMS具有无定形的非晶相结构,溶胶凝胶和P123烧结过程中都没有结晶相生成。此外,图1B为Sr-MMS粉体的小角XRD衍射图谱,在四组样品中均可以观察到大约2θ=1.0时有一个分辨良好的峰,其他三个弱峰值明显可见,将其索引为(100),(110)和(200),是关于p6mm六角形对称性相关的反射,表明其存在高度的六角形介孔结构,结果表明在MMS材料中,Sr部分取代Mg后,介孔结构仍会保留。

图1 粉体的XRD衍射图谱(A);小角XRD衍射图谱(B)
如图2(A)所示,在MMS中用Sr代替Mg并没有改变介孔结构。Sr-MMS具有所有等温曲线均显示IV型,具有明显的磁滞回线,这是由于介孔孔道相关的毛细管凝结所致,表明Sr-MMS具有P6mm介孔孔道。先前的研究表明,介孔硅酸盐和高分子聚合物复合,表现出增强的骨形成生物活性,从而导致更高的化学反应性,从而有利于运送药物,蛋白质和其他生物分子[9]。图2(B)显示了MMS和Sr-MMS的FTIR光谱,在四组样品中均检测到了生物陶瓷的典型Si-O官能团的吸收峰。从图中明显观察到,其中在801 cm-1是由于Si-O的非对称弯曲振动所引起,在1080 cm-1对应的是Si-O-Si对称拉伸振动,进一步表明锶的掺入并没有破坏原来结构。

图2 MMS粉体和Sr-MMS粉体的N2吸附脱附等温线和孔径分布(A);红外图谱(B)
2.2 Sr-MMS/PCL复合支架抗压强度和孔隙率
图3A为根据阿基米德方法测试计算出MMS、5Sr-MMS、10Sr-MMS和10Sr-MMS支架的孔隙率,分别为72.3±2.1%、74.3±1.9%、73.2±1.8%和73.3±2.0%。由于打印过程保持了PCL的用量以及打印参数的一致性,四组支架间孔隙率并未产生明显差异.。图3B为MMS、5Sr-MMS、10Sr-MMS和15Sr-MMS四组支架的抗压强度,分别为3.9±0.24 MPa、4.4±0.19 MPa、4.0±0.16 MPa和3.6±0.16 MPa。因此三维打印技术可以很好的控制支架模型结构使其抗压强度均在2 MPa以上,基本可以满足人体松质骨的要求,因此从内部结构和力学性能来看,四组支架材料均具有骨组织修复的潜力。
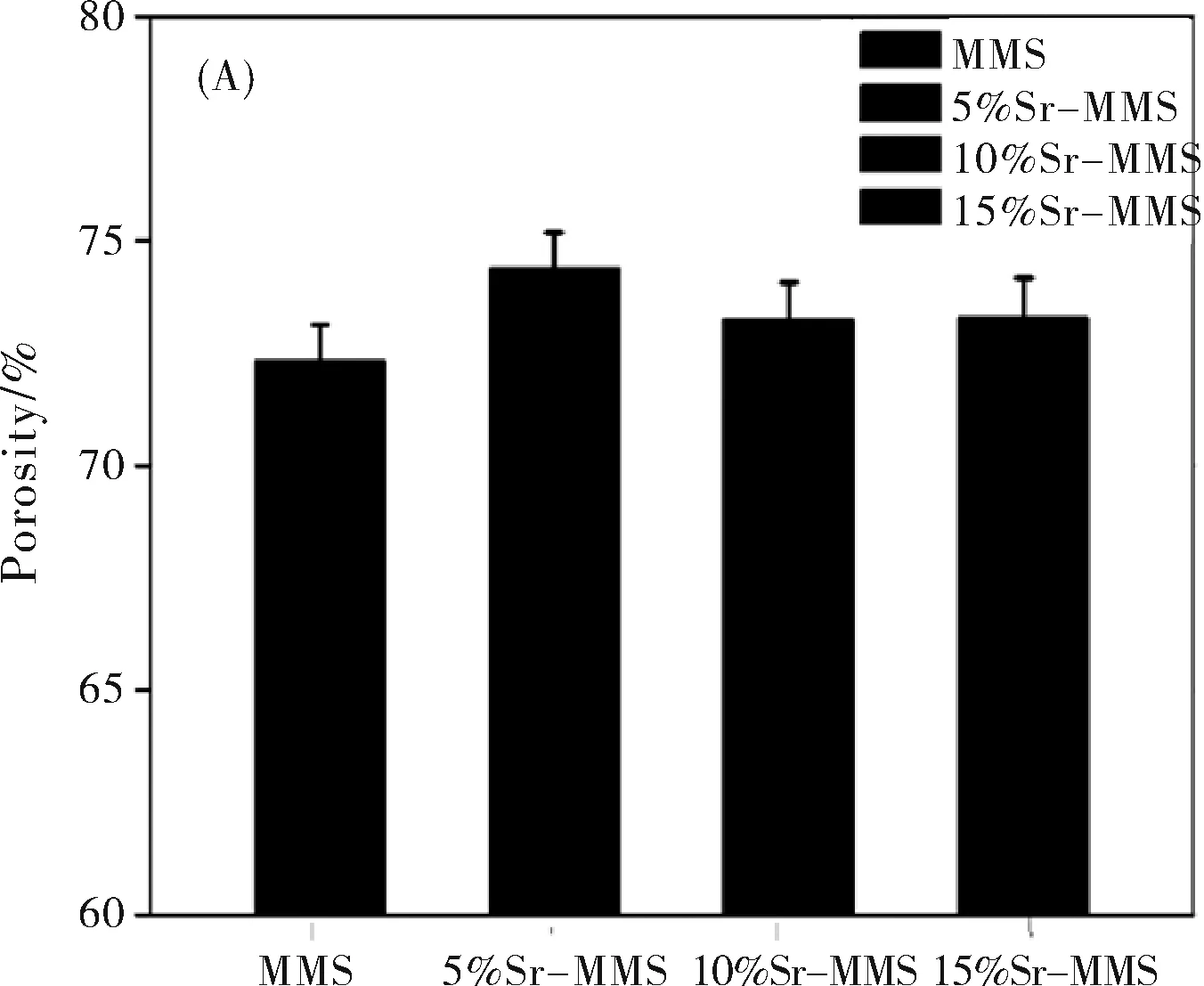
图3 MMSs支架和Sr-MMSs的抗压强度(A);孔隙率(B)(n=3,*表示显著性差异)
2.3 Sr-MMS/PCL复合支架扫描电镜图
图4是四组支架的扫描电镜照片,支架均具有相似的规则的三维连通大孔结构。由高倍SEM照片(A1-D1)可以看出,其表面形貌呈现较小差异,存在类似的表面孔洞尺寸及三维结构,孔径约为400 μm。同时,PCL充当粘结剂的角色,将支架中的粉体均匀包裹,支架的重复性较稳定,因此三维打印技术很好的塑形。

图4 四组支架的扫描电镜照片
2.4 Sr-MMS/PCL复合支架体外降解及其矿化性能
SBF浸泡七天后,各组复合支架表面沉积很多颗粒(图5 A-A1,B-B1,C-C1, D-D1)。颗粒聚集成球体,并在表面沉积融合形成完整的厚层,这是由于功能性Sr-MMS/PCL复合支架浸泡SBF溶液7天后表面有羟基磷灰石的形成。支架表面形貌没有明显差异,说明5Sr-MMS/PCL,10Sr-MMS/PCL,15Sr-MMS/PCL复合支架具有与MMS/PCL支架类似的生物活性,没有随着Sr的掺杂而降低其生物活性。

图5 4组支架在SBF中浸泡7天后的扫描电镜照片
2.5 Sr-MMS/PCL复合支架药物释放性能
如图6所示,四组支架在整个药物释放过程中表现出类似的药物释放曲线,即在刚开始表现出BSA的快速释放,其释放量能达到总装载药物量的70%,然而BSA的释放速度随Sr取代的增加呈现细微的差异。不同的溶出特性可能对速率大小起作用,据报道,一些药物如地塞米松从生物活性硅酸盐玻璃中释放不仅受扩散影响,而且源于玻璃本身的溶解[10]。因此,MMS中Sr对Mg的取代可以控制药物释放率,这种药物释放动力学有利于临床要求初始较高药物剂量随后稳定药物浓度的需求,在一定程度上具有作为骨组织再生的局部给药系统潜力。

图6 MMSs和Sr-MMSs在PBS中的BSA释放曲线
3 结 论
(1)锶的掺杂并没有改变介孔硅酸镁的介孔结构,并且随着锶的掺杂,比表面积降低,由于锶占据了镁的中空位点导致。
(2)制备的Sr-MMS/PCL复合支架抗压强度大于2 MPa,基本能够满足人体松质骨的抗压强度要求。孔隙率良好,有利于细胞。
(3)Sr-MMS/PCL复合支架矿化能力较好,形成羟基磷灰石颗粒,矿化能力有利于后期在人体内的降解。
(4)Sr-MMS/PCL复合支架药物释放缓慢,有利于药物释放动力学的研究。
因此,Sr-MMS/PCL复合支架是一种可望用于骨修复治疗的新型多功能复合支架。
