基于靛红MBH碳酸酯参与不对称环化反应研究进展
2020-08-26刘林林
刘林林
(中国天辰工程有限公司,天津 300400)
Morita-Baylis-Hillman(MBH)反应是指α,β不饱和化合物(主要是指缺电子烯烃)与亲电试剂(醛、酮、亚胺)在叔膦或者叔胺的催化下,生成烯烃α位加成的产物,该反应条件温和、底物适应范围广、产物含有烯烃、羟基等多个官能团等优点(图1)[1]。其产物称为MBH产物,化学家发现,将MBH产物中的羟基转化为碳酸酯(MBH碳酸酯),该化合物在叔膦或者叔胺的作用下,脱除一分子二氧化碳、一分子叔丁醇负离子,其中叔丁醇负离子可以进一步夺取中间体的氢,生成活性碳负离子中间体,可以发生多种类型的环加成反应,其中主要的是[3+2]环加成反应,可以合成多种类型的五元碳环、五元杂环等环状化合物,是目前化学家的研究热点之一[2]。

图1 MBH反应
1 靛红MBH碳酸酯参与的[3+2]环化反应
靛红MBH碳酸酯参与的[3+2]环化反应是最为常见的一种反应类型(图2),也是最基本、最常见的一种反应类型。其中催化剂主要是叔胺,最为常用的是基于金鸡纳碱骨架的叔胺催化剂,也可以是DMAP类催化剂。另一分子反应物常用的是吸电子基取代的烯烃,其中吸电子基取代的烯烃主要包括羰基活化的烯烃[3]、砜基活化的烯烃(或者炔烃)[4]、硝基活化的烯烃等[5]。其产物结构主要是C3位具有五元碳螺环的氧化吲哚衍生物,选择性以及收率都较高。例如,陈迎春课题组报道了一种靛红MBH碳酸酯与基于靛红的活泼烯烃之间的反应,高收率、高对应选择性的生成含有两个螺环的产物,该反应不仅可以放大到克级实验,收率和ee值下降不多,其次反应产物也可以转化成其他更有意义的分子。2015年,还是陈迎春课题组,报道了基于靛红MBH碳酸酯与硝基烯烃之间的不对称[3+2]环加成反应,高效的生成了环戊二烯并螺环化合物,该反应收率最高可达75%,ee值最高可达98%,更有意思的是,原料中的硝基基团,在反应过程中一HNO2的形式脱除了。在不对称有机催化剂C3的作用下,基于靛红MBH碳酸酯与2-硝基苯并呋喃也可以发生[3+2]环加成反应,在此过程中,2-硝基苯并呋喃发生脱芳构化反应,产物中包含一个螺环骨架,收率和选择性都较高。但是对于2-硝基吲哚、2-硝基苯并噻吩等,该[3+2]环加成反应不能发生。

图2 靛红的MBH碳酸酯与活泼烯烃之间[3+2]环化反应
另一种类型的反应物是亚胺类化合物(图3)[6],例如,靛红C3位Boc取代的亚胺,与基于靛红的MBH碳酸酯之间的反应,在手性吡啶类催化剂作用下,可以生成具有双螺环的五元胺类化合物,该反应收率都在90%以上,ee值也很好,反应底物适应性也很广泛。另外产物中的Boc基团也很容易在三氟乙酸的作用下脱除(Adv.Synth.Catal.10.1002/adsc.201700849)。此外,对于环内的亚胺来说,在有机催化剂C5的作用下,也可以与基于靛红的MBH碳酸酯发生[3+2]环加成反应,需要特别注意的是,该MBH碳酸酯中的吸电子基团,氰基的效果最好,酯基也可以参与该反应,但是收率只有中等[7]。该反应的底物范围也很广泛,对于MBH碳酸酯来说,吸电子基团、供电子基基团都可以适用该反应,不同位置的取代基同样能取得较好的效果。总体来说,该反应的选择性基本都是大于20:1,非对应选择性基本都在97%以上,收率也较高。

图3 靛红的MBH碳酸酯与活泼亚胺之间[3+2]环化反应
对于吸电子基取代的高活性的羰基,也可以与MBH碳酸酯发生[3+2]环加成反应,相应的产物为C3位具有五元氧螺环的氧化吲哚衍生物(图4),催化剂为基于金鸡纳碱的叔胺催化剂。相反,在叔膦的作用下,由于磷叶立德更加稳定,生成了共轭烯烃产物[8]。对于该反应的底物范围,其中活泼羰基化合物,羰基的两侧必须要有两个强吸电子基团,例如三氟甲基、酯基等。对于MBH碳酸酯中的吸电子基团,氰基的效果最好,对映选择性从9∶1到大于20∶1,选择性较好,非对应选择性也在93%~99%之间。
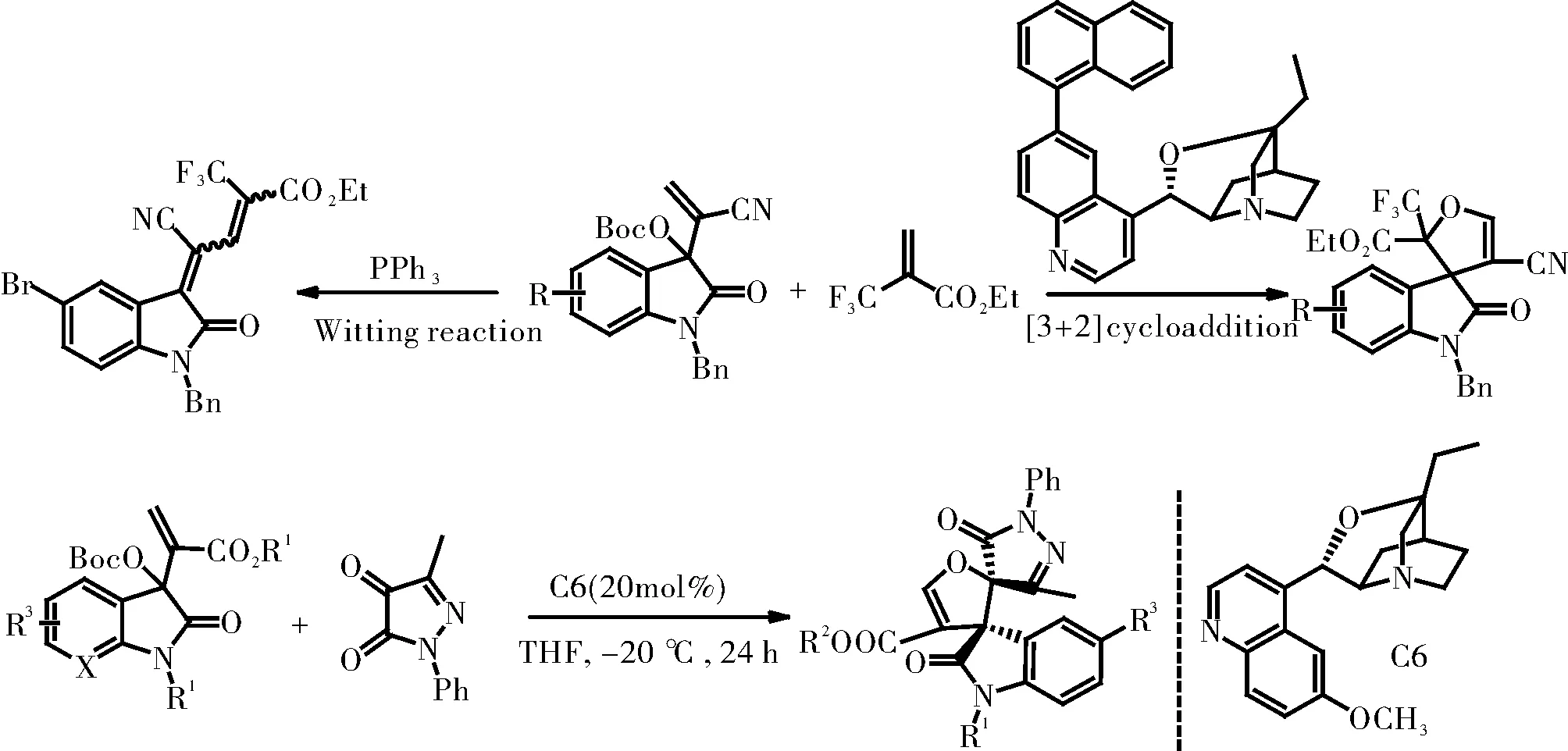
图4 靛红的MBH碳酸酯与活泼羰基之间[3+2]环化反应
吡唑啉酮4,5-二酮,其中5位羰基由于受旁边4位羰基的影响,活性很高,在喹啉类催化剂C6的催化下与靛红的MBH碳酸酯发生[3+2]环加成反应,以较高收率和非对应选择性制备含有两个相邻螺环的化合物。该反应的底物范围很广泛,最终产物可以发生Suzuki偶联。
虽然大多数情况下是叔胺类催化剂,但是叔膦催化剂也可以催化基于靛红的MBH碳酸酯参与的[3+2]环加成反应,这两类催化剂催化的路径相似,但是结果却往往不同,一方面原因就是因为磷叶立德的稳定性更好。例如双膦催化剂Me-DuPhos催化的N-苯基马来酰亚胺与靛红的MBH碳酸酯之间的反应,高收率的得到了C3位具有五元碳螺环的氧化吲哚衍生物(图5)[9]。在该反应的筛选过程中,多种双膦催化剂被研究,其中包括基于连二萘骨架的双膦催化剂,也筛选了单膦催化剂,但是效果一般。该反应的催化路径与叔胺催化相似,先生成含有膦的两性中间体,然后与活泼烯烃发生环加成反应。

图5 叔膦催化的靛红的MBH碳酸酯的[3+2]环化反应
2 靛红MBH碳酸酯参与的[4+3]环化反应
自然界中五元环或者六元环化合物相对其他环状化合物来说,相对更加稳定,因此,在环加成反应中,通常生成五元环或者六元环。但2020年,陈迎春教授课题组报道了基于靛红的MBH碳酸酯参与的[4+3]环加成反应,在叔胺的催化下,硫代橙酮磺酰亚胺与靛红的MBH碳酸酯发生环化反应,与之前工作不同的是,这次并没有生成[3+2]环加成反应,而是发生了[4+3]环加成,生成了苯并噻吩并含氮7元杂环产物(图6)[10]。另外醌类的共轭烯烃类化合物也可以发生类似的[4+3]环加成反应。在该反应中,之所以没有生成[3+2]环加成产物,可能是因为苯并噻吩或者苯环的方向性所致,因为生成[3+2]环加成产物,将破坏上述两类化合物的芳香性。

图6 靛红的MBH碳酸酯的参与的[4+3]环化反应
3 靛红MBH碳酸酯参与的[4+1]环化反应
同样还是陈迎春教授课题组,利用一种醌类化合物与靛红的MBH碳酸酯发生反应,在改变靛红的MBH碳酸酯中吸电子基的位阻,可以将反应从[4+3]环加成的模式变成[4+1]环加成反应。生成了一种苯并呋喃衍生物。该反应收率较好,ee值也很高(图7)[11]。其中靛红的MBH碳酸酯中的叔丁基是调控该反应的关键,这也是第一例叔胺催化的基于靛红的MBH碳酸酯的不对称[4+1]环加成反应。

图7 靛红的MBH碳酸酯的参与的[4+1]环化反应
4 结 语
本综述主要讨论了基于靛红的MBH碳酸酯在环加成反应中的应用,制备各种具有螺环结构的杂环化合物,属于有机小分子催化的范畴,众所周知,有机小分子催化剂相对于过渡金属催化剂来说,具有重要的研究意义,反应条件温和、价格便宜、不引入过度金属杂质,这在药物分子的合成中具有重要的意义。另外,手性是自然界的本质属性,是生命系统中重要的现象之一,手性合成也是药物化学中重要的一环,在某些情况下,两种不同构型的药物分子具有完全相反的药物活性,甚至其中一种构型或者具有强烈的副作用。因此手性合成也具有重要的研究意义,但是不对称有机催化也存在一定的缺陷,比如催化剂的用量较大等,因此本综述对于以后提高有剂催化在药物合成中的应用,具有重要的推动作用。
结合MBH碳酸酯和氧化吲哚两种化合物的优势,靛红MBH碳酸酯在近几年被重视,越来越多的杂环化合物被合成,越来越多的新反应类型被报道,通过本文总结我们发现,[3+2]环化反应已经研究的很透彻了,各种五元杂环化合物被报道,但是其他更大的环的构建还处在初级阶段,报道的也较少。因此发展合适的反应条件,实现基于MBH碳酸酯的新反应以此来构建更大的杂环是将来化学家的重点研究方向之一。此外,尽管有许多杂环化合物被合成,但是对于这些杂环化合物的性质研究,例如抗病毒、抗肿瘤等生物活性,研究的还相对较少,因此,充分发挥产物中氧化吲哚骨架的生物活性,也是将来研究的重点内容。
