鳗草HSF基因家族的筛选与生物信息学分析*
2020-08-26唐学玺
唐学玺,尚 帅,2,臧 宇,陈 军,薛 颂
(1. 中国海洋大学海洋生命学院,山东 青岛 266003; 2. 滨州学院黄河三角洲生态环境研究中心,山东 滨州 256600;3. 自然资源部第一海洋研究,山东 青岛 266061)
植物的发育受到多种非生物胁迫的影响,例如温度,干旱和盐碱化;在漫长的进化过程中,植物进化出了复杂多样的方式以适应温度变化。其中,热应激响应蛋白(Heat shock proteins,HSP)作为热反应的重要响应分子,在植物细胞的修复、蛋白的转录修饰以及信号转导中具有重要的作用[1]。热激转录因子(Heat shock transcription factors,HSF)作为热激反应的主要调控因子,通过上调HSP17,HSP70和HSP90等各种HSP家族的活性[2],参与植物对胁迫反应的转录调控[3-4],也参与植物的生长发育过程[5-6],在热应激反应以及其他非生物和生物胁迫中起重要作用。在植物中,HSF蛋白结构非常保守,通常包括N-端DNA结构域(DBD),寡聚化功能域(OD),核定位信号(NLS)和核输出信号(NES)[7]。HSF基因家族可分为A,B和C三类[7]。其中,A类主要参与热激基因表达,B类没有热激诱导的转录激活活性,可能与A类协同发挥作用,C类的作用尚不清楚[7]。迄今为止,植物HSF基因的研究主要集中于各类作物植物,例如小麦(Triticumaestivum)[8]、水稻[9]、玉米(Zeamays)[10]、番茄(Solanumlycopersicum)[11]和豆类[12]等,但在海洋高等植物中研究较少。
海草(Seagrasses) 是一种生长于热带和温带沿海地区的单子叶被子植物,能够在海水中完成种子萌发、生长和繁殖过程[13]。由海草构成的海草床是典型的近海生态系统之一,在稳定沉积物和为海洋生物提供天然的栖息、索饵、育幼和庇护场所发挥着关键作用,其生态价值可与红树林和珊瑚礁生态系统相媲美[13-14]。近年来,由于全球海洋环境变化和人为活动的影响,导致世界范围内海草床严重衰退。海草床的退化消失将直接导致生物栖息生境丧失、生物多样性锐减以及生物地球化学过程失衡,加剧近海生态系统的脆弱性。鳗草(Zosteramarina) 是一种温带广泛分布的海草类群[15],也是为数不多生活在海洋中的高等植物之一[16],在中国主要分布于辽宁至山东的潮间带和潮下带[17]。鳗草是陆生植物向海洋逐渐迁移进化而来,能够在陆海过渡地带的潮间带地区生存和繁殖,受到潮汐变化的影响,其生长环境存在光照、盐度和温度等环境因子的剧烈变化。在长期进化过程中,鳗草至少经历了三次并行演化[18],进化出多种形态和生理功能,从而能够适应海水的高渗、低光强和光质变化。
为了探究HSF在鳗草适应海洋环境过程中的转录调控作用,有必要采用生物信息学手段,深入研究HSF家族信息及其分子进化特征。基于上述目的,本研究以鳗草基因组以及转录组测序结果为基础[19],对鳗草HSF家族进行序列特征、基因结构、系统发育关系、顺式作用元件和表达情况分析,以期为鳗草HSF基因家族功能研究奠定基础,本研究结果对揭示海洋高等植物的环境适应分子机制具有重要的理论意义。
1 材料与方法
1.1 鳗草HSF基因家族成员鉴定和特征分析
鳗草的基因组序列、编码蛋白氨基酸序列和cDNA序列来源于phytozome v12.1数据库(https://phytozome.jgi.doe.gov)和NCBI(https://www.ncbi.nlm.nih.gov)。下载至本地电脑后,基于本地Blast软件,构建本地数据库。以拟南芥(Arabidopsisthaliana)21个HSFs家族的氨基酸作为种子序列,搜索鳗草基因组和蛋白质数据库,筛选获取e值小于-20的序列作为ZmHSFs候选基因。为更好确定获取基因的准确性,本研究结合Pfam蛋白结构域数据中HSF家族的DNA结构域(PF00447),利用HMMER软件构建隐马尔可夫模型,并以此作为种子序列检索鳗草蛋白质数据库,获取HSFs的候选基因。综合两种筛选方式所获取基因,利用SMART软件对候选基因进行保守结构域的鉴定。此外,利用 ExPasy(https://web.expasy.org/protparam)对蛋白质的理化性质进行分析。
1.2 鳗草HSF基因家族结构和蛋白保守序列分析
使用基因结构显示系统GSDS 2.0(http://gsds.cbi.pku.edu.cn)[20]绘制鳗草HSF基因家族的基因结构示意图。使用MEME(http://meme-suite.org/doc/download.html)对所筛选的鳗草HSF蛋白的保守基序进行分析[21],基序搜索数目为5,其他参数为默认设置。
1.3 鳗草HSF基因家族的系统发育分析
为探究鳗草HSF基因家族的系统发生关系,使用MEGA 6.0软件,利用邻接法构建鳗草、同属的Zosteramuelleri和拟南芥(模式种)3个物种的HSF基因家族的系统发育树,自检值设置为1 000,并使用iTOL在线软件分析(http://itol2.embl.de)。
1.4 鳗草HSF基因家族成员启动子区顺式作用元件分析
从鳗草基因组数据库中获取HSF基因家族成员转录起始位点上游2 000 bp序列,并利用PlantCARE在线数据(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)[22]对启动子区的顺式作用元件进行分析。
1.5 鳗草HSF基因家族的表达分析
鳗草HSF基因家族在不同器官中的表达情况数据来源于NCBI数据库(http://www.ncbi.nlm.nih.gov/sra),SRX978554-SRX978576[19],对下载数据核对后,利用TBtool程序分析这些HSF基因的表达数据并制作基因表达热图[23]。
2 结果
2.1 鳗草HSF转录因子鉴定及其蛋白理化性质预测
利用phytozome v12.1数据库和NCBI数据中鳗草的基因组数据,共鉴定出了12个鳗草HSF转录因子,经过Pfam数据库和SMART功能结构域的鉴定,最终确定了11个鳗草HSF基因。根据拟南芥HSF转录因子亚家族的划分和命名,结合鳗草拉丁名缩写Zm(Z.marina),对鳗草HSF转录因子进行分类和命名,共划分出了7个HSFA亚家族成员和4个HSFB亚家族成员,在鳗草基因组中并未鉴定出HSFC亚家族成员。其中,HSFA包含五个亚家族,HSFB包含两个亚家族;HSFA7亚家族所包含的数目最多,共有3个亚家族成员。
ZmHSFs大小差异较大,最小的ZmHsfA2a仅编码123个氨基酸,最大的是ZmHsfA5,编码416个氨基酸,其分子量也最大(43.06 kD)。ZmHSFs理化性质分析结果显示(见表1),大部分的等电点小于7,只有4个大于7,分别是ZmHsfA7a、ZmHsfA7b、ZmHsfB2a和ZmHsfB2b。蛋白亲疏预测结果显示,11个HSF蛋白总平均疏水指数均小于0,均为亲水性蛋白。亚细胞定位结果显示,有10个HSF蛋白定位于核膜中,仅有一个定位于细胞质中。
2.2 鳗草HSF家族基因结构与蛋白保守基序分析
ZmHSFs基因结构分析结果表明,11个ZmHSFs基因结构中均不含有内含子,相同的ZmHSFs亚家族具有相似的基因结构(见图1)。

图1 鳗草HSF基因结构示意图
ZmHSFs蛋白的保守基序分析结果显示(见图2),同一亚家族的HSF基因的保守基序较为相似,如ZmHsfA7a/ZmHsfA7b/ZmHsfA7c、ZmHsfB2a和ZmHsfB2b、ZmHsfB4h和ZmHsfB4b每组基因亲缘关系较近,它们的基序也相似。11个HSF蛋白基序中均含有Motif 1和Motif 2,Motif 3存在于10个鳗草ZmHSFs蛋白中,由此推测上述3个Motif在鳗草蛋白基序中分布较广,具有较强的保守性。
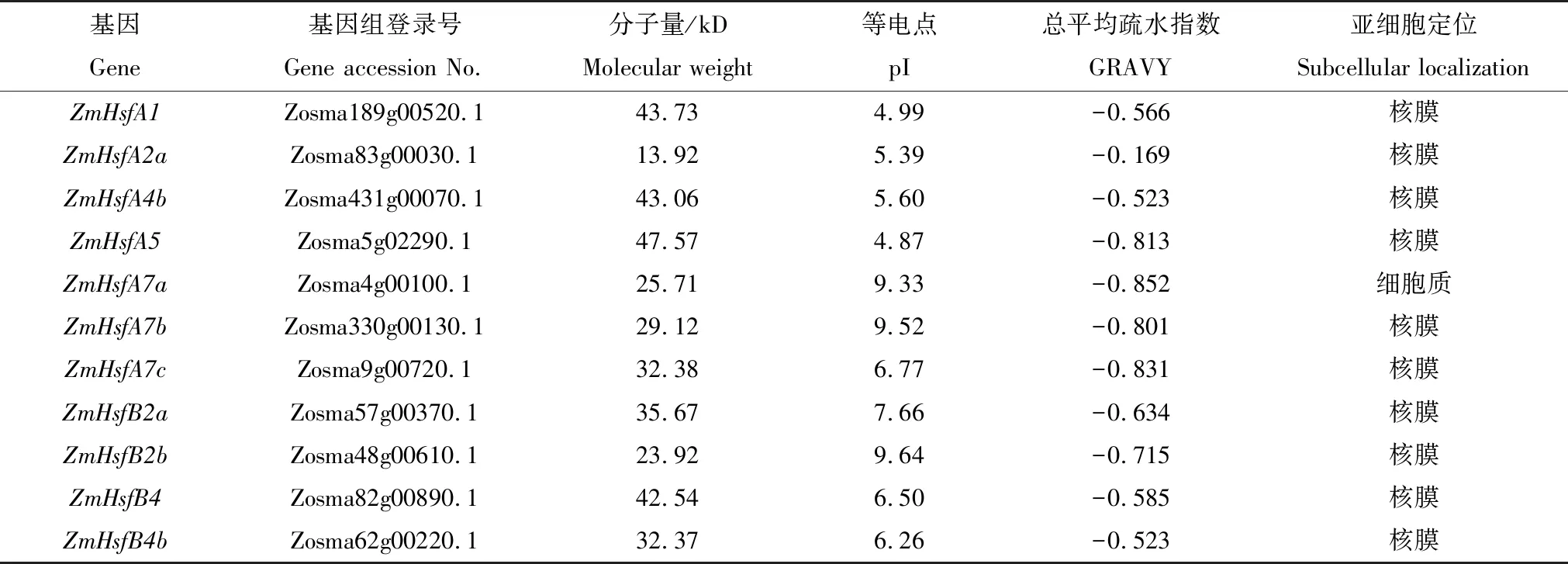
表1 鳗草11个HSF基因家族成员及其理化性质
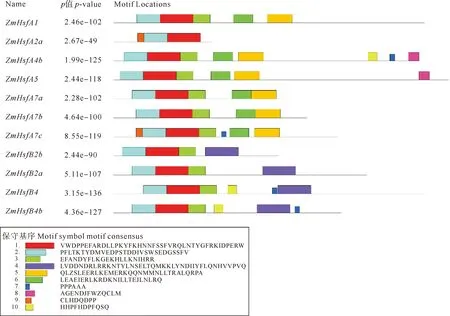
图2 鳗草HSF蛋白保守基序分析
2.3 鳗草HSF基因系统发育分析
系统发育树分析结果显示,HSF基因可以划分为两大分支,其中HSFB基因组成一支,HSFA和HSFC组成一支(见图3)。其中,AtHSFC1与HSFA基因家族聚到一起,并未单独聚为一支;鳗草各HSF基因与拟南芥和Z.muelleri各亚家族基因聚到一起;在各亚家族内部,大部分鳗草HSF基因与ZmuHSF聚到一起,部分ZmuHSF与AtHSF聚到一起。
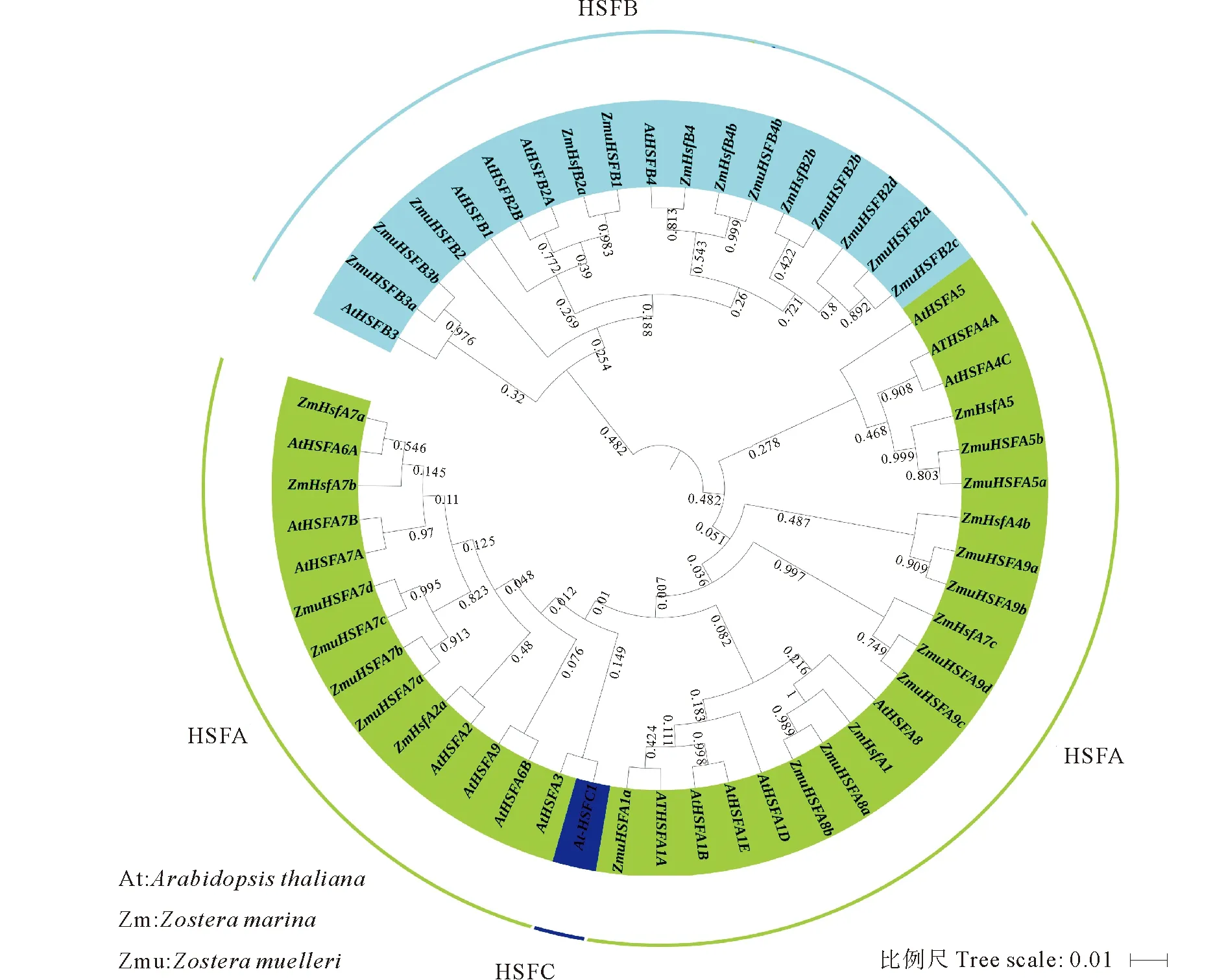
图3 基于鳗草、拟南芥和Zostera muelleri HSF的氨基酸序列系统进化分析结果
2.4 鳗草HSF基因家族启动子顺式作用元件分析
ZmHSFs的顺式启动子元件分析结果表明,各ZmHSF均含有CAAT-box和TATA-box,主要为启动子和增强子区共有顺式作用元件;CGTCA-motif元件和TGACG-motif元件存在于大部分的鳗草HSF基因中,为MeJA响应相关顺式作用调控元件。光反应响应模块相关的元件普遍存在于鳗草HSF基因中,例如AE-box,Box4,GT1-motif,G-box,GA-motif和TCT-motif等;参与抗逆相关的调控元件例如ARE、LTR和MBS等也存在于多个鳗草HSF基因中;参与激素调节的相关调控元件,例如TCA-element和ABRE存在于多个ZmHSFs基因中(见表2、3)。
2.5 鳗草HSF基因家族在不同器官的差异表达分析
通过已报道转录组数据,分析ZmHSFs基因在不同器官中的表达情况(见图4)。结果显示,在各器官中均检测到HSF基因的表达。其中,鳗草雌花发育前期和后期的表达结果表明,ZmHsfA5、ZmHsfB2a和ZmHsfB4b在雌花发育前后存在表达差异,其余ZmHSFs差异不明显。通过比较HSF基因在不同器官中的表达情况发现,ZmHsfA4b、ZmHsfA1和ZmHsfB2a在各个器官中均有较高水平的表达;ZmHsfA7b和ZmHsfB2b虽有表达,但相比于其他HSF基因,其表达水平较低。此外,同一基因在不同器官中存在表达差异,例如ZmHsfA7b在雄花和营养枝中相对表达水平较高,但在根中表达水平较低;ZmHsfA5和ZmHsfA4b在营养枝和根中表达较高,在雌花与雄花中表达较低;ZmHsfA2a在雄花中表达水平较高,而在其他器官中表达较低。

表2 鳗草HSF基因启动子顺式作用元件的种类与数量
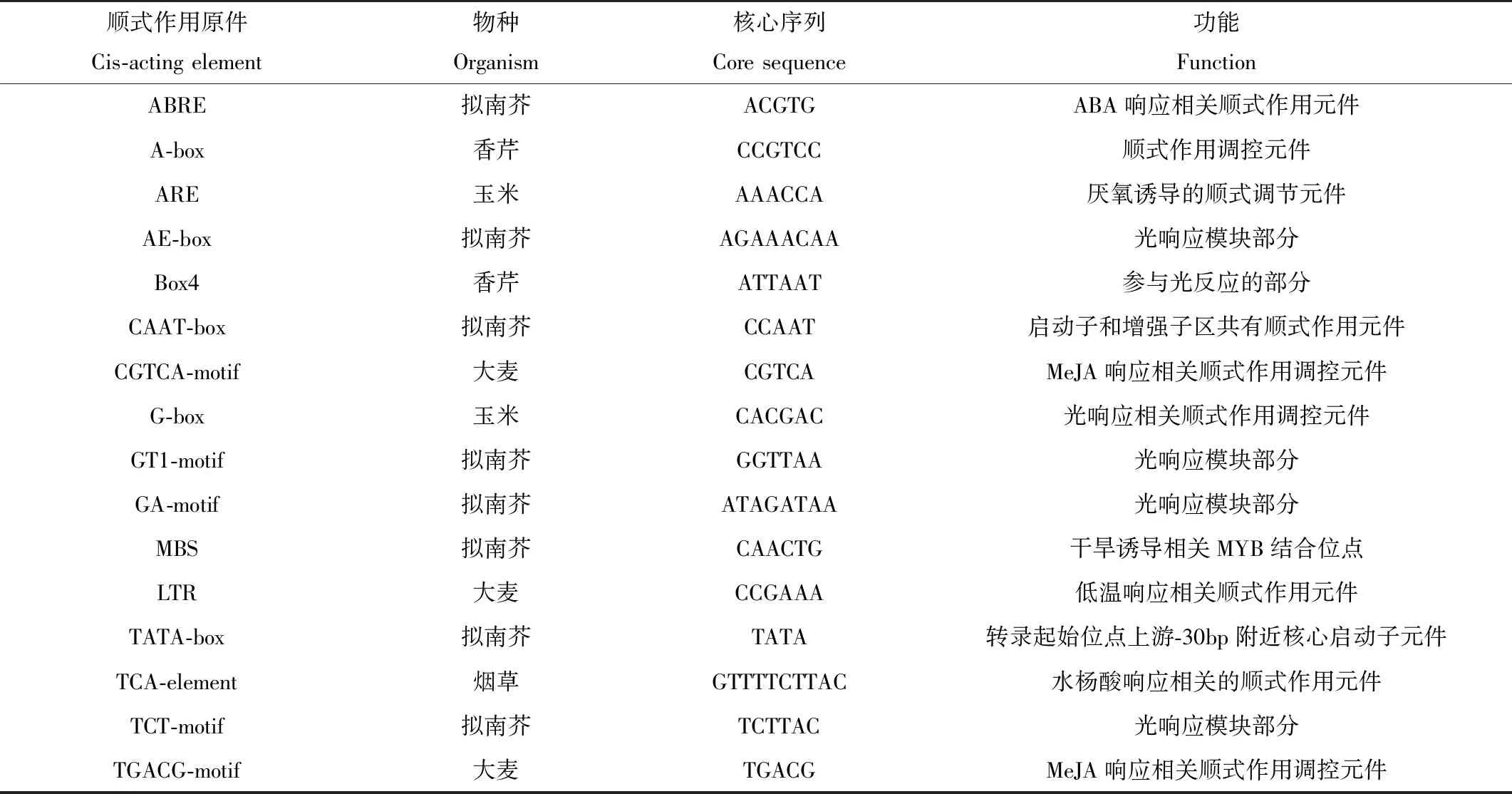
表3 鳗草HSF基因启动子顺式作用元件核心序列与功能
3 讨论
本研究基于已发表的鳗草基因组信息,共鉴定出11个鳗草HSF基因,仅包含HSFA和HSFB两个亚家族,并未鉴定出HSFC亚家族。自然条件下,高温、盐碱和干旱等非生物胁迫对植物的生长、发育和繁殖会产生不利影响。研究表明,植物HSF基因可响应多种非生物胁迫,在植物应对各种非生物胁迫中起着重要的作用,近年来引起了广泛关注[3-4]。HSF基因家族成员在多个物种已被鉴定,但在海洋生物中,尤其是在对近岸海洋生态具有重要作用的海草中研究较少。鳗草作为适应在海洋环境中生长和繁殖的多年生被子植物[19],分析其HSF基因家族对研究海洋高等植物适应海洋环境的分子机制具有重要意义。前人研究发现,植物在进化过程中出现了单、双子叶植物特有成员,例如HSFA8和HSFB3为双子叶植物所特有,HSFA9和HSFC2为单子也植物所特有[24],本研究发现鳗草中缺少上述四种亚家族基因,推测可能是与其二次入海相关的进化过程有关,导致了部分HSF基因的缺失。系统发育分析表明,鳗草、拟南芥和Zosteramuelleri的HSF基因系统发育树分为两大分支,HSFB单独一支,HSFA和HSFC聚为一支。前人结果发现,HSFB亚家族通常单独形成一支,而HSFC在一些物种中单独一支,但在许多物种中,HSFC和HSFA可以聚到一起[25],与本研究结果一致。为更好的探究植物HSF基因的数目规律,本研究汇总HSF基因家族在35个物种中的数目特征(见表4)。结果表明所有物种中HSF基因数目存在一定的差异性,与高等植物相比,HSF基因在三种藻类植物、苔藓植物(小立碗藓)和蕨类植物(江南卷柏)等低等植物中数目较少。大量研究表明,基因复制不仅可以增加基因的数量,而且是产生新基因的途径,有利于植物适应各种环境[47-48]。HSF基因家族成员的数量与基因组复制事件有关之外,植物进化过程中所受的选择压力也会影响HSF基因家族的数目,鳗草在演化过程中经历了至少三次并行演化事件,适应陆地生活后又返回海洋环境中[26],我们推测鳗草HSF基因数目相对其它高等植物较少的原因是由于其在进化过程中的二次入海,导致部分基因数目在进化中丢失,从而使鳗草的HSF基因家族数目少于其他陆生高等植物。
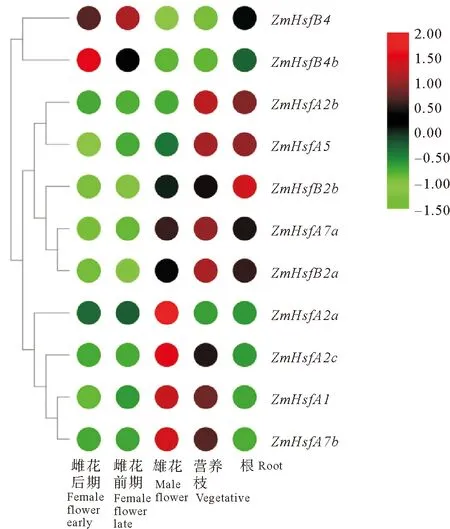
图4 鳗草HSF基因在不同器官中表达分析
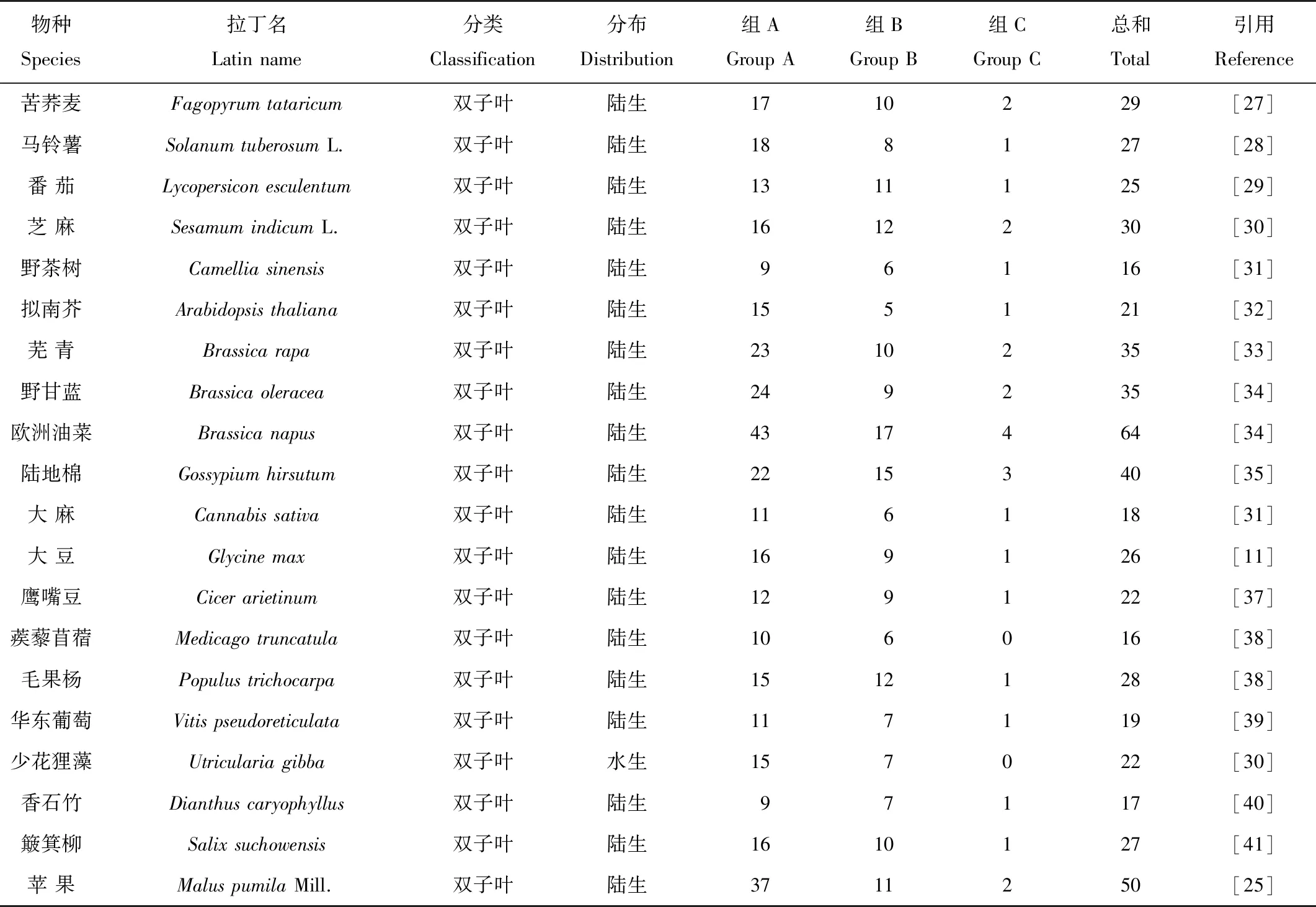
表4 35个物种HSF基因家族家族汇总
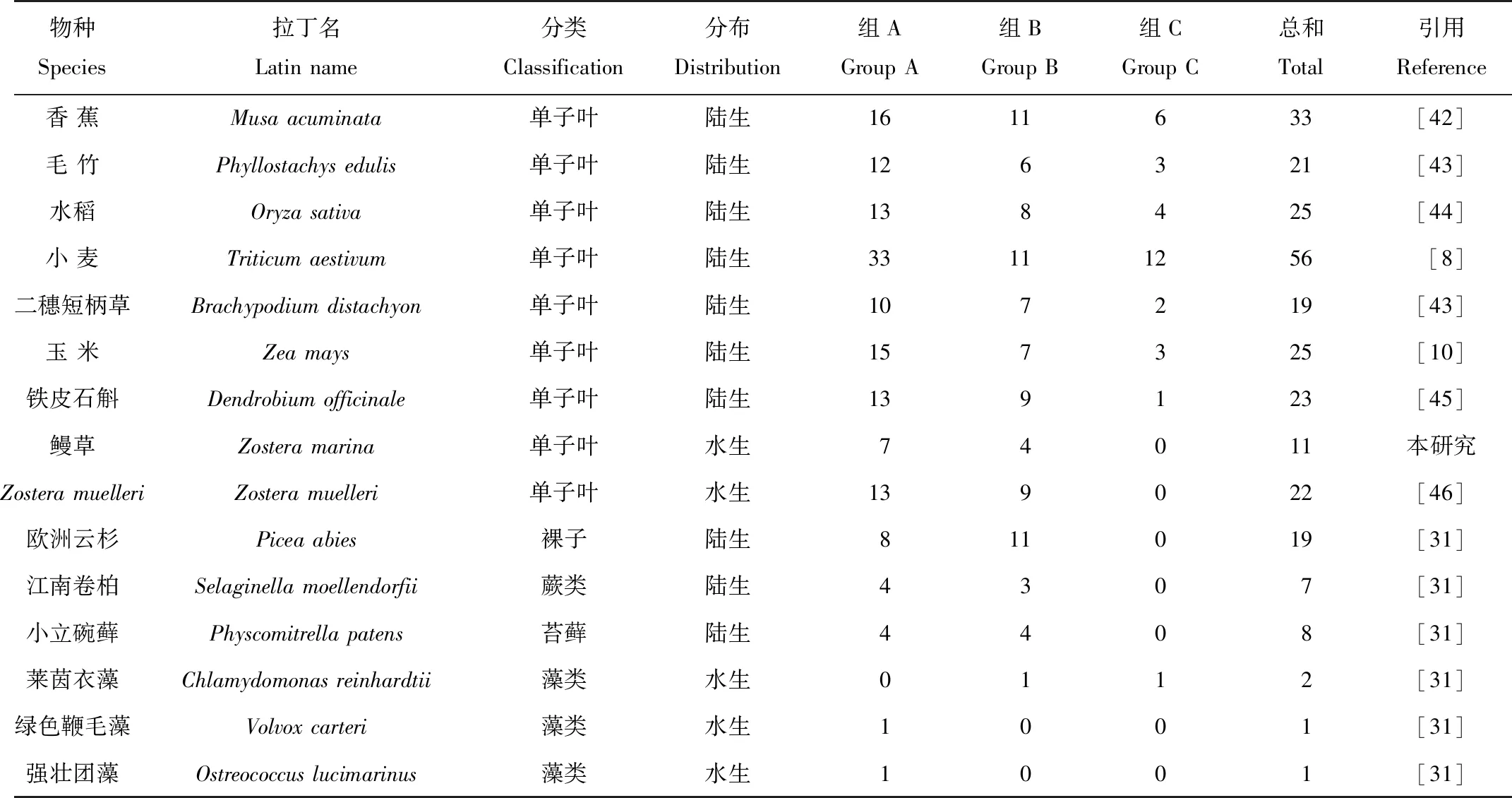
续表4
植物体内信号传递过程较为复杂,同一转录因子可能参与多种信号的表达。前人研究发现,多种信号通路可能参与植物应对温度等非生物胁迫[24,49]。ZmHSFs基因顺式作用元件分析结果显示,ABRE、AE-box,Box4,GT1-motif,G-box,GA-motif、TCT-motif和LTR等普遍存在,说明ZmHSFs很可能同时受到温度和光照等多种非生物因素的调控[24];我们推测在海草生存环境中,光照的变化可能对鳗草生长造成很大的影响,因此在其调控元件中,存在多个与光反应模块相关的顺式作用元件。基因的表达模式与其功能密切相关。近年来,人们对鳗草抗逆基因响应环境胁迫的转录表达特征进行了广泛的研究,特别是温度[50]和盐度[51-52]影响下的基因表达特征,但是围绕HSF基因家族的研究较少。本研究分析了11个ZmHSFs在三种器官中的表达模式,结果表明大部分ZmHSFs存在一定的器官表达差异性,如营养枝和根中的ZmHsfA5和ZmHsfA4b,及雄花中的ZmHsfA2a。HSF基因在不同器官中表达模式存在较大差异,这在其他植物也存在类似的研究结果。Guo等[53]研究了辣椒(Capsicumannuum)HSF基因在不同器官和不同发育时期的表达谱,发现CaHsfs存在组织表达特异性和时期表达特异性,推测CaHsfs广泛参与了辣椒的生长发育过程。王云等对龙眼(Dimocarpuslongan)HSF基因家族不同成员在不同组织器官的表达分析,发现花芽和花蕾的表达量明显高于其他器官,推测DlHsf可能参与龙眼花的发育过程[54]。而在鳗草中,以其他器官相比,ZmHSFs主要在营养枝中相对表达量较高,推测ZmHSFs可能与营养枝的生长发育过程相关。
4 结语
本研究基于已发表的鳗草基因组信息,鉴定出了11个ZmHSFs,包含HSFA和HSFB两个亚家族,并未鉴定出HSFC亚家族,基因数目明显少于其他高等植物,推测二次入海导致鳗草HSF基因数目在进化过程中丢失。鳗草HSF基因顺式作用元件中存在ABRE、AE-box,Box4,GT1-motif,G-box,GA-motif、TCT-motif和LTR等,其表达调控很可能同时受到温度和光照等多种非生物因素的影响。转录表达数据显示,鳗草HSF基因存在基因表达差异和器官表达差异。本研究对ZmHSFs基因进行了生物信息学分析,可为今后深入研究该家族在海草中基因的结构特征和功能提供参考。
