深圳福田红树林保护区自由生活海洋线虫群落特征研究*
2020-08-26崔春燕徐华林刘晓收
华 尔,崔春燕,徐华林,刘晓收,3**
(1.中国海洋大学海洋生命学院,山东 青岛 266003; 2. 广东内伶仃福田国家级自然保护区管理局,广东 深圳 518040;3.中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003)
红树林生态系统(Mangrove ecosystem)是复杂而独特的生态系统,由红树木本植物群落、其他陆地植物群落、动物群落、微生物群落等生物要素及其赖以生存的环境要素共同组成,主要分布于热带、亚热带海岸带、河口等地[1],具有御风护岸、净化水体、保护生物多样性等重要生态功能。红树林生态系统具有高生物多样性、高生产力、高归还率、高分解率的特性[2-3]。目前,世界红树林总面积估计为17万km2。它们对全球生态系统及人类的社会、生活均产生重要的作用,对维持当地及全球生态平衡具有重要的价值[4-6]。
自由生活海洋线虫(Free-living marine nematodes,以下简称海洋线虫)是小型底栖动物中分布最广泛、数量最多的一个类群,通常占小型底栖动物数量的60%以上[7],是红树林生态系统中重要的组成部分。全世界红树林生境小型底栖动物(包括海洋线虫)研究已相继开展,在澳大利亚[8-11]、巴西[12]、法国[13]、非洲[14-15]、马来西亚[16-17]、越南[18-19]、印度[20-22]以及中国[23-41]均有报道。这些研究揭示了不同地区红树林生境海洋线虫群落的时空变化特征及其受控因子,促进了对红树林线虫群落结构和功能的认识。同时,有研究探讨了海洋线虫与红树林凋落物的关系,在红树林复杂的碎屑食物链中,海洋线虫不仅是消费者,同时也承担分解矿化有机碎屑的重要作用[42-44]。另有一些研究探讨了海洋线虫对踩踏[45]、清理[46]等物理扰动的响应,不断在更新我们对海洋线虫在红树林生态系统中功能的认识。
中国红树林主要分布于海南、广西、广东、福建、浙江,以及香港、澳门和台湾。现有红树林总面积约316.94 km2(不含港澳台),为全世界红树林总面积的0.19%,广东、广西、海南省红树林分别占现有红树林总面积的46%、32%和17%[47]。就中国红树林生境小型底栖动物(包括海洋线虫)研究而言,福建省相关研究最多,涉及云霄县漳江口、龙海九龙江口、厦门湾、泉州洛阳江口、宁德湾坞等红树林分布区,详细研究了不同红树林生境小型底栖动物的空间分布及季节动态、海洋线虫群落结构及营养结构[23-33]。此外,在海南东寨港红树林[34-36]、广东湛江红树林[37]、广西防城港东湾红树林[38]、深圳福田红树林[39-41]和香港红树林[43],也开展了小型底栖动物相关研究。这些研究极大地丰富了中国红树林小型底栖动物研究,为深入了解中国境内红树林生态系统的结构和功能提供了大量的数据支持。
深圳福田红树林自然保护区地处中国深圳湾东北部,总面积约368 hm2,是中国面积最小的国家级自然保护区,也是中国唯一在城市腹地的保护区[48-49]。随着深圳城市建设和经济的快速发展,深圳湾滨海湿地面积明显缩减,红树林生态系统严重退化。深圳湾生态系统的结构和功能一直受到诸多学者的关注,对深圳湾底栖生态系统也已有详实的研究[50-51]。但是,迄今为止,我们对福田红树林小型底栖动物(包括海洋线虫)群落结构和功能的认识非常有限,仅有蔡立哲等[39]、蔡立哲[51]、谭文娟等[40]、朱慧兰[41]等的研究结果可供参考。海洋线虫在红树林生态系统中的结构和功能研究亟待补充。本文根据2013年7月至2014年1月采集的样品,研究深圳福田红树林保护区不同区域海洋线虫丰度及群落结构特征,目的是:(1)揭示该地区海洋线虫丰度的时空变化特征及受控因子;(2)了解海洋线虫群落结构的时空变化规律及与环境因子的相关性,探析海洋线虫在红树林生态系统中的作用。本研究结果不仅可以补充该红树林生境海洋线虫群落结构的研究,更为深入了解海洋线虫在该红树林生态系统中的功能提供数据支持,为红树林生态系统健康评价指标体系的构建提供参考,为红树林滩涂生境的生态修复提供指导。
1 材料和方法
1.1 采样区域和时间
本研究分别于2013年7月(夏季)、2013年10月(秋季)、和2014年1月(冬季),在深圳湾北部福田红树林自然保护区(22°30′N~22°32′N, 113°56′E~114°3′E)选择四个区域采集沉积物样品,分别是:凤塘河口(F)、观鸟屋(G)、沙嘴码头(S)和基围鱼塘(见图1)。 其中,在F、G、S区,分别设置断面,选取高潮带(H)、中潮带(M)、低潮带(L)站点采集样品,记为站点FH(114°00′59″E,23°31′19″N)、FM(114°00′59″E,23°31′15″N)、FL(114°00′59″E,23°31′12″N)、GH(114°00′07″E,23°31′40″N)、GM(114°00′08″,23°31′35″)、GL(114°00′08″,23°31′30″)、SH(114°01′49″,22°30′41″)、SM(114°01′47″,22°30′40″)、SL(114°01′46″,22°30′39″);基围鱼塘仅设一个站点,记为Y(114°00′54″,22°31′28″)。F区断面位于凤塘河口,G区断面位于观光浮桥下,S区断面位于废弃码头,均为光滩,无红树植被覆盖;Y区位于红树植物分布区内,但植被类型单一。四个研究区域因地理位置差异,沉积环境特点明显不同,有利于分析海洋线虫群落动态以及与环境因子之间的相关性。
1.2样品采集方法
利用内径为2.9 cm的取样管(注射器改造而成)随机采集3个芯样,取样深度为11 cm。样品取出后,立即用5%甲醛溶液固定保存。以相同的方法采集两个芯样,装入封口袋,置于-20 ℃冰箱冷冻保存,用于沉积物叶绿素a(Chl-a)含量、脱镁叶绿酸(Pha)含量、有机质含量(OM)、沉积物粒度参数等环境因子的测定。利用YSI 600XLM-M水质分析仪现场测定沉积物间隙水温度(Temp)和间隙水盐度(Sal)。由于采样及保存条件不佳,导致夏季FH、FM、FL三个站点部分环境因子样品缺失。
1.3 室内分选及样品处理
小型底栖动物的分选:向野外采集获得的沉积物样品中加入3~5 mL虎红溶液,搅拌混合均匀后,静置染色24 h。完成染色后,将样品倒在500和31 μm孔径两层网筛上,用自来水冲洗,去除样品中的粘土和粉砂。利用硅溶胶(Ludox-TM)离心漂浮法对截留于31 μm孔径网筛的沉积物进行离心,重复离心三次,收集上清液。将上清液再次通过31 μm孔径的网筛,滤掉硅溶胶溶液,并使用自来水将截留于网筛上的样品冲洗、转移至培养皿中,在解剖镜下按小型底栖动物类群挑选生物并计数[52]。
海洋线虫的鉴定:分选获得的海洋线虫,经过虫体透明后制成永久封片,在显微镜下观察并鉴定至属或种的水平[53]。根据线虫的口腔类型和取食方式,将线虫分为四个功能类群(摄食类型),分别为:1A型,选择性沉积食性者(Selective deposit feeders);1B型,非选择性沉积食性者(Non-selective deposit feeders);2A型,刮食者或硅藻摄食者(Epigrowth feeders);2B型,捕食者或杂食者(Omnivores/predators)[54]。
环境因子的测定:沉积物粒度参数、沉积物Chl-a含量、Pha含量、沉积物有机质含量等的测定按照《海洋调查规范》[52]执行。
1.4 数据处理
利用IBM SPSS Statistics 20.0(IBM Corp., Armonk, NY, USA)软件进行环境因子与海洋线虫丰度等观测变量之间Pearson相关性分析;进行多因素方差分析,检验季节、空间对观测变量的独立影响及两者之间的交互作用产生的影响,进而最终找到利于观测变量的最优组合。
利用PRIMER 6.0(PRIMER-E Ltd., Plymouth, UK)软件对生物数据及环境数据进行多元分析。首先,对线虫群落丰度数据进行平方根转化,计算Bray-Curtis相似性矩阵。随后的非参数多变量排序(MDS)、相似性分析检验(ANOSIM),和生物与环境连接的逐步分析(BIOENV)均在相似性矩阵的基础上进行。MDS排序,可以分析各站点之间群落结构的相似性;ANOSIM分析,可以进一步检验不同季节、不同空间线虫群落结构的差异,从无分离(R≈0)到完全分离(R=1);BIOENV分析,连接环境和生物矩阵,可以分析线虫群落结构与环境变量之间的关系。相似性百分比(SIMPER)在线虫群落数据进行平方根转化基础上,可以了解引起群落之间种类组成差异的物种。对各站点环境因子变量进行标准化转换后进行主成分分析(Principal components analysis, PCA),可以分析各站位之间的环境相似度。
2 结果
2.1 环境因子特征
研究站点主要环境因子具有明显的季节差异(见表1)。间隙水平均温度表现为夏季>秋季>冬季;间隙水盐度平均值表现为冬季>秋季>夏季。采样站点的底质类型均为黏土质粉砂(YT),粉砂-黏土含量高(78.9%~100%),中值粒径(Md)平均值表现为秋季>冬季>夏季。沉积物Chl-a含量平均值表现为冬季>秋季>夏季;Pha含量则为秋季>夏季>冬季。研究站点沉积物有机质含量普遍较高,其平均值表现为冬季>夏季>秋季。方差分析结果显示,间隙水温度(F=45.829,p=0.000)、间隙水盐度(F=116.556,p=0.000)、Chl-a含量(F=8.441,p=0.002)和中值粒径(F=3.754,p=0.038)的季节差异显著,其他受测环节因子均不具有显著的季节差异(p>0.05)。
同时,研究站点环境因子的空间分布不均匀,主要表现为不同区域之间存在差异,但相同区域内不同潮带环境因子基本一致。平均间隙水温度表现为S区(26.0±4.1) ℃>G区(25.6±3.0)℃>Y区(25.0±11.1) ℃>F区(22.7±5.7) ℃;间隙水盐度表现为F区(15.8±3.9) ‰>S区(11.5±6.9)‰>G区(11.0±7.7)‰>Y区(9.2±8.8)‰。沉积物粉砂黏土含量最高值出现在S区(98.7±1.0)%,其次为G区(97.5±2.4)%和Y区(95.2±4.5)%,F区粉砂黏土含量最低(90.5±6.8)%。中值粒径的空间分布则表现为F区最大(7.2±0.9)μm,Y区最小(5.9±0.8)μm,S区和G区分别为(6.4±0.4)和(6.2±0.6) μm。沉积物Chl-a含量的空间变化表现为S>Y>F>G,其平均值分别为(1.55±1.09)、(1.43±0.69)、(1.31±0.32)、和(1.01±0.46) μg/g。Pha含量空间变化则表现为Y>F>G>S,其平均值分别为(8.57±0.36)、(7.56±1.76)、(7.10±1.05)、(6.39±1.10) μg/g。Y区有机质含量最高,其平均值为(13.25±2.98)%。S、G、F区有机质含量依次为(9.72±0.96)%、(9.04±1.53)%、(8.01±2.46)%。方差分析结果显示,沉积物粉砂黏土含量(F=10.491,p=0.000)、中值粒径(F=4.058,p=0.002)和有机质含量(F=5.991,p=0.004)具有极显著的区域差异,其他受测环境因子的区域差异不显著(p>0.05)。F、G和S区的所有受测环节因子在高、中、低潮带之间的潮带差异均不显著(p>0.05)。
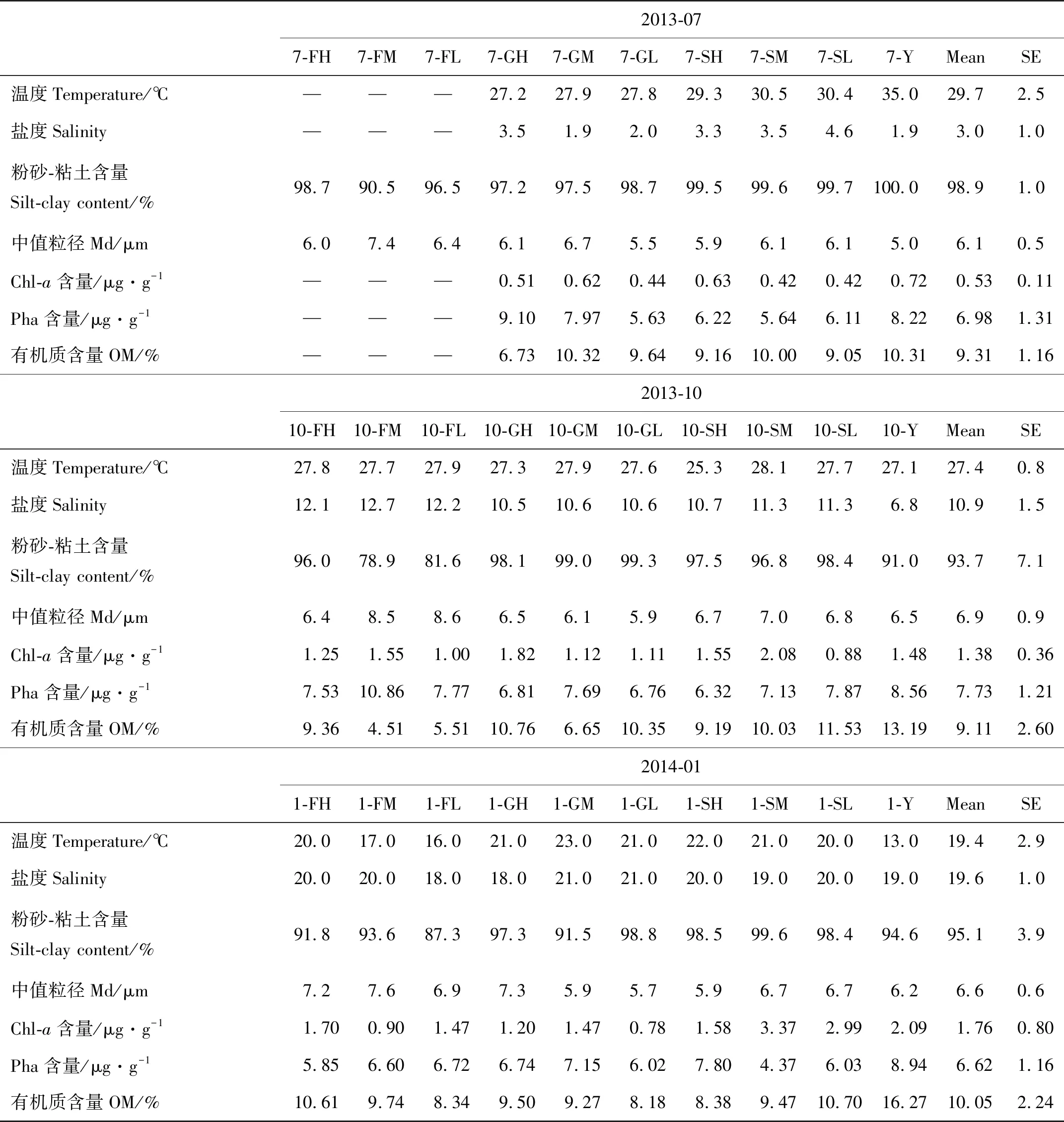
表1 深圳福田红树林保护区主要环境因子Table 1 Environmental variables in Futian mangrove reserve, Shenzhen
环境因子主成分(PCA)分析结果显示,主分量轴PC1和PC2累积可解释环境变异度的70.4%。沿PC1轴从左至右,代表间隙水温度(0.444)、粉砂-黏土含量(0.431)和沉积物OM含量(0.064)的增加,间隙水盐度(-0.499)、中值粒径(-0.465)、Chl-a含量(-0.366)和Pha含量(-0.115)的降低(见图2)。沿PC2轴由下至上,代表沉积物OM含量(0.435)、粉砂黏土含量(0.416)、Chl-a含量(0.338)、间隙水盐度(0.286)的增加,Pha含量(-0.440)、间隙水温度(-0.351)和中值粒径(-0.353)的降低(见图2)。图2A显示,不同采样季的站点沿主成分轴交替出现,表现出研究站点环境特征的季节差异。ANOSIM检验结果显示其季节分离度显著(GlobalR=0.653,p=0.001),三个季节间环境特征差异显著(成对检验,均p<0.05)。同时,图2B显示各区域站点相对集中,表现了一定的区域差异。ANOSIM检验结果显示不同区域之间的差异显著(GlobalR=0.387,p=0.001)。成对检验结果显示,Y区与S区差异显著(R=1,p=0.016),Y区与G区差异显著(R=0.704,p=0.031),S区与F区差异显著(R=0.481,p=0.020)。但是,高、中、低潮带的分离度不明显(见图2C),ANOSIM结果证明潮带差异不显著(R=0.027,p=0.293),表明各区域不同潮间带环境特征基本一致。

(A.季节;B.区域;C.潮带。蓝色圆圈和直线为叠加向量。向量长度反映了该变量对这两个特定主成分轴贡献的重要性。如果直线到达圆圈,则该变量在特征向量表中的其他系数为0。A. Plotted according to seasons; B. Plotted according to areas; C. Plotted according to tidal zones. Blue circle and lines are superimposed vectors. If the line reaches the circle then none of that variable's other coefficients in the Eigenvectors Table will differ from 0.)
2.2 海洋线虫丰度
海洋线虫是小型底栖动物优势类群,平均丰度为(1 591.4±84.8) ind./10 cm2,占小型底栖动物总丰度的98.8%。夏季、秋季、冬季的平均丰度分别为(5 095.5±602.0)、(469.5±63.7)、(610.8±251.7) ind./10 cm2,表现为夏季丰度高,秋、冬季丰度低(见表2)。
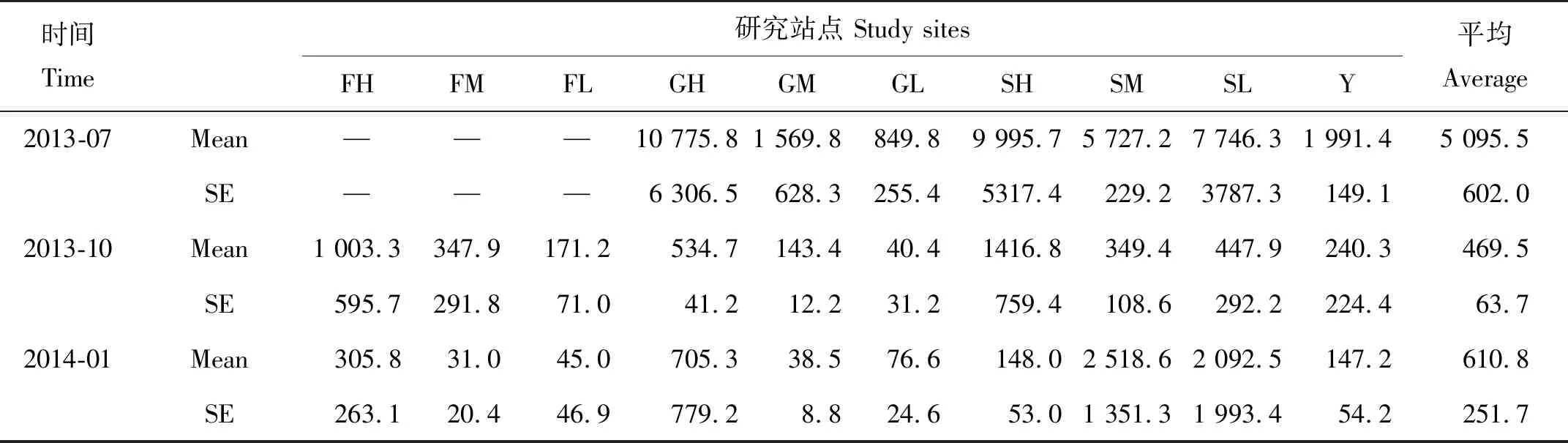
表2 深圳福田红树林保护区海洋线虫平均丰度Table 2 Average abundance of marine nematodes in Futian mangrove reserve, Shenzhen /ind.·10 cm-2
同时,海洋线虫丰度空间差异较大,其平均值表现为S区(3 097.4±600.5) ind./10 cm2> G区(1 252.9±948.5) ind./10 cm2> Y区(793.0±112.7) ind./10 cm2> F区(317.3±139.7)ind./10 cm2。F区和G区各季节海洋线虫丰度均表现为高潮带丰度值最高,并显著高于中、低潮带线虫丰度。S区线虫丰度的潮带分布特点不同于F区和G区,夏、秋季,高潮带海洋线虫丰度最高,中潮带丰度最低,冬季则正好与之相反(见图3)。
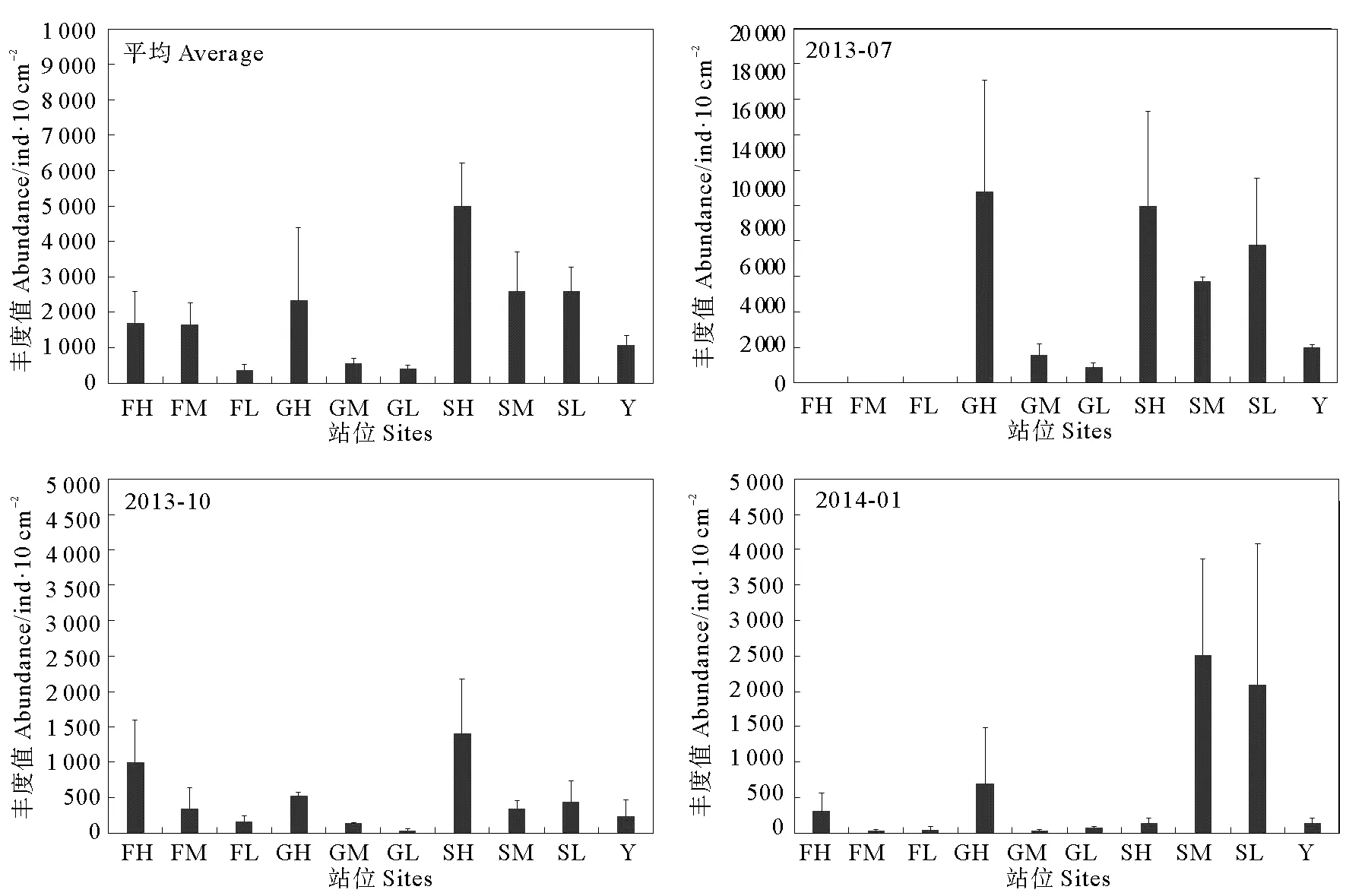
图3 研究站点不同季节线虫平均丰度(ind./10 cm2)Fig.3 Average nematodes abundance (ind./10 cm2) of different study sites in different seasons
三因素方差分析结果显示,线虫丰度具有显著的季节差异(F=4.810,p=0.012)(见表3);成对检验显示,7月线虫丰度显著高于10月(p=0.016)和1月丰度值(p=0.001)。同时,结果显示线虫丰度的区域差异显著(F=3.625,p=0.033)(见表3),S区线虫丰度分别显著高于F区(成对检验,p=0.004)和G区(成对检验,p=0.025)。总体而言海洋线虫丰度的潮带差异不显著(F=3.100,p=0.053)。季节、区域、潮带等因素交互影响下,线虫丰度均未表现显著的差异(F=0.266,p=0.944),表明相对于交互影响,季节和空间对海洋线虫丰度产生的独立影响更显著。
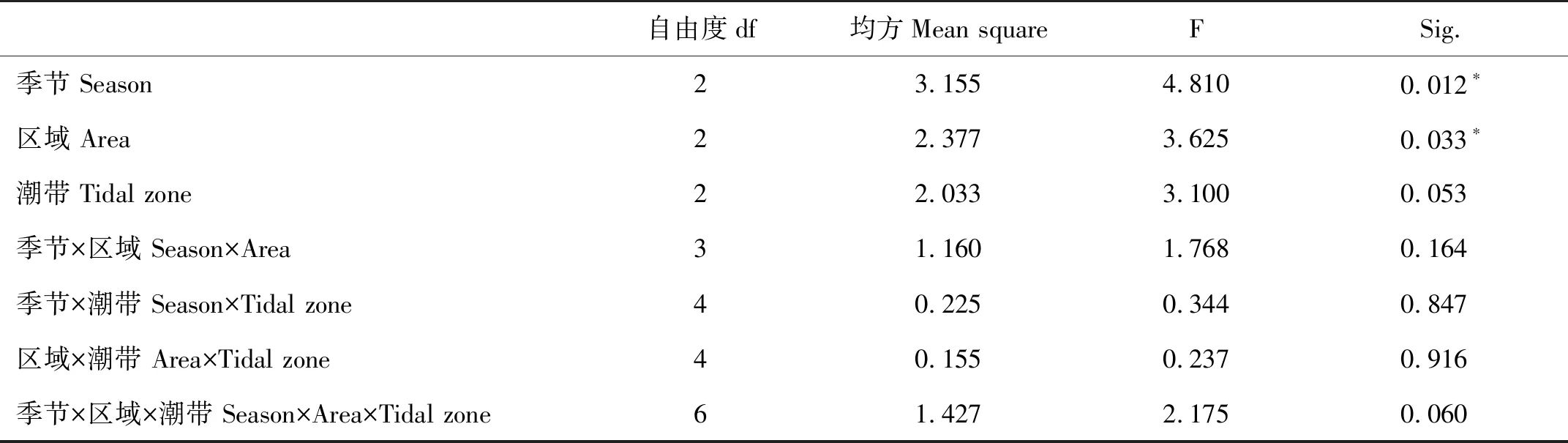
表3 海洋线虫丰度多因素方差分析结果Table 3 Results of multi-factor analysis of variance of nematode abundance
2.3 海洋线虫群落种类组成
本研究共鉴定海洋线虫71种,隶属于46属17科8目。夏季,共鉴定海洋线虫30属46种;秋季,共鉴定25属44种;冬季,共鉴定22属35种。位于沙嘴码头的SH站点线虫种数最多,为40种;位于观鸟屋的GL站点和基围鱼塘Y站点种数最少,仅为18种。线虫优势科为轴线虫科(Axonolaimidae)和条线虫科(Linhomoeidae),占总丰度的65%。其次是希阿利线虫科(Xyalidae),囊咽线虫科(Sphaerolaimidae),色矛线虫科(Chromadoridae)。海洋线虫优势属有假拟齿线虫属(Pseudolella,28.1%)、拟齿线虫属(Parodontophora,20.0%)、微口线虫属(Terschellingia,17.3%)、吞咽线虫属(Daptonema,14.5%)、亚囊咽线虫属(Subsphaerolaimus,8.6%)、后线形线虫属(Metalinhomoeus,2.1%)等,累计占总丰度的90.6%。Pseudolellasp. 1、Parodontophorasp. 1、Parodontophorasp. 2、Terschellingiasp. 3、Daptonemasp. 1、Subsphaerolaimussp. 1、Terschellingiasp. 1、Daptonemasp. 2等为优势种,累计贡献率为73.0%(见表4)。
不同季节线虫群落优势种组成显示(见表4),Pseudolellasp. 1、Parodontophorasp. 1、Daptonemasp. 1在夏季、秋季、冬季均为优势种,3个种的累计贡献率分别为43.3%、40.5%、38.0%。Daptonemasp.1的贡献率在不同季节间的变化不明显,Pseudolellasp.1对群落的贡献率在夏季和秋季最高,冬季降低,Parodontophorasp. 1对群落的贡献率在冬季最高,夏季和秋季降低(见表4)。此外,Metalinhomoeussp.1的贡献率在冬季最高(10.6%),夏季和秋季贡献率分别为2.6%和1.9%;Terschellingiasp. 1的贡献率在秋季显著增加(17%),夏季仅为2.4%。
不同区域线虫优势种组成显示(见表4),Y区海洋线虫群落优势种为Daptonemasp. 2、Terschellingiasp. 3、Subsphaerolaimussp. 1和Daptonemasp. 3,累计贡献率为75.4%,优势种组成明显不同于其他三个研究区域。F、G、S区线虫优势种组成基本相同,Pseudolellasp. 1、Parodontophorasp. 1、Daptonemasp. 1累计贡献率分别为43.6%,41.3%,38.6%。不同潮带海洋线虫群落优势种组成基本相同,表明同一区域群落相似性较高。
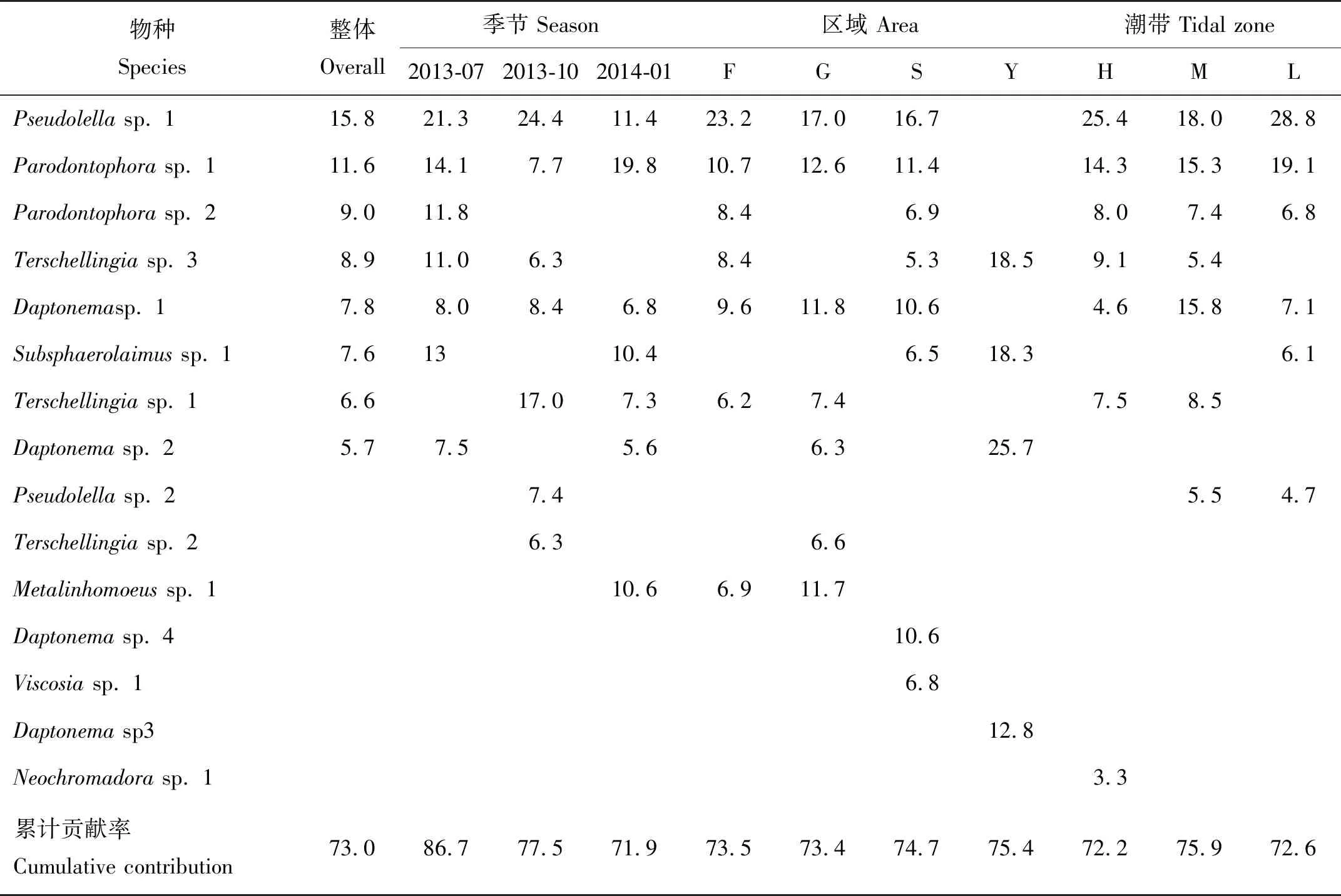
表4 深圳福田红树林保护区海洋线虫群落优势种贡献率(SIMPER分析)Table 4 Contributions of dominant species by SIMPER analysis of marine nematode community in Futian mangrove reserve, Shenzhen /%
海洋线虫群落MDS排序结果显示,不同季节的站点相对集中出现,表现了线虫群落的种类组成具有一定的季节差异(见图4A)。ANOSIM检验结果显示,线虫群落种类组成的季节差异极显著(R=0.307,p=0.001);成对检验结果显示,三个季节间种类组成的差异均极显著(均p<0.01,见表5)。同时,由图4B可以看出,相同区域的站点相对集中。ANOSIM检验结果显示种类组成在不同区域间差异极显著(R=0.303,p=0.001)。成对检验结果显示,S区与其他三个区差异显著(均p<0.05),Y区与F区差异显著(p<0.05)(见表5)。但是,不同潮带间线虫群落种类组成的差异不显著(R=0.012,p=0.360,见图4C、表5)。
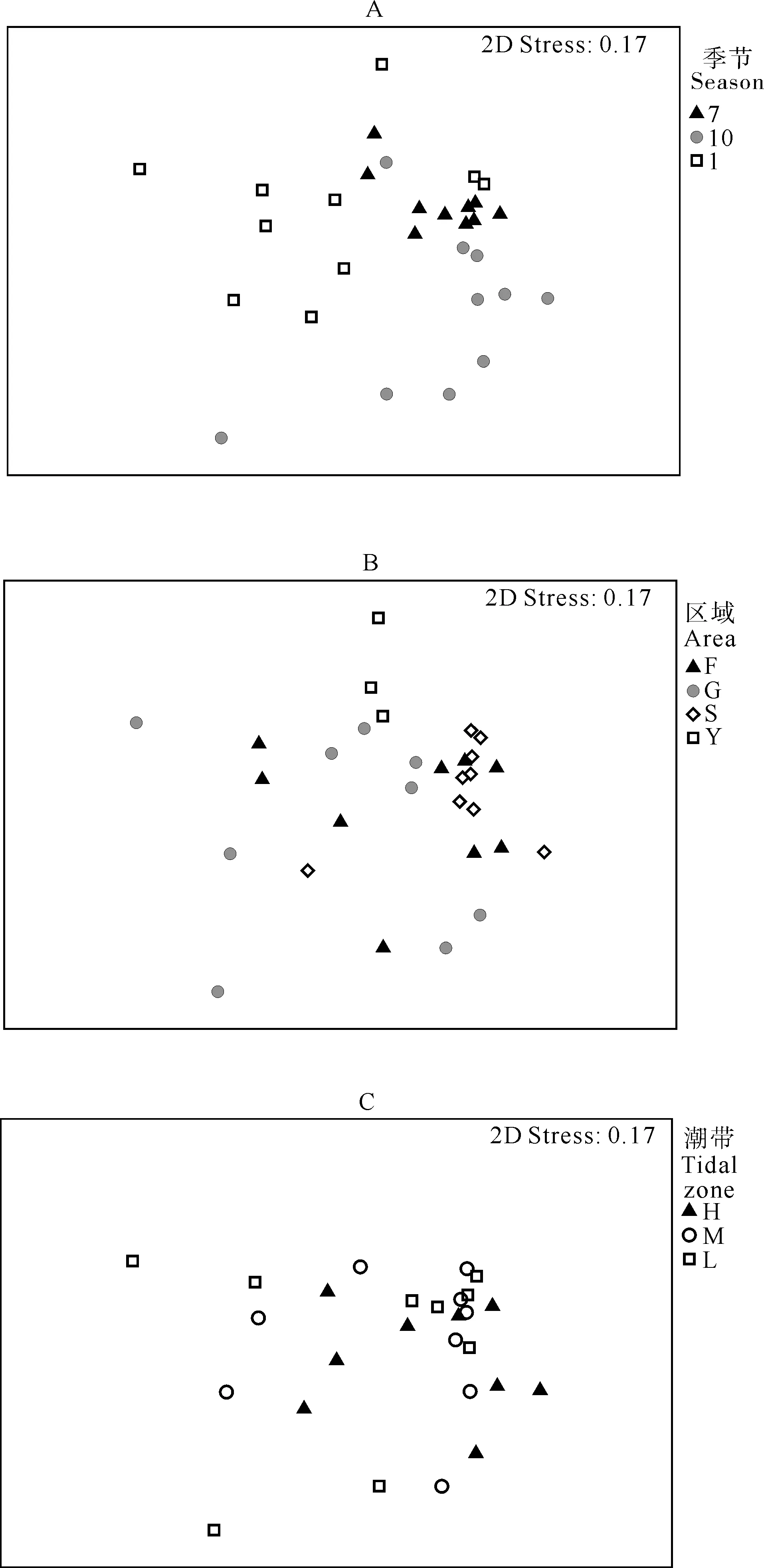
(A. 季节;B. 区域;C. 潮带。A. Plotted according to seasons; B. Plotted according to areas; C. Plotted according to tidal zones.)
2.4 海洋线虫群落营养结构
研究站点海洋线虫群落中,刮食者(2A)为最优势类型,占总丰度的51%;其次为非选择性沉积食性者(1B)和选择性沉积食性者(1A),分别占29%和18%;捕食者占2%。但是,Y区站点线虫群落营养结构不同于其他站点,最优势类型为1B型,占总丰度的58%;其次是1A型,占35%;2A和2B型分别占4%和3%;表现了Y区与其他区域之间的差异(见图5)。ANOSIM检验显示,线虫群落营养结构的季节差异显著(R=0.188,p=0.07),区域差异显著(R=0.265,p=0.01),但是潮带差异仍不显著(R=0.019,p=0.175)。成对检验结果显示,线虫营养结构在不同季节间、不同区域间均具有显著的差异(见表5)。针对不同摄食类型线虫丰度百分比的多因素方差分析结果显示,四种摄食类型丰度百分比呈现不同程度的季节差异、区域差异或潮带差异(p<0.05或<0.01,见表6)。同时,季节、区域和潮带的交互作用对四种摄食类型线虫的丰度百分比产生不同程度的影响(见表6)。
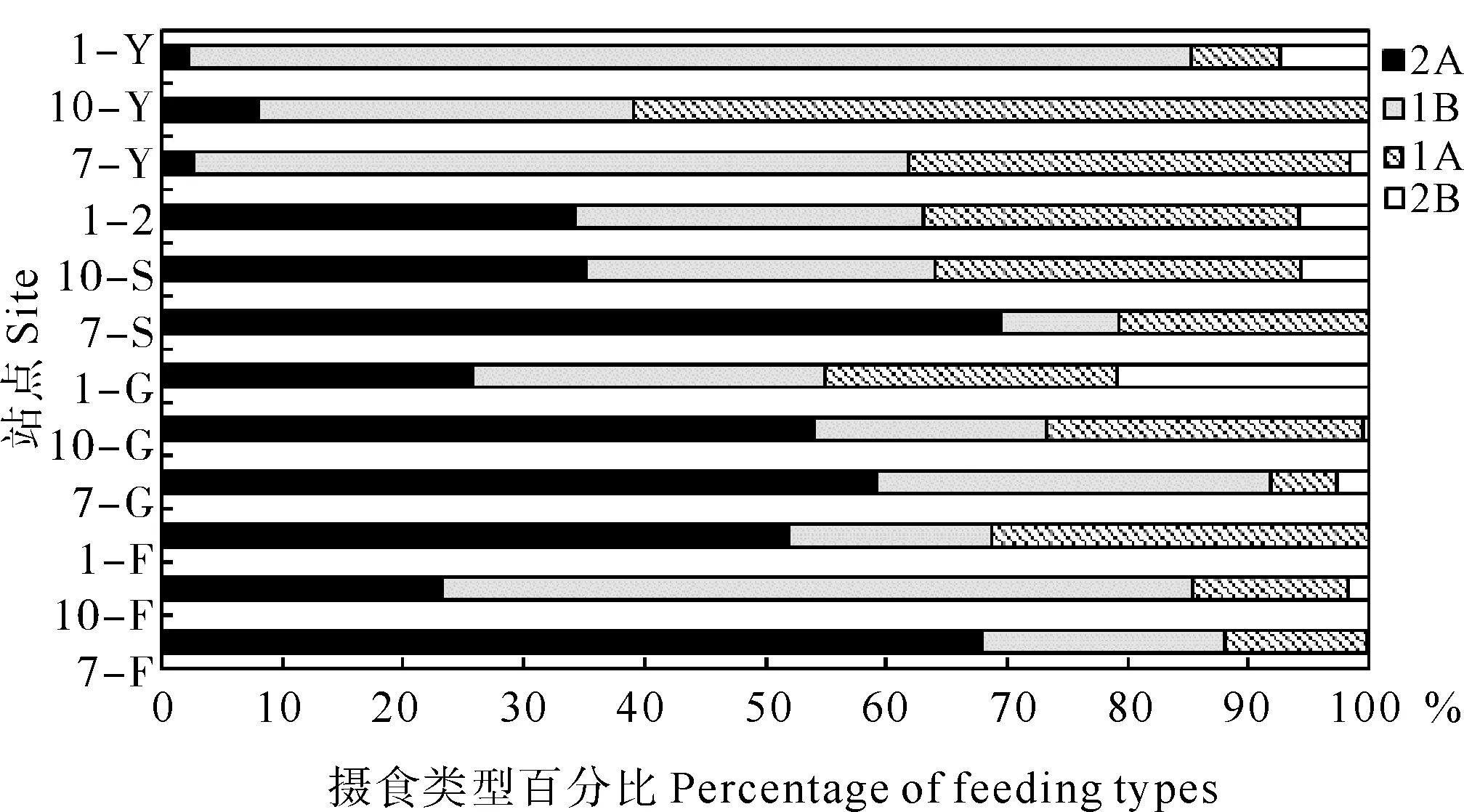
图5 研究站点海洋线虫群落四种摄食类型百分比Fig. 5 Percentage of four feeding types of marine nematode community at the study sites
2.5 海洋线虫群落特征与环境因子的相关性分析
海洋线虫丰度与环境因子之间的相关性分析结果显示,线虫丰度与间隙水温度(r=0.499,p<0.01)和粉砂黏土含量(r= 0.409,p<0.05)呈显著的正相关,与间隙水盐度(r=-0.620,p<0.01)和中值粒径(r=-0.412,p<0.05)呈显著负相关。表明,间隙水温度、盐度和沉积物粒度特征异质性是引起线虫丰度季节变化和空间差异的主要影响因素。
海洋线虫群落数据与环境因子的BIOENV分析结果显示,间隙水温度和盐度的参数组合能最好地解释各站点海洋线虫群落种类组成的差异,其相关系数为0.210。温度、脱镁叶绿酸、有机质含量和粉砂黏土含量的参数组合能最好地解释各站点海洋线虫群落营养结构的差异,其相关系数为0.299。
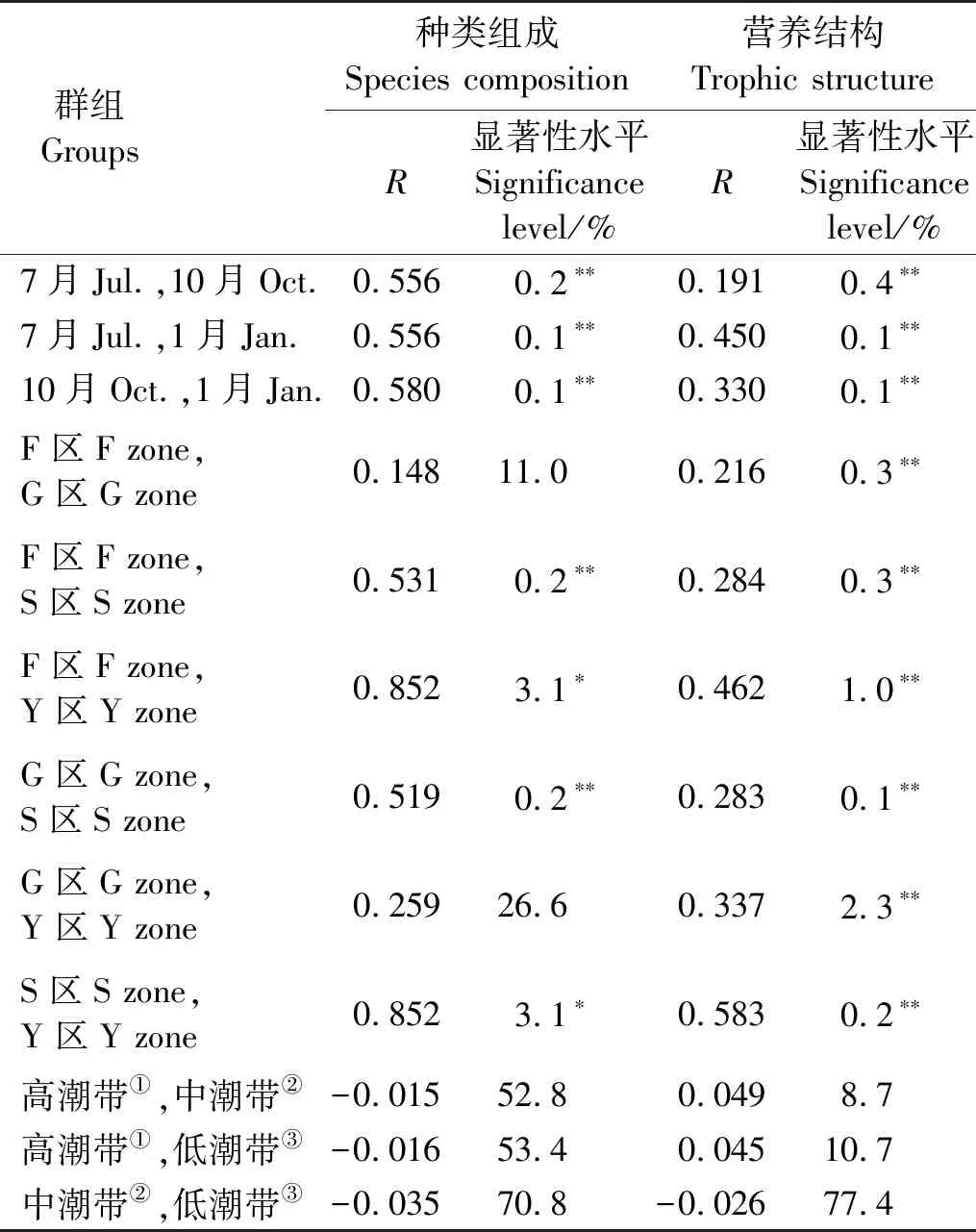
表5 线虫群落种类组成与营养结构ANOSIM成对检验结果Table 5 Paired Test results of nematode community species composition and trophic structure by ANOSIM
3 讨论
福田红树林保护区海洋线虫平均丰度为(1 591.4±84.8) ind./10 cm2,以假拟齿线虫属(Pseudolella)、拟齿线虫属(Parodontophora)、微口线虫属(Terschellingia)、吞咽线虫属(Daptonema)、亚囊咽线虫属(Subsphaerolaimus)、后线形线虫属(Metalinhomoeus)等为优势属。本研究结果与以往福田泥滩[39]和红树林湿地[41]生境研究相比,线虫群落优势种组成基本一致,但是,夏季海洋线虫丰度特别高[39-41]。首先,本研究与以往研究涉及的研究区域虽有重叠,但不尽相同,站点差异可能是引起平均值差异的主要原因。其次,这也与小型底栖动物分选方法不同有关。本研究选择孔径为31 μm的网筛进行小型底栖动物的分选,包含了更多以往研究[39]中没有分选到的线虫,特别是个体较小的幼龄个体。而本研究结果也恰恰显示,夏季线虫幼龄个体比例较高。因此,夏季丰度特别高,可能是以往研究没有观察到的结果。再次,海洋线虫丰度增加可能与研究地有机质含量升高有关[40]。深圳湾福田红树林保护区位于城市腹地,凤塘河及支流穿过保护区,受排污活动的影响,有机质含量升高。2009—2011年,福田红树林沉积物有机质含量为3.0%~6.0%[55]。本研究中,沉积物有机质含量普遍较高4.51%~16.27%,夏季平均有机质含量为(9.31±1.16)%。有机质含量的升高导致线虫丰度激增。同时,研究地线虫群落优势种组成呈现与有机质含量升高相关的表现:具有机质污染指示作用的线虫,如微口线虫属(Terschellingia)、拟齿线虫属(Parodontophora)、吞咽线虫属(Daptonema)线虫的丰度较高。这些属的线虫对有机质污染具有一定的耐受性,其丰度及优势度在有机质含量较高的环境会增加[56]。它们的优势度往往是生态质量状况评价的重要指标,其相对丰度>10%即代表生态质量状况较差或差[56-58]。本研究中,这三个属的线虫相对丰度分别为17%、20%和14%,表明福田红树林生境面临严峻的有机质污染,生态质量状况较差。近年来,对福田红树林生态系统的健康评价结果也显示,该生态系统处于亚健康状态[59]。

表6 海洋线虫不同摄食类型丰度百分比多因素方差分析结果Table 6 Results of multi-factor analysis of variance of the percentages of nematodes abundance clustered in different feeding type
3.1 福田红树林海洋线虫群落时空变化特征及主要影响因子
本研究显示,福田红树林保护区海洋线虫丰度与群落结构具有显著的空间差异和季节动态特征。线虫群落空间差异主要表现为区域差异显著,但是,不同潮带线虫群落丰度、种类组成及营养结构相似,表明同一区域内线虫群落特征一致。区域差异主要源于植被类型差异、沉积物粒度特征差异和有机质含量代表的食物资源差异。它们相互作用、相互影响,对线虫群落产生综合影响。S区(沙嘴码头)、F区(凤塘河口)和G区(观鸟屋)采样站点均位于红树林保护区内的光滩;Y区是基围鱼塘区,位于高潮带,在红树植被分布区内。不同植被类型代表的生境差异,是引起Y区与其他研究区之间线虫丰度和群落结构差异的一个重要方面。因生境不同,Y区与其他区(特别是S区、G区)之间环境因子差异显著,表现为沉积物颗粒最小、有机质含量特别丰富。因此,以有机碎屑为食的沉积食性(1A型和1B型)海洋线虫成为该区优势摄食类型,其营养结构及种类组成显著不同于其他站点(刮食者2A型占优)。此外,本研究结果还显示,线虫丰度和摄食结构与沉积物粉砂黏土含量显著相关。本研究中,粉砂黏土含量相对较低的F区有机质含量最低,线虫丰度也最低(特别是FM和FL站点),线虫群落种类组成和营养结构均显著不同于粉砂黏土含量最高的S区和有机质含量最高的G区。通常,粉砂-黏土含量高的沉积物利于有机质富集,线虫丰度增加。同时,粒度特征影响线虫的形态特征。随着沉积物颗粒变细,身体小、刚毛短的线虫增多[60],进而引起线虫群落种类组成的变化。由此可见,植被类型、沉积物粒度特征及有机碎屑代表的食物资源质与量的差异,是导致福田红树林保护区线虫丰度及群落结构呈现空间差异的重要因素。
福田红树林保护区线虫群落季节差异主要表现为夏季丰度高,秋冬季丰度低,三个季节种类组成区分度明显,营养结构差异显著。线虫群落结构及丰度的季节差异,与研究地沉积环境因子的季节性动态有关。首先,温度和盐度是福田红树林环境因子季节差异的重要体现:夏季,温度高盐度低,冬季与之相反。本研究结果显示,海洋线虫群落结构与温度、盐度具有显著的相关关系,丰度与温度呈正相关、与盐度呈负相关。已有大量研究证实,高温可以缩短线虫世代时间,有利于线虫的快速生长发育[7]。海南东寨港红树林地区[36]和湛江高桥红树林区[37]海洋线虫群落也呈现夏季丰度最高的特征(见表7)。低盐可以促进底栖硅藻蛋白质合成,加快细胞增殖速度[61]。底栖硅藻又是海洋线虫重要的食物来源。所以,在温度高、盐度低的夏季,食物资源丰富,海洋线虫的生殖发育达到高峰,丰度最高。同时,温度和盐度的季节性变化,会影响线虫的摄食行为,进而影响线虫群落摄食结构。夏季,底栖硅藻和底栖微生物数量增加,刮食硅藻和细菌的2A型线虫得利,快速生长、繁殖。因此,在F、G、S区域,夏季2A型线虫丰度迅速增加,成为夏季群落优势摄食类型。冬季,底栖硅藻数量减少,但红树林特有的红树凋落叶却很多。凋落叶会促进异氧微生物数量的增多,加速对凋落叶的分解,增加沉积物中的有机碎屑。凋落叶的有机碎屑为红树林生态系统的物质循环提供了重要保障,也是海洋线虫,特别是沉积食性线虫,重要的食物来源。因此,秋、冬季,以有机碎屑为食物的沉积食性线虫(1A型和1B型)优势逐渐显现,例如Terschellingiasp.1(1A)和Metalinhomoeussp.1(1B)在秋、冬季优势度增加。
其次,沉积物粒度特征的季节动态也是影响线虫丰度和群落结构季节变化的重要因素。福田红树林沉积物类型为黏土质粉砂,粉砂黏土含量高,沉积物颗粒细。本研究中,夏季,研究站点沉积物粒径显著低于秋、冬季,粉砂黏土含量高于秋冬季。沉积物粒度特征通过影响线虫的形态特征及摄食行为,最终导致夏季与秋、冬季线虫群落结构及丰度的分化。此外,沿岸湿地沉积物中幼鱼及大型底栖动物的捕食行为也是控制线虫季节变化的重要因素之一。海洋线虫是某些大型底栖动物的食物来源,例如小型甲壳类、鱼类和食肉性多毛类[62-63]。深圳湾大型底栖动物群落中,小个体、生命周期短的小头虫(Capitellacapitata)和寡毛类的丰度较高[50]。已有研究显示,福田泥滩线虫与小头虫的数量消长一致,保持着共栖关系[39]。食物资源丰富、源自大型底栖动物的捕食压力较低,因此,线虫丰度保持较高的水平。遗憾的是,本研究没有对大型底栖动物群落动态进行同步研究。在今后的研究中,红树林海洋线虫与其捕食者之间的消长关系有待于进一步研究予以证实。

表7 中国不同红树林生境线虫丰度(ind./10 cm2)比较Table 7 Comparisons of nematodes abundances (ind./10 cm2) in different mangrove habitats, China

续表
3.2 福田红树林与其他地区红树林生境海洋线虫群落特征的比较
中国红树林分布介于18°N~28°N,主要以蜡烛果(Aegicerascorniculatum,别称桐花树)、秋茄(Kandeliacandel)、海榄雌(Avicenniamarina,别称白骨壤)、木榄(Bruguieragymnorrhiza)、海桑(Sonneratiacaseolaris)、无瓣海桑(Sonneratiaapetala)等红树植被为优势种。福田红树林保护区以桐花树、秋茄、白骨壤等为优势种,与其他红树林生境优势树种相同、基础生境相似。因此,与中国其他红树林生境相比,海洋线虫平均丰度处于其他地区丰度变化范围之内(见表7),优势属、种相似。例如,微口线虫属(Terschellingia)、拟齿线虫属(Parodontophora)、吞咽线虫属(Daptonema)等属海洋线虫在福建秋茄、白骨壤、桐花树生境[23, 25],湛江高桥桐花树、木榄(Bruguieragymnorrhiza)、无瓣海桑(Sonneratiaapetala)生境[37]均为优势属;Metalinhomoeus属为海南东寨港红树林优势属[36]。本研究线虫群落优势属组成与福建、湛江、海南红树林生境的研究结果相似,表明它们是相似生境的相似群落。同样,以上属线虫常见于全球海榄雌属(Avicennia)[8-10,12,15,21-22]、红树属(Rhizophora)[8,17,21]植被为主的红树林生境。
但是,中国各地红树林生境线虫丰度变化幅度较大,线虫平均丰度不仅因地域不同表现差异,也因红树林优势树种的不同出现显著的差异(见表7)。曹婧[24]分别对福建漳江口白骨壤、秋茄、桐花树生境小型底栖动物的研究显示,白骨壤生境小型底栖动物丰度最高,秋茄林生境最低。湛江高桥红树林的研究显示,无瓣海桑生境线虫丰度最高,木榄生境丰度最低[37]。总的来讲,白骨壤生境线虫丰度最高,其次为秋茄,无瓣海桑、桐花树、海桑、木榄生境等。类似结果也普遍出现在世界其他红树林分布区。印度东南沿岸红树林区线虫研究显示,白骨壤生境线虫丰度高于红树(Rhizophoraapiculata)生境[21]。非洲及印度等地海桑属(Sonneratia)红树林生境小型底栖动物丰度最高,木榄生境丰度最低[14, 22]。Ghosh and Mandal[22]在印度Sandabans红树林区的研究进一步表明,木榄和美洲红树(Rhizophoramangle)生境海洋线虫群落结构显著不同于桐花树、白骨壤、海桑(Sonneratiacaseolaris)生境的线虫群落。不同红树植被的凋落叶、根系结构及分泌物等特有特征的差异,会引起线虫丰度和种类组成的变化[11, 64-65]。红树凋落叶是沉积物有机质的重要来源,是线虫主要的食物来源。同时,凋落叶所含单宁会抑制线虫丰度的增加,对线虫丰度及分布产生重要影响。红树植物的单宁含量因树种不同而存在差异。白骨壤单宁含量较低可能是白骨壤生境线虫丰度高于其他红树林生境的主要原因之一。此外,红树植物根系较浅,但根冠比高,形成支柱根或板状根,增加了沉积环境空间异质性,影响线虫的丰度及分布。不同的红树植物根系结构不同,例如,白骨壤主根不明显,侧根多为横向伸展的“横走根”;秋茄具有小型的板状根,主根短,侧根都是向下直伸;木榄具有发达的呼吸根,向上长出地面后再向下伸入土中。红树植物根系结构不同,影响线虫的丰度及分布的程度不同。印度Sandabans红树林区的研究,探讨了红树根系生物量及分泌物与小型底栖动物群落结构和丰度的关系,认为单宁含量适中、红树根系生物量适中的生境,小型底栖动物(包括海洋线虫)丰度最高[11]。
同时,各地海洋线虫群落种类组成不尽相同,许多优势属或种具有典型的地方性分布特点。例如,萨巴线虫(Sabatieria)、显齿线虫(Viscosia)、折咽线虫(Ptycholaimellus)、拟囊咽线虫(Parasphaeroalaimus)等在福建红树林优势度明显,而在本研究中丰度较低。本研究中丰度较高的假拟齿线虫(Pseudolella),在朱慧兰等[41]的研究中,同样以优势属出现在福田红树林湿地,表明该属在福田红树林保护区丰度高、优势度明显。但是,在中国已有的其他红树林线虫研究中并未大量出现。假拟齿线虫(Pseudolella)主要分布于泥质沉积物,是河口生境常见种[66]。有研究显示,该属常见于白骨壤生境[21],对原油污染具有较高的耐受能力[66]。但是,关于该属线虫生物学及生态学研究较少,对其在福田红树林生态系统中的功能及生物指示作用仍需更广泛的研究予以证实。营养结构的差异也普遍存在于中外红树林生境线虫群落。福田红树林主要摄食类型为2A型,其丰度百分比具有显著的季节差异。本研究与福建湾坞秋茄林和东寨港红树林海洋线虫群落营养结构相似(见表8)[25, 36]。印度红树林已有研究显示,其红树林海洋线虫也以2A型为优势类型[21-22]。2A型线虫多以底栖硅藻为主要食物来源。显然,它们的数量与初级生产力和硅藻丰度密切相关。研究区域初级生产力和硅藻丰度差异引起线虫营养结构的变化,从而影响线虫群落结构特征。
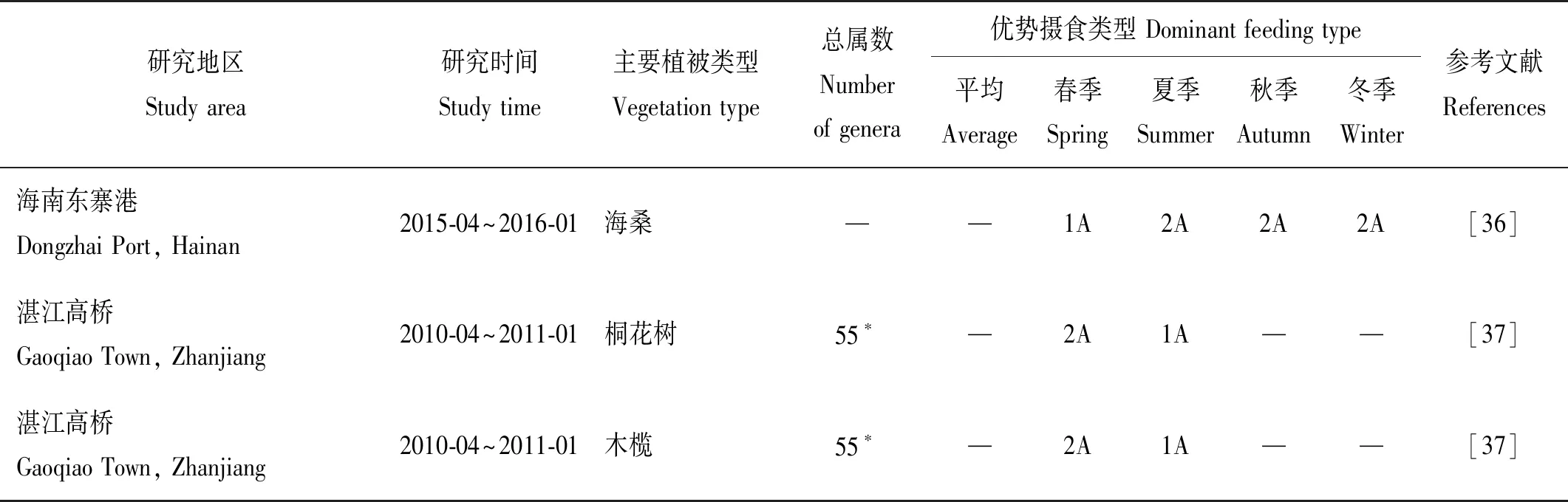
表8 中国不同红树林生境线虫群落优势摄食类型比较Table 8 Comparison of the dominant feeding types of nematodes community in different mangrove habitats, China

续表
此外,红树林地区其他因素,例如所在地区气候特征、干扰强度、环境胁迫、人类扰动等,也是引起不同地区红树林生境线虫群落特征差异的重要原因。已有研究显示,轻度踩踏会引起红树林生境小型底栖动物丰度的增加[45];红树林的清理活动会使个体较小的非选择型食性线虫丰度增加[46]。分析不同环境扰动或压力梯度下,海洋线虫群落特征的变化也是今后红树林海洋线虫群落研究的一个重要方向,有利于探明海洋线虫在红树林生态系统中的功能。
4 结语
福田红树林保护区海洋线虫群落平均丰度较高,其变化范围与中国其他红树林线虫丰度变化范围相符。线虫群落以假拟齿线虫属(Pseudolella)、拟齿线虫属(Parodontophora)、微口线虫属(Terschellingia)、吞咽线虫属(Daptonema)、后线形线虫属(Metalinhomoeus)等属为优势属,优势属成分与中国各地红树林生境相似,表现为相似生境的相似群落特征。但是,福田红树林生境海洋线虫群落种类组成与其他地区不尽相同,部分优势属或种,例如假拟齿线虫属(Pseudolella),具有典型的地方性分布特点。线虫群落优势摄食类型为刮食者(2A型),其数量与初级生产力和硅藻丰度密切相关。
福田红树林线虫丰度与群落结构具有显著的空间差异和季节变化特征。线虫群落空间差异主要表现为区域差异,源于植被类型差异、沉积物粒度特征差异和有机质含量代表的食物资源差异。不同潮带线虫群落结构及丰度值相似,表明同一区域线虫群落结构一致。线虫群落结构及丰度的季节差异主要与研究地间隙水温度、盐度和沉积物粒度特征的季节性变化有关。此外,来自上级营养级的捕食和红树林地区其他因素,如气候特征、干扰强度、环境胁迫、人类扰动等,也是影响海洋线虫群落结构及丰度的重要因素,有待于未来进一步研究证实。
致谢:感谢刘清河、黄德铭等在本研究采样工作中做出的贡献。感谢原子皓、蔡山、刘晓萌、张德梅、宋慧丽在室内分析工作中付出的努力。
