响应面法优化苔干多糖的提取工艺及其体外抗氧化研究
2020-08-26方颂平姚洪礼冉景春张志祥童梦茹
邢 爽,方颂平,姚洪礼*,冉景春,张志祥,童梦茹,闵 慧,
(1.亳州学院 生物与食品工程系,安徽 亳州 236800;2.亳州学院 配制酒工程技术研究中心,安徽 亳州 236800)
苔干,又称贡菜,一年生草本植物,是安徽亳州涡阳县义门镇的名贵特产,其富含蛋白质、果胶及多种氨基酸、维生素和人体必须的微量元素及碳水化合物,有“天然保健品,植物营养素”之美称[1]。多糖是一类普遍存在于生物体中且含量较多的天然高分子聚合物,由醛糖或酮糖通过糖苷键连接而成的[2]。研究发现,植物多糖不仅是植物生物膜及其他细胞结构中的必不可少的组成成分,同时具有多重功效如抗肿瘤、降血糖、降血脂、抑菌、抗氧化性等,且毒副作用均小[3-4]。多糖的抗氧化性是其抗肿瘤、降血压、降血脂的作用机制之一[5-6],研究表明人类的多种疾病和氧化应激、免疫力息息相关,如多糖的抗肿瘤功能是通过增强机体免疫功能间接发挥抗肿瘤作用,而几乎人体系统的疾病与氧化应激密切相关,多糖则可以发挥抗氧化作用降低氧化应激水平[7-8],目前对植物多糖抗氧化性的研究主要关注在多糖清除自由基的能力上[9-10]。
本文主要研究苔干多糖的提取工艺、除蛋白纯化工艺及其抗氧化性,采用单因素结合响应面的实验方法优化苔干多糖的提取、除蛋白纯化工艺,探讨苔干多糖清除DPPH·自由基、超氧阴离子自由基及羟基自由基的能力,以期为充分开发苔干的营养价值提供参考。
1 材料与方法
1.1 材料与试剂
苔干产地为安徽亳州涡阳县义门镇苔干种植基地。
无水乙醇、三氯乙酸、苯酚、正丁醇、七水合硫酸亚铁、Tris-HCl 缓冲液、水杨酸、浓硫酸、氯仿等均为分析纯,购于国药试剂公司。
1.2 仪器与设备
超微粉碎机,可见分光光度计,旋转蒸发仪,JK-500B超声波仪,恒温干燥箱等均为国产常规仪器设备。
1.3 实验方法
1.3.1 苔干的预处理 选取质量佳的苔干,80 ℃烘干,得到苔干的干物质,粉碎,过80目筛网,得到苔干粉,密封保存至干燥器中。
1.3.2 苔干多糖提取工艺研究
1.3.2.1 料液比对苔干多糖提取率的影响 采用超声波辅助水提醇沉法提取苔干中的多糖。准确称取苔干粉末5.0 g,加入到250 mL锥形瓶中,分别按照料液比1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)加入80 ℃的蒸馏水,置于超声波中辅助浸提,超声功率设置为350 W,提取温度为80 ℃,提取时间为120 min,提取次数为1次。提取完毕后过滤,将滤液用旋转蒸发仪减压浓缩,其中水浴温度设置为60~70 ℃,转速为50 r/min,最终使浓缩液的体积为原滤液体积的20%。在强烈搅拌的状态下向浓缩的提取物中缓慢加入4倍体积乙醇(95%),4 ℃下静置12 h[11],抽滤,得沉淀,烘干,得到粗多糖,称重并测定多糖的含量,计算提取率。
1.3.2.2 提取时间对苔干多糖提取率的影响 选择最佳的料液比,提取时间分别设置为60、90、120、150、180 min,其他实验条件同1.3.1.1,考察提取时间对苔干多糖得率的影响。
1.3.2.3 提取温度对苔干多糖提取率的影响 选择最佳的料液比及提取时间,提取温度与加入的蒸馏水温度分别设置为50、60、70、80、90 ℃,其他实验条件同1.3.2.1,考察提取温度对苔干多糖得率的影响。
1.3.2.4 提取次数对苔干多糖提取率的影响 选择最佳的料液比、提取时间及提取温度,提取次数分别设置为1、2、3、4 次,其他实验条件同1.3.2.1,考察提取次数对苔干多糖提取率的影响。
1.3.2.5 超声功率对苔干多糖提取率的影响 选择最佳的料液比、提取时间、提取温度及提取次数,超声功率分被设置为100、150、200、250、300、350、400 W,其他实验条件同1.3.2.1节所述,考察超声功率对苔干多糖提取率的影响。
1.3.2.6 苔干多糖提取的响应面实验 结合单因素的实验结果,设计优化苔干多糖提取率的响应面实验。根据 Design-Expert 8.0 中 Box-Behnken 的中心组合试验设计原理[12],进行响应面实验设计,实验因素及水平设计见表1,以苔干多糖提取率为响应值。对各因素及响应值进行多元线性回归和二项式拟合,通过对回归方程的分析及各因素交互作用的响应面图形分析,寻求最优苔干多糖的提取工艺。
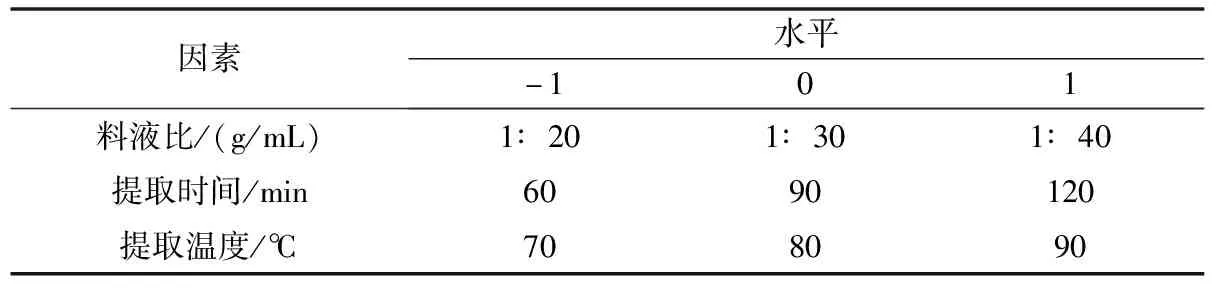
表1 Box-Behnken实验因素及水平设计表
1.3.3 苔干多糖除蛋白纯化方法的研究 为获得多糖提取率较高的苔干多糖,以苔干粗多糖为研究对象,比较 Sevage 法、TCA 法、木瓜蛋白酶法的除蛋白效果。
1.3.3.1 Sevage 法除蛋白 取一定量苔干粗多糖溶液,分别按多糖与Sevage试剂的比例为2∶1、1∶1、1∶2、1∶3、1∶4,加入Sevage试剂(氯仿∶正丁醇=5∶1),震荡30 min,然后以4000 r/min离心10 min,弃去有机层和蛋白质沉淀层,重复上述操作,直至无变性蛋白质出现,测定上清液的多糖含量,计算多糖的保留率[13]。
1.3.3.2 TCA 法除蛋白 取一定量的苔干粗多糖溶液,分别加入20%三氯乙酸(TCA)至终浓度为1%、3%、6%、9%、12%、15%,震荡摇匀,在4 ℃条件下静置2 h后,4000 r/min离心15 min,弃去沉淀,将上清液用2 mol/L NaOH溶液调pH至中性,测定上清液中多糖含量,计算多糖的保留率[14]。
1.3.3.3 木瓜蛋白酶法除蛋白 取一定量的苔干粗多糖溶液,木瓜蛋白酶溶液添加量分别为1%、2%、3%、4%、5%,调节溶液pH为6,酶解温度设置为50 ℃,酶解2 h,酶解后糖液放入沸水浴灭酶5 min,冷却至室温。4000 r/min离心10 min,弃去沉淀,取上层清液测定多糖含量,计算多糖的保留率[15]。
1.3.4 苔干多糖的抗氧化性研究 测定苔干多糖对DPPH·、羟基自由基及超氧阴离子自由基的清除能力[16-18]。
1.4 多糖提取率、纯化率的测定
采用苯酚-硫酸法测定苔干多糖的含量。
多糖提取率的计算方法:多糖提取率=粗多糖质量×多糖含量/苔干粉质量×100%;
多糖保留率的计算方法:多糖保留率=脱蛋白后多糖含量/脱蛋白前多糖含量×100%。
1.5 多糖抗氧化性的测定
1.5.1 DPPH·清除率计算公式 DPPH·清除率=[(A0-Ax)/A0]×100%(A0为空白对照液的吸光度;Ax为待测溶液的吸光度)。
1.5.2 羟自由基清除率计算公式 羟自由基清除率=[(A0-Ax)/A0]×100%(A0为空白对照液的吸光度;Ax为待测溶液的吸光度)。
1.5.3 超氧阴离子自由基清除率的计算公式 超氧阴离子自由基清除率=[(A0-Ax)/A0]×100%。(A0为空白对照液的吸光度;AX为待测溶液的吸光度)。
2 结果与分析
2.1 葡萄糖标准曲线
采用苯酚-硫酸法测得葡萄糖标准曲线,标准曲线的回归方程为y=1.0519x+0.028,R2=0.9931。
2.2 苔干多糖提取工艺研究
2.2.1 单因素实验
2.2.1.1 料液比对苔干多糖提取率的影响 料液比对苔干多糖提取率的的影响见图1。从结果来看,料液比对苔干多糖的提取率有一定影响,随着料液比的升高,苔干多糖的提取率先升高后降低,其中料液比1∶30时,提取率最高,为5.26%。在一定范围内料液比升高,有利于苔干多糖的溶出,但料液比升高会影响超声辅助提取多糖的效率,导致提取率降低。

图1 料液比对苔干多糖提取率的影响
2.2.1.2 提取时间对苔干多糖提取率的影响 选取最佳的料液比,提取时间对苔干多糖提取率的影响如图2所示。随着提取时间的增加,苔干多糖的提取率呈现先升后降的趋势,其中90 min时提取率最高,为5.46%。多糖是活性物质,采用超声辅助提取时,时间对多糖的提取是累加效应,时间延长,超声波对多糖的破坏程度增加,导致多糖破坏,提取率降低。
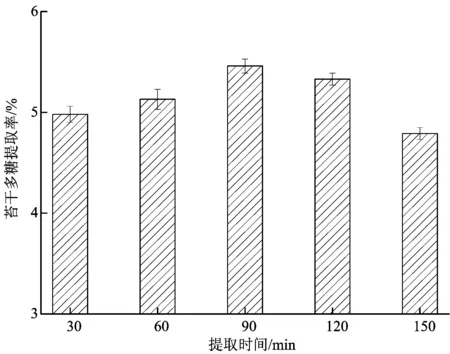
图2 提取时间对苔干多糖提取率的影响
2.2.1.3 提取温度对苔干多糖提取率的影响 选取最佳的料液比及提取时间,提取温度对苔干多糖提取率的影响如图3所示,可以看出,提取温度的升高有利于苔干多糖的溶出,提取温度为80 ℃时苔干多糖的提取率最高,为5.52%。温度继续升高,加之超声波的作用,有可能破坏多糖,导致提取率降低。

图3 提取温度对苔干多糖提取率的影响
2.2.1.4 提取次数对苔干多糖提取率的影响 提取次数对苔干多糖的提取率具有一定的影响(图4),从图中可以看出,提取次数越高,苔干多糖的提取率升高,提取4次时提取率最高,为6.12%,提取3~4次时提取率升高的不显著,考虑到时间、能耗及后续浓缩、醇沉时间及成本,苔干多糖提取2次较佳。

图4 提取次数对苔干多糖提取率的影响
2.2.1.5 超声功率对苔干多糖提取率的影响 超声功率对苔干多糖提取率的影响如图5所示,可以看出,超声功率对苔干多糖的提取有一定影响,随着超声功率的增加,苔干多糖的提取率先升高后降低,超声功率为200 W时苔干多糖的提取率最高为6.21%,一定程度的超声有助于苔干多糖的提取,但是超声功率过大对多糖的破坏作用增强,造成苔干多糖提取率有所下降。

图5 超声功率对苔干多糖提取率的影响
2.2.2 响应面实验 采用 Design-Expert.V8.0.6软件,对苔干多糖提取率的响应面实验条件设计及结果见表2。根据各因素对实验结果的影响进行二次回归模型的拟合,拟合后得到下式:Y=6.3+0.24A-0.025B-0.31C-0.12AB+0.28AC-0.34BC-0.72A2-0.12B2-0.57C2,其中Y为苔干多糖的提取率,A、B、C分别是液料比、提取温度、提取时间的编码。
对表2数据进行回归分析,结果如表3所示。
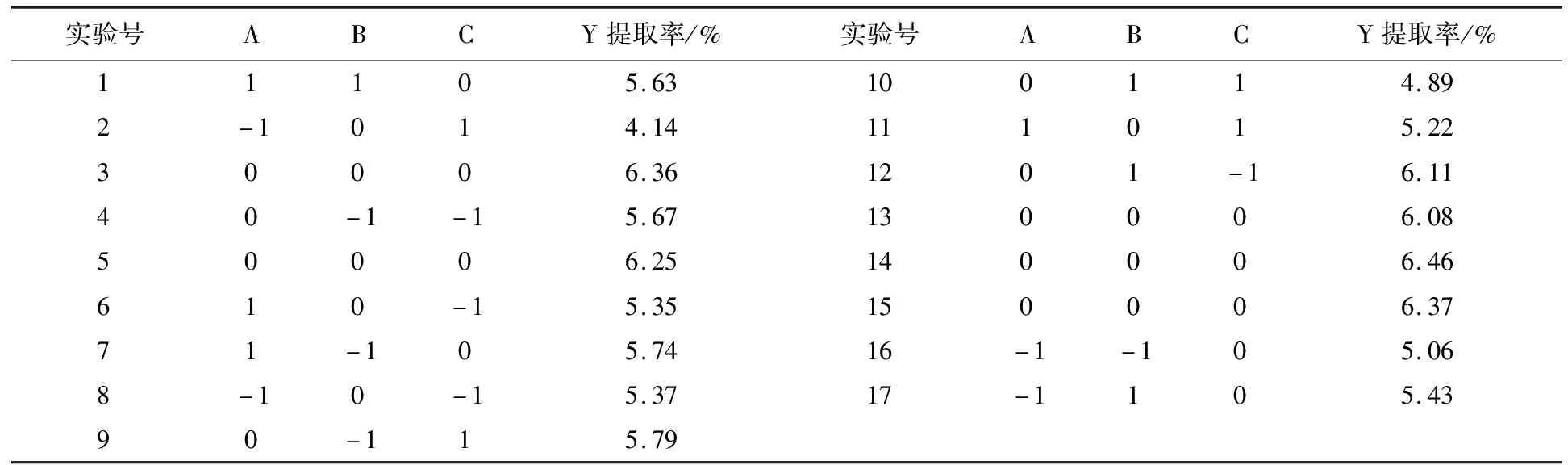
表2 响应面实验设计及结果

表3 回归方程各项的方差分析
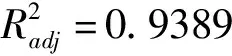
响应面各因素交互作用分析结果如图6所示。

图6 响应面各因素交互作用图
由 Design-Expert.V8.0.6软件分析,苔干多糖的最佳提取条件为料液比为1∶30.70、提取温度83.57 ℃,提取时间79.21 min,苔干多糖的提取率为6.56%。结合实际实验条件,设置料液比为1∶31、提取温度为84 ℃、提取时间为80 min,提取次数为2次,进行验证实验(平行3次),在此实验条件下,苔干多糖的提取率为6.41%±0.11%,实际测定值与理论值相近,说明拟合模型拟合良好。
2.3 苔干多糖脱蛋白纯化方法研究
图7表示采用 Sevage 法对苔干多糖脱蛋白纯化的研究。从图7可以看出,随着 Sevage 试剂添加量升高苔干多糖的保留率降低,其中 Sevage 试剂添加量为4:1时多糖保留率最高,为80.34%。
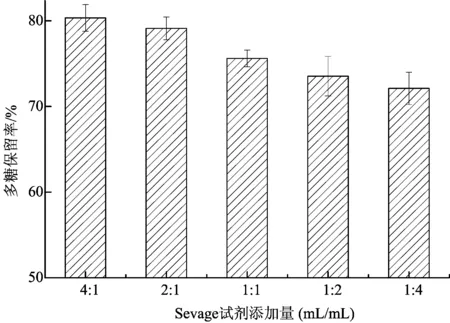
图7 Sevage 试剂添加量对苔干多糖保留率的影响
采用TCA法对苔干多糖脱蛋白纯化的研究结果如图8所示,随着加入的三氯乙酸浓度的升高,苔干多糖的保留率先升后降,TCA浓度为9%时苔干多糖的保留率最高,为83.41%。

图8 三氯乙酸浓度对苔干多糖保留率的影响
采用木瓜蛋白酶法对苔干多糖脱蛋白纯化的研究结果如图9所示,可以看出,随着酶液添加量的增加探杆多糖保留率升高,其中酶液添加量为5%时多糖保留率最高,为85.98%。

图9 木瓜蛋白酶添加量对苔干多糖保留率的影响
以苔干多糖保留率为指标,3种脱蛋白方法的研究相比较而言,采用木瓜蛋白酶除蛋白的效果最佳。
2.4 苔干多糖的抗氧化性研究

图11 苔干多糖浓度对羟基自由基的清除能力的影响

图12 苔干多糖浓度对超氧阴离子自由基的清除能力的影响
图10~12分别表示苔干多糖对DPPH·、羟基自由基及超氧阴离子自由基的清除能力。可以看出,随着多糖浓度的升高,多糖对DPPH·、羟基自由基及超氧阴离子自由基的清除能力均增强,其中苔干多糖对DPPH·的最大清除率为59.65%,对羟基自由基最大的清除率为49.31%,对超氧阴离子自由基最大的清除率为63.93%。结果表明苔干多糖具有一定的抗氧化性,但与Vc清除DPPH·、羟基自由基及超氧阴离子自由基能力相比,苔干多糖的抗氧化性不如Vc。

图10 苔干多糖浓度对DPPH·的清除能力的影响
3 结论
本文对苔干多糖的研究,主要从以下几个方面进行。
(1)首先,采用超声波辅助水提法提取苔干多糖,分别进行了单因素实验和响应面实验分析,得出了苔干多糖的最佳提取工艺:料液比为1∶30.07、提取温度83.57 ℃,提取时间79.22 min,提取次数2次,超声功率为200 W;此外,因素影响程度的大小顺序为提取时间>水料比>提取温度。根据实际情况,苔干多糖的提取条件可选择为料液比为1∶31、提取温度84 ℃,提取时间80 min,提取次数2次,超声功率200 W。
(2)其次,以苔干多糖保留率为指标,选取Sevage 法、TCA法、木瓜蛋白酶法对苔干多糖的进行除蛋白,发现相比 Sevage 法、TCA法除蛋白,采用木瓜蛋白酶除蛋白的效果最佳。
(3)最后,研究苔干多糖的抗氧化性,并与Vc进行对比,发现苔干多糖具有一定的抗氧化能力,苔干多糖在一定浓度范围内,随着多糖浓度的升高,苔干多糖对DPPH·、羟基自由基及超氧阴离子自由基的清除能力增强,其中苔干多糖对DPPH·的最大清除率为59.65%,对羟基自由基最大的清除率为49.31%,对超氧阴离子自由基最大的清除率为63.93%。
