鼠疫耶尔森菌caf 1基因缺失株体外生物学特性和对小鼠致病性分析
2020-08-25程鹏博曹超越张丽丽赵月峨鹿建春周冬生胡凌飞杨文慧
程鹏博,陆 灏,曹超越,蒋 南,张丽丽,赵月峨,鹿建春,周冬生,胡凌飞,杨文慧
鼠疫耶尔森菌是引起烈性传染病鼠疫的病原菌,可以通过蚤类在鼠与鼠之间,鼠与人之间传播,或通过气溶胶在人与人之间传播肺鼠疫[1]。自20世纪80年代以来,鼠疫进入了一个活跃时期,自然疫源逐渐扩大,动物间鼠疫重新活跃,人间鼠疫也经常发生[2]。
现有研究表明,鼠疫耶尔森菌表面的荚膜蛋白抗原因子(fraction F1)是鼠疫耶尔森菌的免疫保护性抗原之一,是由p MT1质粒携带的F1抗原操纵子编码产生。F1抗原操纵子包括是caf 1 M(编码分子伴侣)、caf 1A(锚定蛋白)和caf 1(编码F1抗原)3个基因,此外,还有一个调控基因caf 1R[3]。F1抗原操纵子位于与编码噬菌体T3连接酶基因高度同源的ORF2、IS100和与霍乱弧菌原噬菌体整合酶高度同源的ORF12之间[4]。表明F1抗原基因可能通过基因重组水平传递而来。其中caf 1是F1的结构基因,编码F1抗原的亚单位,其编码的F1抗原是鼠疫耶尔森菌的毒力决定因子之一。F1抗原的主要作用是抗吞噬作用,通过掩盖作用阻断黏附素-受体相互作用,大大减少与吞噬细胞相互作用的细菌数,从而阻断吞噬细胞的吞噬作用[5]。F1抗原的另一个作用是使被吞噬的鼠疫耶尔森菌存活并繁殖,产生致死量的细菌数,其机制可能是通过表达F1抗原产生的封闭作用完成的[6]。
鉴于此,本研究对鼠疫耶尔森菌的caf 1基因进行探讨,以期阐明caf 1基因的缺失对鼠疫耶尔森菌体外生物学功能的影响,并建立小鼠动物感染模型来比较caf 1基因缺失株对小鼠毒力的影响。
1 材料与方法
1.1 材 料
1.1.1 菌株、质粒及实验动物 鼠疫耶尔森菌201株(田鼠分离株,对人不致病菌,本室保存),质粒p AC-cr RNA、p KD46-Cas12a(本室保存),SPF级6到8周龄雌性BALB/c小鼠(北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006)。
1.1.2 试剂 氨苄西林(MP,美国)、氯霉素(MP,美国)、BHI培养基(BD公司,美国)、LB培养基(实验室自制)、血平板(北京陆桥技术股份有限公司)、DNA Mar ker DL2,000(Ta Ka Ra BIOTECH 公司,大连)、QIAquick PCR Purification Kit(Qiagen公司,德国)、QIAquick Gel Extraction Kit(Qiagen公司,德国)、PrimeSTARTMHS DNA Polymerase(Ta Ka Ra BIOTECH公司,大连)、Taq DNA pol ymerase(Ta Ka Ra BIOTECH 公司,大连)、T4 polynucleotide kinase(NEB,美国)、10 T4 DNA ligase buffer(NEB,美国)、引物均合成自北京天一辉远生物科技有限公司。
1.1.3 仪器 手持式液体气溶胶肺递送装置(北京慧荣和科技有限公司),霉菌培养箱MJP-250型(上海精宏实验设备有限公司),UV-8000 A型紫外分光光度计(上海元析仪器有限公司),Gene Amp PCR System 9700型PCR仪(美国ABI公司),凝胶成像分析系统(北京君意东方电泳设备有限公司),电泳仪Power Pac 300(BIO RAD公司,美国)。
1.2 方 法
1.2.1 caf 1基因缺失株的构建 通过前期建立的CRISPR/Cas12a介导的基因编辑方法构建F1抗原编码基因caf 1的缺失株[7]。首先合成靶向的cr RNA引物caf 1 del cr RNA-F、caf 1 del cr RNA-R(表1),退火克隆到cr RNA表达质粒p AC-cr RNA上,同时设计并合成重组引物caf 1 del oligo(表1)。之后将λRed重组酶及核酸酶Cas12a表达质粒p KD46-Cas12a转入鼠疫耶尔森菌201株,诱导重组酶表达,制备其感受态细胞。向感受态细胞中转入约300 ng靶向caf 1基因的cr RNA表达质粒和500 ng重组oligo,加1 mL LB培养基复苏2 h,40 μL/400μL梯度涂布于双抗LB平板(氨苄西林60 μg/mL,氯霉素30μg/mL)培养2天。挑选单菌落到双抗板上划线,PCR(预变性95℃/5 min;变性94℃/40 s;退火50℃/40 s;延伸72℃/1 min;再延伸72℃/5 min)、测序筛选重组正确克隆后,在含7%蔗糖的LB平板及42℃培养丢掉辅助质粒,获得最终的caf 1基因缺失株,标记为201Δcaf 1,保藏菌株(BHI培养液含30%甘油,保存于-80℃)。
表1 实验所用引物Tab.1 Primers of experiment
1.2.2 caf 1基因缺失株的鉴定 将获得的基因缺失株201Δcaf 1和鼠疫耶尔森菌201株进行10 min的热裂解获得其DNA模板,并以表1的JD-caf 1-F和JD-caf1-R作为鉴定引物对DNA进行鉴定。通过琼脂凝胶电泳技术,验证基因缺失株201Δcaf1构建成功。
1.2.3 细菌培养 鼠疫耶尔森菌201株与基因缺失株201Δcaf1均转接三代培养。接种甘油菌种接种于20 mL的BHI肉汤中,26℃200 r/min培养36 h至平台期(OD600≥2.5)后收取菌液,20倍稀释并转接于20 mL的BHI肉汤中,26℃200 r/min培养至OD600≈1.0时再次收菌,而后100倍稀释转接于20 mL的BHI肉汤中,26℃下200 r/min培养至对数中期(OD600≈1.0)后转入37℃200 r/min培养3 h,获得最终培养菌液。
1.2.4 菌落形态观察 鼠疫耶尔森菌201株与基因缺失株201Δcaf1均通过1.2.2所述方法进行培养,随后采用分区划线法,将菌液接种于血平板,26℃培养72 h,最后观察比较2株菌在血平板上的菌落形态。
1.2.5 生长曲线测定 鼠疫耶尔森菌201株与基因缺失株201Δcaf1参照1.2.2所述方法培养至第二代,同等比例转接第三代后在26℃下200 r/min持续培养,并在培养后的第0~36 h内每2 h取1次200μL的菌液,菌液样本使用终浓度为5%的甲醛固定,取样结束后用紫外分光光度计测定所有菌液样本的吸光值(600 n m),绘制生长曲线。实验共重复3次,取平均值。
1.2.6 菌株自凝聚率测定 将培养好的鼠疫耶尔森菌201株与基因缺失株201Δcaf1菌液以3 000 r/min离心10 min,收集菌体,用生理盐水洗涤2次,然后悬垂于生理盐水中,以生理盐水为空白对照,调节菌液使之在600 n m波长下OD值约为1.0,记为OD1。取5支型号一致的试管,每支试管加入2 mL调整好浓度的同一株菌的菌悬液,分别室温静置0.5 h、1 h、1.5 h、2 h、2.5 h、3 h,然后各吸取200μL上层溶液测得其OD600吸光值,重复3次,取平均值,记为OD2。通过不同时间吸光值的差异,可分别计算出2株菌的自凝聚率,计算公式如下:
菌株自凝聚率=(OD2/OD1)×100%
1.2.7 气溶胶肺递送途径感染小鼠LD50测定 使用含有0.05%泊洛沙姆的生理盐水将菌液配制成理论感染剂量(2 000 CFU/50μL、500 CFU/50μL、200 CFU/50μL、100 CFU/50μL、50 CFU/50μL、25 CFU/50μL、10 CFU/50μL、2 CFU/50μL)。选取SPF级6到8周龄雌性BALB/c小鼠160只,随机分成16组,每组10只小鼠。1到8组分别肺递送不同剂量的鼠疫耶尔森菌201株菌液50μL,9到16组分别肺递送不同剂量的基因缺失株201Δcaf1菌液50μL。每天观察记录2次小鼠发病及死亡情况,连续观察2周,根据各感染剂量组小鼠死亡情况分别求出2株菌株气溶胶肺递送感染小鼠的半数致死剂量(LD50)。
1.2.8 不同途径感染小鼠生存曲线观察 选取SPF级6到8周龄雌性BALB/c小鼠80只,随机分成8个组,每组10只小鼠。使用含有0.05%泊洛沙姆的生理盐水将鼠疫耶尔森菌201株与基因缺失株201Δcaf1菌液配制成理论感染剂量2 000 CFU/50 μL,分别以气溶胶肺递送、滴鼻、腹腔注射、尾静脉注射4种途径感染小鼠,每天观察记录2次小鼠发病及死亡情况,连续观察2周,绘制生存曲线。
1.2.9 统计学分析 在菌株自凝聚率测定实验中,应用SPSS16.0软件进行统计分析,同一时间点内比较采用multivariate检验,以P<0.05表示差异具有统计学意义。在不同途径感染小鼠生存曲线观察实验中,应用Graph Pad Pris m 8.0.1软件进行统计学分析,并绘制生存曲线,组间比较采用Logrank(Mantel-Cox)检验,以P<0.05表示差异具有统计学意义。
2 结 果
2.1caf1基因缺失株的鉴定 利用1.2.1设计的用于鉴定caf1基因的上下游引物JD-caf1-F/R对缺失株和野生株进行菌落PCR扩增,扩增产物通过1.5%琼脂糖凝胶电泳进行检测,结果显示野生株caf1基因扩增为阳性,产物长度416 bp,所有缺失株caf1基因扩增均为阴性(图1),表明基因缺失株201Δcaf1构建成功。
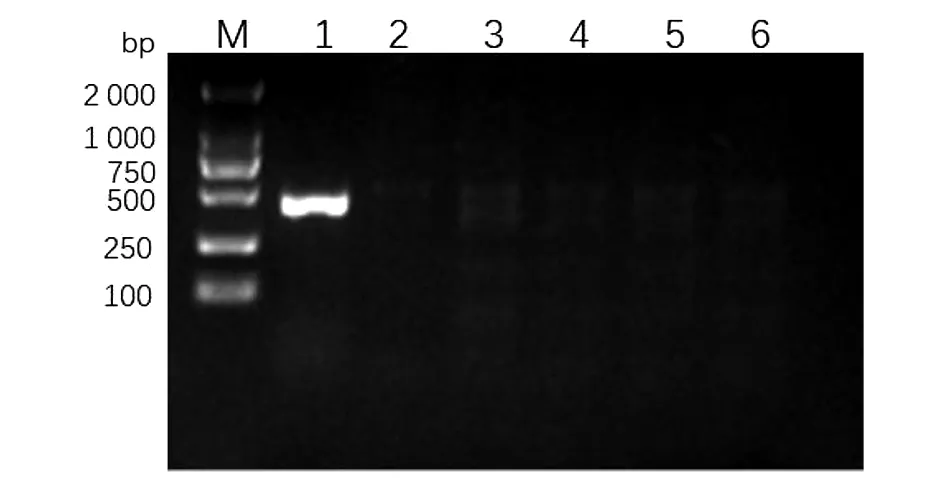
图1 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的caf 1基因PCR产物琼脂糖凝胶电泳图Fig.1 Electrophoresis of PCR of Y.pestis 201 and 201Δcaf 1
2.2 菌落形态观察 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1接种血平皿培养72 h后,可见二者均长出浅灰色、表面光滑的细小菌落,菌落形态观察结果无明显差异。
2.3 菌株生长曲线分析 26℃培养条件下鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的生长曲线基本一致(图2)。2株株菌均经历适应期、对数期、稳定期3个阶段,均经过8 h适应期后进入对数生长期,培养14 h后进入稳定期。

图2 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的生长曲线Fig.2 Growth curve of Y.pestis 201 and 201Δcaf 1
2.4 菌株自凝聚率比较 在静置的液体环境中鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的自凝聚率如图3所示,2个菌株的自凝聚率呈现出上升趋势。菌液自凝聚率的上升趋势并不是一条直线,基因缺失株201Δcaf 1在0~2 h内自凝聚率上升快于鼠疫耶尔森菌201株,在2~3 h内自凝聚率上升较慢于鼠疫耶尔森菌201株。当静置3 h后,野生株与缺失株的自凝聚率基本不会发生显著性的变化,维持在80%左右。基因缺失株201Δcaf 1的自凝聚率高于鼠疫耶尔森菌201株,F0.5h=89.99,P<0.05;F1.0h=54.93,P<0.05;F1.5h=57.60,P<0.05,差异有统计学意义。在2 h、3 h时时间点上基因缺失株201Δcaf 1的自凝聚率与鼠疫耶尔森菌201株的自凝聚率无明显差异,提示caf 1基因缺失影响鼠疫耶尔森菌早期自凝聚率。此实验重复3次,实验结果一致。
2.5 气溶胶肺递送途径感染小鼠LD50比较 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1通过气溶胶肺递送途径感染BALB/c小鼠,根据各感染剂量组小鼠死亡情况绘制出生存曲线(图4),并使用Reed-Muench法求出两株菌气溶胶肺递送感染BALB/c小鼠的LD50。计算结果鼠疫耶尔森菌201株的LD50为14 CFU/只,基因缺失株201Δcaf 1的LD50为82 CFU/只,缺失株LD50约是野生株的6倍。由此可见,caf 1基因的缺失引起了鼠疫耶尔森菌气溶胶途径感染小鼠毒力的下降。

图3 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1株不同时间的自凝聚率图Fig.3 Coherency of Y.pestis 201 and 201Δcaf 1
2.6 不同途径小鼠感染试验 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1分别以气溶胶肺递送、滴鼻、皮下注射、尾静脉注射途径对BALB/c小鼠进行2 000 CFU/50μL剂量的感染,由生存曲线图可知BALB/c小鼠全部死亡(图5),但每个途径缺失株的全部死亡时间均晚于鼠疫耶尔森菌201株。通过4种途径下的鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的生存曲线比较可知,基因缺失株死亡时间与野生株相比气溶胶肺递送途经(χ2=19.0,P<0.05)、滴鼻途经(χ2=18.0,P<0.05),皮下注射途经(χ2=10.23,P<0.05),尾静脉注射途经(χ2=15.31,P<0.05),提示caf 1基因缺失影响鼠疫耶尔森菌通过4种不同途径感染小鼠的毒力。
3 讨 论
CRISPR-Cas系统,即成簇的规律间隔的短回文重复序列簇(cl ustered regularly interspaced short palindro mic repeats,CRISPR)和 CRISPR相关蛋白(CRISPR associated protein,Cas),广泛存在于细菌和古生菌基因组中[8],作为一种获得性免疫系统来有效地抵抗噬菌体和外界各种基因原件造成的干扰。利用CRISPR-Cas系统,构建靶向cr RNA引导Cas核酸酶对靶点进行剪切产生双链断裂,则可对基因组进行剪切[9]。本研究利用CRISPR-Cas12a系统结合噬菌体蛋白重组系统成功构建了应用于鼠疫耶尔森菌的基因编辑体系,用于鼠疫耶尔森菌caf 1基因敲除。
成功获得鼠疫耶尔森菌caf 1基因缺失株后,本研究探讨了caf 1基因的缺失对鼠疫耶尔森菌生长曲线、菌落形态、自凝聚率等生物学特性的影响。通过比较鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的生长曲线和菌落形态,发现2株菌没有明显差异,表明caf 1基因的缺失并不影响鼠疫耶尔森菌的生长曲线和菌落形态。但在2 h以内因缺失株201Δcaf 1的自凝聚率比鼠疫耶尔森菌201株的高,在3 h后自凝聚率趋于一致,表明caf 1基因的缺失影响鼠疫耶尔森菌的自凝聚率。有研究表明微生物的聚集作用与微生物产生的胞外聚合物(Extracellular Polymeric Substances,EPS)密切相关,对微生物聚集体结构的形成和维持起着至关重要的作用[10]。当不同类型的EPS或EPS中的某些成分比例发生变化时,微生物之间的聚集性会出现变化[11]。而F1蛋白作为EPS的组成成分时,在基因缺失株201Δcaf 1不能合成F1蛋白的情况下,EPS的成分和结构均发生了变化。从而影响了基因缺失株201Δcaf 1的自凝聚率的变化和聚集体的稳定。与本实验结果相符,当caf 1基因缺失后自凝聚率在短期内升高,在3 h后缺失株与野生株的自凝聚率基本一致,推测是由于微生物聚集体在重力作用的影响下出现沉淀现象导致自凝聚率的升高。

图4 鼠疫耶尔森菌201株(A)与基因缺失株201Δcaf 1(B)气溶胶肺递送感染小鼠生存曲线图Fig.4 Survival curves of Y.pestis 201 and 201Δcaf 1

图5 鼠疫耶尔森菌201株与基因缺失株201Δcaf 1株4种途径感染小鼠生存曲线图Fig.5 Four ways of survival curves of Y.pestis 201 and 201Δcaf 1
随后本研究对caf 1基因的缺失是否引起鼠疫耶尔森菌毒力的变化进行了验证。首先,使用气溶胶肺递送途径对BALB/c小鼠进行鼠疫耶尔森菌201株与基因缺失株201Δcaf 1的感染,结果表明缺失株LD50是野生株的约6倍,可见caf 1基因的缺失引起了鼠疫耶尔森菌毒力在气溶胶肺递送感染小鼠模型上的下降。其次,本研究通过肺递送、滴鼻、皮下、尾静脉注射4种途径中给予小鼠绝对致死量的鼠疫耶尔森菌,结果表明基因缺失株201Δcaf 1死亡时间均晚于鼠疫耶尔森菌201株。在这4种途径下BALB/c小鼠对于基因缺失株201Δcaf 1的敏感度降低。目前已知鼠疫耶尔森菌中由F1抗原和由低钙反应质粒编码的Ⅲ型分泌系统共同完成的抗吞噬作用[12],当缺失Ⅲ型分泌系统的菌株失去F1抗原后,被吞噬的鼠疫耶尔森菌会增加6倍,当缺失F1抗原的菌株失去Ⅲ型分泌系统后,被吞噬的鼠疫耶尔森菌会增加14倍,当两者均缺失时吞噬率会增加18倍[13]。虽然F1抗原有抗吞噬作用,但F1抗原不是必须的毒力因子,F1抗原基因的缺失并不能明显降低不同动物模型的半数致死量[14]。与本实验结果相符,BALB/c小鼠对于基因缺失株201Δcaf 1的敏感性降低,LD50升高6倍。
本实验构建了基因缺失株201Δcaf 1,并对其从基因水平进行鉴定。通过生物学功能实验,我们发现基因缺失株201Δcaf 1和鼠疫耶尔森菌201株在相同的培养条件下菌落形态和生长速率上无明显差异,自凝聚率有所升高。而且BALB/c小鼠对基因缺失株201Δcaf 1的敏感性降低,LD50也有所升高。本研究基于CRISPR/Cas12a方法构建了基因缺失株201Δcaf 1,证实该基因参与细菌的自凝聚过程和致病过程。在此基础上我们将进一步通过研究caf 1基因,以便更加深入的研究诠释F1蛋白的生物学功能。
