奶牛粪便分离的伊氏李斯特菌伊氏亚种基因组序列测定及其分子特征分析
2020-08-25蒋华英宋泽萱纪顺师王怡倩徐保红高伟利陈峥宏叶长芸
蒋华英,甘 霖,毛 盼,宋泽萱,纪顺师,王怡倩,王 艳,徐保红,高伟利,陈峥宏,叶长芸
伊氏李斯特菌是一类革兰阳性、兼性厌氧的胞内病原菌。对外界环境条件耐受能力强,可形成生物膜,在包括低温、高盐、较宽的p H范围等环境条件下都能定植并繁殖[1-2],这种特性使伊氏李斯特菌通常可长期存在于各类环境中[3]。伊氏李斯特菌主要感染动物,特别是反刍类动物,可导致动物败血症、乳腺炎、肠炎、流产等[2,4-5]。近年来也常有伊氏李斯特菌引起人感染的报道[2,6-8]。伊氏李斯特菌引起的人李斯特菌病的报道较单增李斯特菌少,但伊氏李斯特菌在食品中的污染并不少见,人具有摄入伊氏李斯特菌污染食品而感染的风险[9-11]。由于动物与环境接触较密切,感染伊氏李斯特菌的动物可通过粪便将伊氏李斯特菌排入周围环境,作为市场肉类食品的来源,养殖畜禽类动物如果携带伊氏李斯特菌,会增加其污染(肉类)食品及奶制品的风险[12]。国外已有多起伊氏李斯特菌引起反刍类动物李斯特菌病暴发的报道[13-14],而我国反刍类动物中伊氏李斯特菌的存在情况尚不清楚。伊氏李斯特菌的毒力岛LI PI-1与单增李斯特菌所共有,毒力岛LIPI-2包括smc L基因及一组内化素蛋白基因。而smc L则为伊氏李斯特菌特有基因,编码一种能破坏细胞膜的鞘磷脂酶C,其遗传性相对不稳定。LIPI-2被认为可能在伊氏李斯特菌的致病性和宿主嗜性中起重要作用[15]。Yin Yue-lan等2019年从绵羊李斯特菌病暴发事件中分离到一种同时包含单增李斯特菌毒力基因和伊氏李斯特菌毒力基因的特殊菌株,其毒力强于单增李斯特菌,提示在同一环境中共存的不同种李斯特菌,其毒力基因可能存在一定的相关性[16]。
本研究首次从国内奶牛粪便中分离到伊氏李斯特菌,并对其进行了全基因组测序,并分析其遗传特征,以及毒力基因、耐药基因和前噬菌体基因等分子特征。
1 材料与方法
1.1 样本采集 2019年7月在某奶牛场共采集196份奶牛粪便样本。用无菌棉签蘸取适量新鲜奶牛粪便,保存于含20%甘油的脑心营养液中,放置4℃保存,并及时送至实验室进行细菌分离和鉴定。
1.2 样本的分离和鉴定 奶牛粪便样本根据ISO 11290方法进行李斯特菌的分离培养[17]。将20%甘油脑心培养液保存的粪便样本充分混匀,取1 mL混合物加入10 mL Half Fraser增菌液中,放置于空气摇床,30℃,220 r/min,孵育24 h;随后,取1 mL Half Fraser增菌培养物转移至5 mL Fraser增菌液中,放置于空气摇床,37℃,220 r/min,孵育48 h。用接种环取4~5环的二次增菌液,接种至李斯特菌显色固体培养基CM1080平板(Oxoid,Basingstoke,UK),将平板放置于恒温箱,37℃培养36~48 h。从每个CM1080平板上各挑选5个疑似菌落,涂布于脑心浸液固体培养基进行纯培养,采用基于李斯特菌属和各个种的特异性引物进行PCR鉴定[18],引物由北京擎科测序公司合成,选择伊氏李斯特菌参考菌株PA M55作为阳性对照。
1.3 核酸提取及测序 将本研究中奶牛粪便样本分离的伊氏李斯特菌在脑心浸液固体培养基上纯化后,用 Wizard○RGeno mic DNA Purification Kit提取核酸,由北京诺禾致源生物信息科技有限公司完成基因组测序。选用高通量Illu mina Hiseq PE150测序平台进行测序及SOAP denovo(version 2.04)软件进行组装,伊氏李斯特菌PA M55为参考菌株。
1.4 基于核心基因的进化树分析 将测序后的伊氏李斯特菌和NCBI中获得的其他伊氏李斯特菌基因组序列进行比较,通过Mu Mer软件将所选择菌株基因组序列比较得到的SNP用MEGA 6.0软件构建系统进化树,算法采用Neighbor-joining法,bootstraps参数设置为1 000。其中,将NCBI上伊氏李斯特菌 PA M55、NCTC11846、WSLC3010、RR3、NCTC11007、WSLC3009、ICDC_Liv037、ICDC_Liv035、G_770及NCTC12701的全基因组序列作为对照进行比对分析,其中伊氏李斯特菌G_770分离自一名法国艾滋病患者,将其纳入本研究与分离自奶牛粪便标本的伊氏李斯特菌一起比对分析。单增李斯特菌EGD-e作为外群参照菌株。
1.5 毒力基因 在两个网站https://cge.cbs.dtu.dk/ser vices/Vir ulenceFinder/和htt p://www.mgc.ac.cn/VFs/main.ht m上进行了伊氏李斯特菌的毒力基因比对分析,参数设置为最少80%的长度和85%的同一性[19],以单增李斯特菌EGD-e为参考菌株。
1.6 耐药基因和噬菌体基因 伊氏李斯特菌分离菌株基因组在耐药基因数据库(The Co mprehensive Antibiotic Resistance Database)中进行耐药相关基因的比对分析,使用噬菌体数据库网站(http://phaster.ca/)比对分析噬菌体基因。
1.7 CRISPR/Cas系统 CRISPR簇由一段不连续的同向重复序列和插入其中的间隔序列组成,与CRISPR相关基因cas基因构成CRISPR/Cas系统,是细菌的反入侵免疫系统。本研究采用CRISPRdigger软件[20]对伊氏李斯特菌基因组进行CRISPR系统的检测。
2 结 果
2.1 奶牛粪便样本中伊氏李斯特菌的检测结果196份奶牛粪便样本中有9份样本为李斯特菌阳性,经特异基因的PCR鉴定,3株为伊氏李斯特菌,6株为英诺克李斯特菌,分离率分别为1.53%和3.06%。参考曹晓龙等的分型方法[18],3株伊氏李斯特菌的MLST分析结果均为ST1型。
2.2 伊氏李斯特菌基因组基本特征及基于核心基因组的系统发育树分析 3株伊氏李斯特菌分离株的Scaffol d数为15~17个。基因组长度、G+C含量及总编码基因数分别为2.87~2.90 Mbp、36.97%~37.00%及2 894~2 923个。总RNAs为87~96个。16S r DNA基因序列分析确定为伊氏李斯特菌伊氏亚种。
奶牛粪便样本分离的3株伊氏李斯特菌与参考菌株PA M55(羊来源)的ST型相同(ST1),采用基于核心基因组的SNPs分析构建了3株伊氏李斯特菌与PA M55及NCBI数据库中部分伊氏李斯特菌菌株基因组序列的系统发育树(图1)。系统发育分析显示,3株伊氏李斯特菌分离株与PA M55(羊)及G_770(病人)同属于一个分支。基于核心基因的SNPs分析发现奶牛粪便样本分离的3株伊氏李斯特菌间无SNPs差别。
2.3 毒力基因 3株伊氏李斯特菌分离株与G_770菌株的毒力岛LIPI-1及LIPI-2基因均阳性,其他绝大部分致病性李斯特菌毒力相关基因也为阳性,但3株伊氏李斯特菌分离株的免疫调节基因inl K、int A,侵袭相关基因aut、vi p缺失,G_770免疫调节基因int A,侵袭相关基因aut、vip缺失,inl K基因存在(图2)。毒力相关基因主要包括粘附基因(f bp A、ami、inl F、Lap)、定植基因(op p A、cl pc、cl p P、f ri、htr A、per R、prs A 2、p yc A、rel A、sod、tig)、侵袭 基 因 (aut、iap、gtc A、inl A、inl B、inl P、l pe A、vi p)、溶细胞膜基因(hl y、smc L)及毒力调控关联基因(cheY、lis K、pr f A、vir R)等。
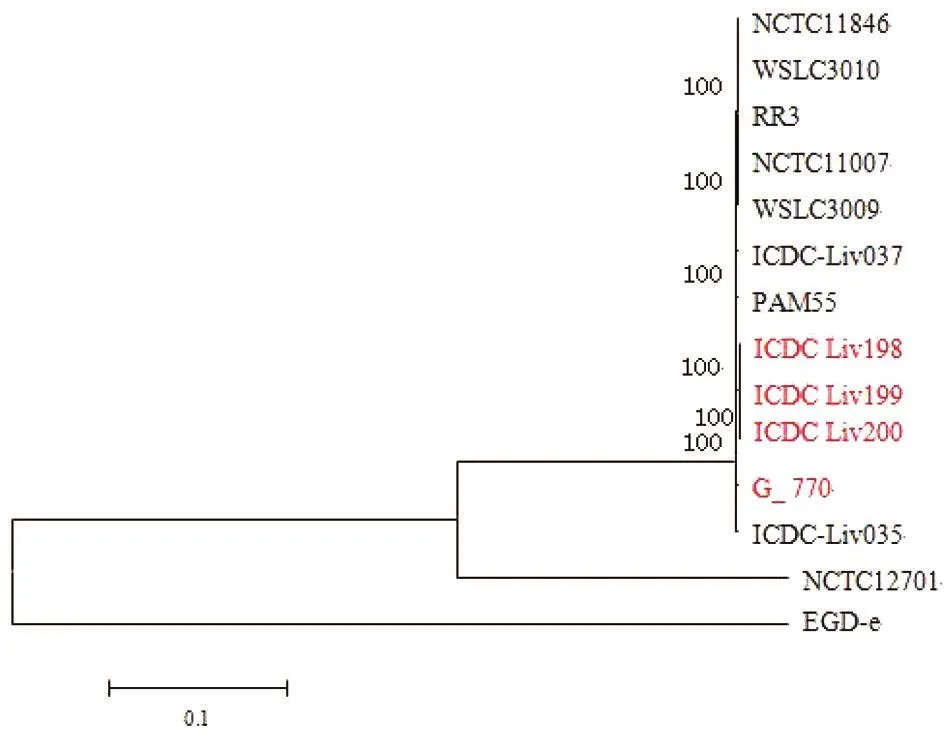
图1 伊氏李斯特菌基于核心基因组SNPs的系统进化分析Fig.1 Phylogenetic relationship of Listeria ivanovii strains based on SNPs of core genes
2.4 耐药基因和前噬菌体基因 通过与耐药基因库(The Co mprehensive Antibiotic Resistance Database)比对,3株伊氏李斯特菌均含22个抗性相关基因 (ileS、cls、al a S、l mr D、mur A、ef r A、l mr C、r po B、EF-Tu、mpr F、Tae A、arl R、r ph B、mf d、gyr A、mec C、mec B、mec A、tet 42、nor B、l mr P、l mr B),其中Identity>80%的耐药相关基因为达托霉素抗性基因mpr F、NO还原酶基因nor B。G_770菌株除此之外还包含van Z等基因。
通过噬菌体网站(http://phaster.ca/)比对Liv198、Liv199以及Liv200菌株分别含有一个长度分别为25.5 kb、27.5 kb和25.5 kb的不完整前噬菌体(命名为Prophage_1),GC含量分别为36.4%、36.5%和36.4%,各有16个编码基因。前噬菌体上有结合胆汁酸水解酶基因、铜抗性基因等。而G_770菌株包含与之类似的前噬菌体基因,长度为25.6 kb,GC含量为36.4%,包含16个编码基因。
2.5 CRISPR位点 3株伊氏李斯特菌基因组各包含一个CRISPR位点,其单元重复序列为TTTACATTTCATAATAAGTAATTAAAACC,在 Liv 198菌株中该单元重复序列重复11次,有10个间隔区,在Liv199和Liv200菌株中该重复序列重复13次,有12个间隔区。下游基因依次编码CRISPR相关蛋白Cas2,I-B型CRISPR相关内切酶Cas1,CRISPR相关蛋白Cas4,CRISPR相关解旋酶/核酸内切酶Cas3,I-B型CRISPR相关蛋白Cas5,I-B型CRISPR相关蛋白Cas7/Cst2/Dev R,I-B型CRISPR相关蛋白Cas8b1/Cst1,CRISPR相关核糖核酸内切酶Cas6。以上基因元件共同构成I-B型CRISPR/Cas系统。G_770伊氏李斯特菌也包含一个I-B型CRISPR/Cas系统,其单元重复序列为GTTTTAATTACTTATTATGAAATGTAAAT,该单元重复序列重复10次,有9个间隔区。Liv198菌株的CRISPR/Cas系统结构见图3。
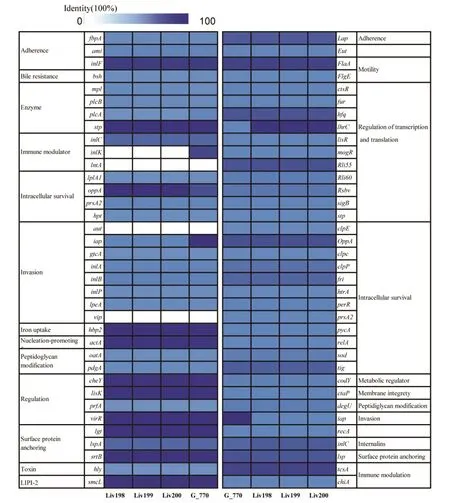
图2 伊氏李斯特菌分离株的毒力相关基因Fig.2 Vir ulence-related genes of Listeria ivanovii str ains
3 讨 论
本研究对养殖场采集的196份奶牛粪便样本进行了李斯特菌的检测,其中伊氏李斯特菌的分离率为1.53%,英诺克李斯特菌为3.06%,国外研究发现动物类养殖场中的饲料、环境及动物相关产品如原奶中伊氏李斯特菌的携带情况较多,携带率约9.2%~25%[21-22],动物粪便中伊氏李斯特菌分离很少[23],但常有由伊氏李斯特菌引起反刍类动物李斯特菌病暴发的报道[13]。伊氏李斯特菌可存在于土壤、水、饲料及养殖环境中,且伊氏李斯特菌有明显的生态偏好,在反刍类动物养殖场周围环境中更常见,为养殖场动物感染的重要来源[11,21,24]。伊氏李斯特菌耐酸、耐盐、耐低温,对消毒剂等有一定抵抗力,生存力较强,从源头、加工环境、运输、储存、销售市场再到消费者家冰箱等各个环节中可以定殖甚至持续存在[3],任一环节出现伊氏李斯特菌污染都可能造成整条食品链的污染。Catherine M等在澳大利亚维多利亚州的7个牧场的牛奶和环境里分离出伊氏李斯特菌,分离率约为3.3%[11]。

图3 Liv198 CRISPR/Cas系统结构示意图Fig.3 CRISPR/Cas systemidentified in Liv198 strain
伊氏李斯特菌污染不仅影响食品质量,对人还有潜在致病性。1992年Cu mmins AJ等首次从英国一名艾滋病患者的血液样本中分离出伊氏李斯特菌,该患者表现为腹泻、发热和明显的神经系统症状,确诊后经阿莫西林治疗2周后好转[25]。1994年Lessing MP等从英国另一名26岁的青年艾滋病患者的血液中分离出伊氏李斯特菌[26];2007年Guillet C等从法国一名肾移植患者的血液和粪便中均分离出伊氏李斯特菌,该患者临床症状表现为腹泻、呕吐、脱水和低热等[6]。2014年Beye M报告了一例由伊氏李斯特菌G_770引起的艾滋病患者死亡的案例[27]。国内李华信等也报道了血和骨髓同时感染伊氏李斯特菌和类志贺邻单胞菌的案例[7]。因此,伊氏李斯特菌对免疫低下的人群有潜在致病风险。Dahshan H等在埃及某一禽类养殖场的鸡饲料、水、鸡肉、养殖场垃圾中首次检测出伊氏李斯特菌,检出率为10%~25%,发现养殖场存在交叉污染现象[22]。由于伊氏李斯特菌可引起动物尤其是反刍类动物的流产、乳腺炎以及李斯特菌病暴发[14,28],除了带来重大经济损失外,还可能通过动物接触及污染食品感染人发生李斯特菌病,因此,对动物中伊氏李斯特菌的监测具有重要的公共卫生意义。
本研究中分离的3株伊氏李斯特菌经MLST鉴定为ST1型,与临床病人分离菌株G_770、病羊中分离的PAM55菌株及曹晓龙等从云南的野鼠中分离的伊氏李斯特菌型别一致,在国外研究的样本中也有相同型别[29]。ST1型为中国多个地区的动物来源伊氏李斯特菌的优势型别,甘霖等通过细胞及动物实验证实ST1型别为高毒力菌株,对人和动物有潜在致病风险[30]。基于核心基因组的SNPs的系统进化分析显示,本研究分离的伊氏李斯特菌与国外分离的PA M5菌株(羊来源)以及G_770(病人来源)同属于一个分支。Liv198和Liv199菌株分离自养殖场同一饲养栏内不同区域的奶牛粪便样本,Liv200分离自另一饲养栏牛群粪便样本,3株菌的核心基因组无SNP差别,提示可能为同一克隆菌株来源。
毒力相关基因分析显示,3株伊氏李斯特菌分离株均携带了毒力岛LIPI-1、LIPI-2,并且粘附、侵袭、定殖能力、动力及毒力基因调节相关的基因均为阳性,提示这3株菌均有致病性。免疫调节基因inl K、int A和侵袭相关基因aut、vip在这3株菌中缺失,但与其功能相似的其他免疫调节基因(inl C、tcs A等)、侵袭相关基因(iap、gtc A、inl A、inl B、inl P、l pe A等)完整,这些基因变化对于3株伊氏李斯特菌的毒力是否有影响还需进一步研究证实。病人来源的伊氏李斯特菌G_770菌株的毒力基因存在情况与3株伊氏李斯特菌分离株相同,但其免疫调节基因inl K阳性,G_770与奶牛分离菌株间是否具有毒力差异还需进一步研究证实。伊氏李斯特菌可以粘附和侵袭人类胎盘羊膜细胞,裂解吞噬泡,聚合宿主细胞肌动蛋白,并且比单增李斯特菌的细胞间扩散能力更强,虽然伊氏李斯特菌在细胞内的存活率低于单增李斯特菌,但对于免疫力低下或缺陷的人来说仍具有潜在感染风险[8,25-26]。
本研究发现3株伊氏李斯特菌分离株携带20个抗性相关基因,但其中Identity>80%的仅有达托霉素抗性基因mpr F、NO还原酶基因nor B。病人来源的伊氏李斯特菌G_770菌株耐药相关基因的携带情况也相似,但其还携带了van Z基因。G_770菌株携带的van Z是Tn1546转座子的一部分[31],该转座子的存在赋予粪肠球菌对糖肽的抗性。在没有Tn1546转座子其他成分的情况下,VanZ赋予了粪肠球菌对替考拉宁(而非万古霉素)低水平的抗性[32]。目前尚未见人和动物来源李斯特菌株对万古霉素耐药的报道[33]。
前噬菌体是一种整合在宿主基因组上的温和噬菌体,插入染色体特定部位,与细菌染色体的复制联系紧密。本研究分离的伊氏李斯特菌和G_770菌株的前噬菌体为不完整噬菌体Prophage1,其以非常保守的形式存在于本研究菌株及PA M55等伊氏李斯特菌伊氏亚种中。Prophage1含有结合胆汁酸水解酶基因、铜抗性基因等[34],这些功能对伊氏李斯特菌的生存能力有关。通常认为伊氏李斯特菌中的伊氏亚种对噬菌体敏感,而伦氏亚种相对耐噬菌体感染[35]。
CRISPR/Cas系统被认为是细菌的重要免疫防线之一,利用小干扰CRISPR RNA(cr RNAs)和靶核酸之间的碱基互补来识别和降解外源遗传元件。CRISPR/Cas包括由不连续的高度保守的重复序列和具有多样性的间隔序列组成的CRISPR位点及位于CRISPR位点附近的cas基因,cas基因编码Cas蛋白 Cas1、Cas2、Cas4,干扰蛋白 Cas3、Cas5、Cas7,以及亚型特异性蛋白Cas8b和Cas6b。G_770与本研究的伊氏李斯特菌存在I-B型CRISPR/Cas系统,可以认为具有抵抗外来入侵元件的能力。
本研究发现国内养殖场奶牛可携带伊氏李斯特菌。通过基因组、毒力基因、耐药基因、噬菌体基因及CRISPR/Cas系统等遗传特征的分析,发现奶牛分离菌株与国外病人分离株在遗传关系及菌株分子特征上具有很高的相似度。伊氏李斯特菌可通过粪便途径污染环境造成动物间的交叉传播。食品加工过程处理不当,人体可能通过摄入伊氏李斯特菌污染的牛奶或牛肉制品而感染,发生李斯特菌病。因此,应重视伊氏李斯特菌潜在的致病风险,加强病原学监测,预防由其所致的人李斯特菌病。
