布鲁氏菌IV型分泌系统效应蛋白BPE043的功能和致病机制研究
2020-08-25罗文博付梦姣冯俊霞卢志宇胡雪媛温博海赵晓冬熊小路周冬生柯跃华
罗文博,付梦姣,焦 俊,冯俊霞,卢志宇,胡雪媛,温博海,赵晓冬,熊小路,周冬生,柯跃华
布鲁氏菌病是由布鲁氏菌(Brucella)侵入机体造成的一种人兽共患病,以流产和发热为特征,对人和动物的生命健康造成了严重威胁[1]。布鲁氏菌为兼性的革兰氏阴性菌[2-4],毒力主要表现为胞内寄生[5]。布鲁氏菌可以通过形成布鲁氏菌泡(BCV)来避免被溶酶体降解,从而在胞内生存和复制[6],不会造成细胞的程序性死亡[7]。
布鲁氏菌IV型分泌系统(Type IV secretion syster ms,T4SS)是贯穿细胞壁和外膜的,由12个基因编码的蛋白组成的复合物[8],是布鲁氏菌致病的主要毒力因子。T4SS主要通过分泌蛋白来干扰宿主细胞的正常功能。其分泌的效应蛋白近些年被不断发现,目前被报道的共有15种[9],大多数效应蛋白的功能和作用机制未知,BPE043是其中之一。本文研究的BPE043保守区域为环状核苷酸结合结构域[10]。其他功能有待研究。
Rab是小G蛋白超家族中最大的旁支,通常被认为是信号调控的分子开关,在调节囊泡的形成、停靠和转移方面起调节作用[11]。Rab蛋白在布鲁氏菌感染细胞后形成的BCV中被发现[12]。本研究以布鲁氏菌野生株104为起始菌株,构建了BPE 043基因的缺失株,通过进行生长曲线测定、小鼠感染能力测定以及筛选有可能与BPE043有相互作用的宿主蛋白等,初步研究了BPE043蛋白的功能,为进一步研究BPE043在布鲁氏菌感染过程中的作用机制奠定了基础。
1 材料与方法
1.1 材 料
1.1.1 菌株 羊种布鲁氏菌104株由中国人民解放军疾病预防控制中心保存,布鲁氏菌BPE 043基因突变株由实验室构建。
1.1.2 试剂 布鲁氏菌培养基Bucella Broth和Bucella Broth Agar购自BD公司;胰蛋白胨大豆琼脂(TSA)购自AOBOX公司;PhantaTMSuper-Fidelity DNA Polymerase、Clon ExpressTMMulti S重组克隆试剂盒购自南京诺唯赞生物科技有限公司;基因组提取试剂盒购自QIAGEN公司;感受态细胞DH5α购自天根生化科技有限公司(北京);抗体购自Cell Signaling Technology(CST)公司;转染试剂盒Lipofecta mine 3000 Transf ection Kit购自invitrogen;免疫共沉淀试剂盒购自上海生工生物有限公司。
1.1.3 实验动物 选取30只SPF级的BALB/c小鼠,均为雌性,6周龄。购于北京维通利华公司。
1.2 方 法
1.2.1 引物合成 本实验所用引物均由北京擎科生物科技有限公司合成。引物序列见表1。

表1 布鲁氏菌BPE 043基因突变株载体构建所需引物Tab.1 Primers for constr uction of BPE 043 gene mutant vector of Brucella
1.2.2 布鲁氏菌BPE 043基因突变株载体的构建根据BPE 043基因两端的序列设计N端和C端的同源臂引物。然后以羊种布鲁氏菌野生株104的序列为模板,以BPE 043-N-F、BPE 043-N-R引物和BPE 043-C-F、BPE 043-C-R引物分别扩增BPE 043基因N端和C端的同源臂。以卡那霉素表达质粒p UC19质粒为模板,用引物KANA-F和KANA-R扩增卡纳抗性基因。将获得的BPE 043左右同源臂和卡那片段进行纯化,利用同源重组试剂盒将纯化片段连入载体p MD-18 T。将载体导入感受态细胞DH5α。在卡那平板上进行筛选后,提质粒测序鉴定。质粒命名为p MD-18T-BPE 043-K。
1.2.3 布鲁氏菌BPE 043基因突变株的构建 将质粒p MD-18 T-BPE 043-K电转化到羊种布鲁氏菌野生株104的感受态细胞中。接种进行活化后,涂布于卡那抗性的布鲁氏菌TSA固体平板上进行筛选,将疑似阳性克隆用卡那替换目的基因的内引物和外引物进行PCR鉴定。将阳性克隆命名为104ΔBPE 043。
1.2.4 突变株与野生株生长曲线的测定 将活化后的羊种布鲁氏菌野生株104和突变株104ΔBPE 043各取2μL分别接种于10 mL布鲁氏菌液体培养基中。在37℃、200 r/min条件下培养至OD600为0.6。将菌液稀释到OD600为0.2。在37℃、200 r/min条件下继续培养。每1 h取样一次测OD值,每个样品做3次重复取均值。直到进入平台期。绘制104和104ΔBPE 043的生长曲线。
1.2.5 小鼠感染试验 将30只雌性、6周龄的BALB/c小鼠随机分为2组,分别接种羊种布鲁氏菌野生株104和突变株104ΔBPE 043(腹腔注射)。接种剂量为1×106cf u/只。2组小鼠分别在接种后的1至5周每周处死3只,测量脾脏重量。剪取0.05 g脾脏于EP管中加800μL的PBS进行研磨,进行合适倍数的稀释后进行涂板。37℃恒温箱中培养48 h后进行菌落计数。
1.2.6 免疫共沉淀寻找布鲁氏菌效应蛋白BPE043的互作蛋白 将鼠源Rab3、Rab 4、Rab 8、Rab 11、13、Rab 14、Rab 35基因克隆至含有Flag标签的真核表达载体上,构建 Flag-Rab 3、Flag-Rab4、Flag-Rab 8、Flag-Rab 11、Flag-Rab 13、Flag-Rab 14、Flag-Rab 35重载质粒。再将BPE 043基因克隆至含有Myc标签的真核表达载体上,构建Myc-BPE 043重载质粒。所有重组质粒均由北京擎科生物科技有限公司合成。用Lipof-ecta mine 3000 Transfection Kit试剂盒在HeLa细胞中分别共转染Myc-BPE 043 和 Flag-Rab 3、Flag-Rab 4、Flag-Rab 8、Flag-Rab 11、Flag-Rab 13、Flag-Rab 14、Flag-Rab 35等质粒,转染质粒浓度为1 000 ng/mL。转染后24 h去掉培养基,细胞用PBS洗涤,再用胰蛋白酶处理,3 000 r/min离心5 min收集细胞。去掉上清,加细胞裂解液和SDS×Loading Buffer。离心后得到上清液。留取少量上清液,其他用免疫共沉淀试剂盒处理(加入抗Myc抗体),得到免疫沉淀物。通过Wester n Blotting来检测上清液和免疫沉淀物中的Myc和Flag标记。
2 结 果
2.1 p MD-18T-BPE 043-K自杀载体的构建与鉴定以羊种布鲁氏菌野生株104为模板,分别用以引物 BPE 043-N-F、BPE 043-N-R 和 BPE 043-C-F、BPE 043-C-R扩增BPE 043基因两端的同源臂;以质粒p UC19为模板,用引物KANA-F和KANA-R扩增卡那抗性基因片段。BPE 043基因两端同源臂以及卡那抗性基因片段的大小均与预期一致。用同源重组试剂盒将同源臂和卡纳基因纯化片段连接载体质粒p MD-18T,获得重组质粒p MD-18TBPE 043-K。以重组质粒为模板,BPE 043-N-F、BPE 043-C-R为引物进行PCR扩增,获得大小为600 bp左右的片段,与预期一致。
2.2 布鲁氏菌BPE 043基因突变株的构建与鉴定将重组质粒p MD-18 T-BPE 043-K转入DH5α中,扩大培养,用卡那平板筛选后,以BPE 043-N-F、BPE 043-C-R为引物进行PCR扩增,获得片段大小为600 bp左右,与预期一致。提取质粒后,电转到羊种布鲁氏菌野生株104中。发生同源重组后,用卡那平板筛选疑似阳性克隆,用内引物N-I-F、N-IR和C-I-F、C-I-R分别扩增野生株104以及疑似同源重组阳性菌株。野生株扩增结果为阴性,疑似阳性克隆N端和C端扩增分别获得大小为163 bp和128 bp的片段,与预期一致(图1)。104ΔBPE 043构建成功。
2.3 突变株与野生株的生长曲线分析 将OD600稀释为0.2的羊种布鲁氏菌野生株104和突变株104ΔBPE 043继续在37℃、200 r/min条件下培养,每隔1 h取样测OD值,连续取样20 h,绘制生长曲线如图2。可见在8 h到12 h之间突变株浓度略低于野生株,其他时间段两菌浓度基本一致。突变株与野生株总体生长趋势大致相同。表明BPE 043基因的缺失并不会对布鲁氏菌的生长情况造成显著的影响。
2.4 小鼠体内感染试验 用羊种布鲁氏菌野生株104和突变株104ΔBPE 043分别对2组小鼠进行腹腔注射1×106cf u/只剂量后,1周后可以在脾脏中检测到布鲁氏菌。比较第1到5周2组小鼠脾脏重量和脾细菌载量。结果显示,第1周2组小鼠脾均肿大,但突变株104ΔBPE 043感染组小鼠体重低于野生株104感染组。第2周2组小鼠脾重均达到最大。之后2组小鼠脾重均开始下降,突变株104ΔBPE 043感染组下降速度较快。2组差值逐渐增大(图3 A);在脾细菌载量方面,第1周2组小鼠脾细菌载量均达到最高值,且突变株104ΔBPE 043感染组低于野生株104感染组。第2周2组小鼠脾细菌载量均下降,二者差值依然较大。之后3到5周野生株104感染组脾细菌载量基本维持不变,而突变株104ΔBPE 043感染组脾细菌载量快速下降(图3B)。结果表明BPE043的缺失降低了布鲁氏菌在小鼠体内的毒力,也降低了其在体内的复制能力。

图1 PCR验证B.melitensisΔBPE 043突变株结果Fig.1 Test of B.melitensisΔBPE 043 mutant strain by PCR
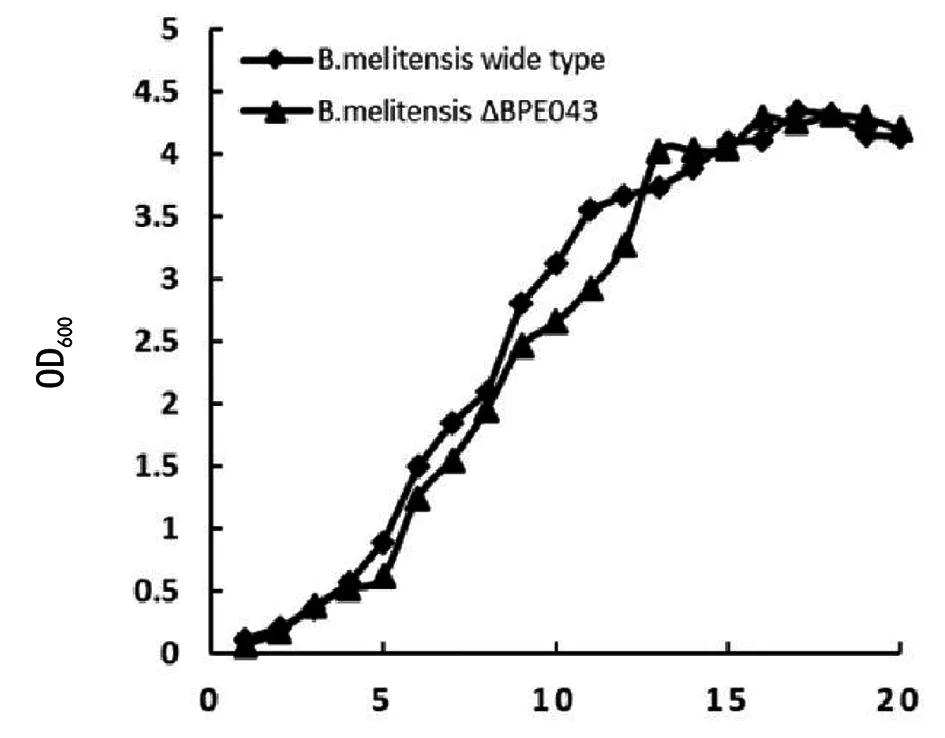
图2 104,104ΔBPE 043生长曲线的测定Fig.2 Growth of the 104,104ΔBPE 043
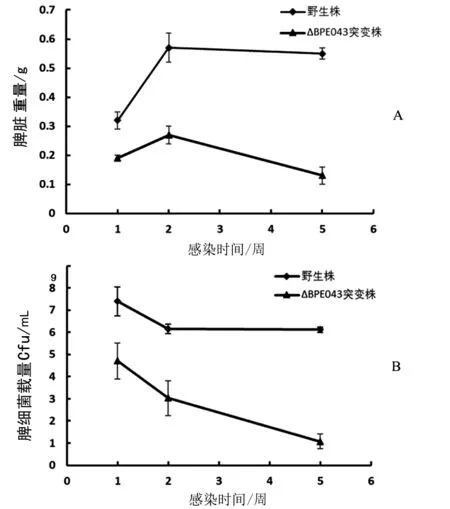
图3 布鲁氏菌野生株104和突变株104ΔBPE 043小鼠体内感染试验中脾脏重量(A)和脾细菌载量(B)分析Fig.3 Analysis of the weight(A)and the bacterial load(B)bet wween WT 104 and 104ΔBPE 043 in the spleen
2.5 免疫共沉淀筛选布鲁氏菌效应蛋白BPE043的互作蛋白 HeLa细胞转染24 h后收取样品,获得上清液;留存少量上清液后,其他部分用免疫共沉淀试剂盒(加入抗Myc抗体)处理得到免疫沉淀物。用Wester n Blotting分别检测各样品的上清液和免疫沉淀物中的Myc和Flag标记。结果如图4。各样品上清液中Myc和Flag检测均为阳性,说明各质粒已成功转入细胞,可排除后续结果中的假阳性;以藕联Myc抗体的填料对样品进行免疫共沉淀,SDS-PAGE检测免疫共沉淀。结果显示所有样品Myc检测全部为阳性,说明Myc-BPE043蛋白被成功沉淀下来。Flag检测显示只有 Myc-BPE043、Flag-Rab4和 Myc-BPE043、Flag-Rab11转染组为阳性,说明BPE043和Rab4、Rab11存在相互作用。

图4 免疫共沉淀筛选BPE043互作蛋白Fig.4 Screening protein interactions of BPE043 by co-immunoprecipitation
3 讨 论
布鲁氏菌IV型分泌系统(Type IV secretion syster ms,T4SS)由vir B操纵子调控,参与布鲁氏菌感染宿主后的胞内活动。T4SS组装完成后,布鲁氏菌即可通过T4SS分泌效应蛋白来感染宿主细胞[13]。目前已经发现了15个由T4SS分泌的效应蛋白[9]。其中VirB调控的效应物A(Vce A)和效应物C(VceC)是最早发现的2个效应蛋白[14]。BPE043和BPE123、BPE005等是另一部分T4SS分泌的蛋白,具有高度保守性[15]。但对其功能和作用机制尚不清楚。因此,本研究对BPE 043基因在布鲁氏菌感染和胞内生存过程中的功能做了初步探索。
研究基因的功能常用到基因敲除的方法。其中同源重组因其可以精准替换目的基因且遗传稳定,是基因敲除中最常用方法。本研究中以羊种布鲁氏菌104为模板,通过同源重组构建了布鲁氏菌BPE 043基因缺失株,进行了生长曲线和小鼠体内感染的测度,筛选了宿主细胞内的靶蛋白,初步说明了BPE 043基因在布鲁氏菌感染和胞内生存过程中起重要作用。
生长曲线测定试验显示,在0到20 h测定时间内,羊种布鲁氏菌野生株104和突变株104ΔBPE 043的生长趋势大致相同。只有在8~12.5 h之间,突变株的细菌浓度略低于野生株。两者差值很小。这有可能与试验偶然性有关。基本可以认为BPE 043基因的缺失不会影响布鲁氏菌的生长趋势。
小鼠体内感染试验显示,羊种布鲁氏菌野生株104和突变株104ΔBPE043感染小鼠后均会在1周后检测到小鼠脾脏重量的升高,说明它们均有致病性,会引起小鼠脾脏的肿大。但野生株感染组小鼠脾脏重量的上升高于突变株感染组,且2周后突变株感染组小鼠脾脏重量持续下降;同样,突变株感染组小鼠脾细菌载量2周后快速下降,而野生株感染组在感染2周以后下降速度变缓,且野生株感染组脾细菌载量全程高于突变株感染组。说明BPE043在布鲁氏菌对小鼠进行体内持续感染的过程中起重要作用。该基因的缺失对布鲁氏菌的毒力影响非常显著。
免疫共沉淀试验显示,在将带有Myc标签的BPE043和带有Flag标签的相关Rab蛋白成功转入细胞后,使用Myc抗体对Myc-BPE043蛋白进行吸附,检测结果全部为阳性。在对Flag的检测中,只有Rab4和Rab11为阳性。说明二者与BPE043存在相互作用。Rab相关蛋白在布鲁氏菌感染宿主形成的BCV中被发现[12],本试验说明BPE043和Rab4、BPE043和Rab11 2对互作蛋白很可能在BCV的形成以及逃避宿主的免疫机制方面起一定的作用。值得注意的是,试验中Rab8和Rab13的阳性结果不是很明显,其是否与BPE043存在相互作用有待于进一步研究。
综上所述,本研究表明BPE 043基因不会影响布鲁氏菌体外的生长特性,但对于布鲁氏菌对宿主的感染和胞内生存有重要作用。并确定了与BPE043存在相互作用的蛋白Rab4和Rab11。为进一步研究BPE043在布鲁氏菌中的功能和致病机制奠定了基础。
