冬凌草PAL基因的克隆及表达分析
2020-08-25黄进勇张济萌郭瀚师岳彩鹏张靖楠
黄进勇, 张济萌, 郭瀚师, 王 璐, 岳彩鹏, 张靖楠
(1. 郑州大学 农学院 河南 郑州 450001; 2. 郑州大学 生命科学学院 河南 郑州 450001)
0 引言
冬凌草(Isodonrubescens)隶属唇形科香茶菜属,主产于河南济源太行山一带,有消炎、抑菌、抗肿瘤等多种药用价值[1-3]。迷迭香酸是冬凌草中天然酚酸类次生代谢物[4-5],有抑菌、抗氧化等多种生物活性[6],在医学方面有较高的利用价值[7]。
迷迭香酸主要通过两条前体分别为苯丙氨酸和酪氨酸[8]的平行分支途径进行生物合成[9],在以酪氨酸为起始物的途径中,酪氨酸氨基转移酶(tyrosine aminotransferase,TAT)是合成RA分子结构上4-羟基苯乳酸部分的限速酶。在苯丙烷代谢支路上,以苯丙氨酸为起始物,苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)是合成RA分子结构上咖啡酰基的关键酶。支路的终产物4-香豆酰辅酶A在迷迭香酸合成酶催化下,合成4-香豆酰-4′-羟基苯乳酸,最后,在细胞色素P450单加氧酶的CYP98亚家族羟化酶的作用下生成迷迭香酸。
迄今,PAL基因在荸荠[10]、柱花草[11]、玉米[12]、木薯[13]、枸杞[14]、陆地棉[15]中相继被克隆,生物学功能被进一步分析,基于其他植物关于迷迭香酸的生物合成途径也有了基本的认知,但冬凌草中该化合物的生物合成途径及其关键酶的功能和调控机制仍未见报道。为了深入了解冬凌草中迷迭香酸的生物合成途径及调控机理,本实验从冬凌草叶片中克隆得到PAL基因,并采用生物信息学的方法预测和分析该酶的基因、相应氨基酸序列的理化性质、系统演化关系等,最后采用实时荧光定量聚合酶链式反应技术,分析了IrPAL在冬凌草不同组织中的表达变化情况,为进一步对冬凌草的开发利用奠定基础。
1 材料与方法
1.1 实验材料
冬凌草种子由郑州大学济源研究院提供,在实验室继代培养,获得冬凌草无菌苗。取样时摘取植株根、茎、叶于液氮速冻后冻存于-80 ℃冰箱备用。
1.2 实验试剂
RNA提取试剂盒购自贝贝生物科技有限公司,cDNA反转录试剂盒购自TaRaKa公司,凝胶回收试剂盒购自OMEGA公司。Prime STAR Max Premix(2×)酶及SYBR Green PCR Master Mix酶购自TaRaKa公司。设计的引物由生工生物工程有限公司合成。
1.3 冬凌草总RNA的提取与cDNA的合成
取冬凌草无菌苗组织加液氮研磨,根据RNA提取试剂盒说明书提取冬凌草总RNA,用超微量核酸蛋白分析仪检测其浓度及纯度,1%琼脂糖凝胶电泳检测其RNA条带,采用TaRaKa反转录试剂盒合成冬凌草cDNA。
1.4 冬凌草PAL基因的全长克隆
从GenBank上获得已录入的PAL基因全长cDNA序列,从开放阅读框(ORF)两端非编码区设计一对特异性引物,PAL-F:5′-CGGTCCATTTGCGCTACTCC-3′;PAL-R:5′-GCTATACGGTGTAATTCGCG-3′。以冬凌草cDNA为模板,以PAL-F、PAL-R为引物进行PCR扩增,扩增条件:95 ℃预变性3 min;95 ℃变性30 s,54 ℃复性30 s,72 ℃延伸1 min,总共35个循环;最后72 ℃延伸5 min。1%琼脂糖凝胶电泳检测PCR产物,所得目的片段按照OMEGA试剂盒的说明书进行切胶回收。将回收产物送到测序公司进行测序。
1.5 冬凌草PAL基因的生物信息学分析
使用在线分析工具Blast对序列进行同源性分析;使用NCBI的ORF finder查找PAL基因的开放阅读框,得到编码的氨基酸序列;利用ProtParam对PAL蛋白质序列的氨基酸组成、等电点及亲疏水性等进行分析;利用Tmhmm 2.0检测PAL蛋白质是否编码跨膜蛋白区;应用SignalP4.1在线分析PAL蛋白是否具备信号肽序列;利用ExPaSy中的psipred分析蛋白序列的二级结构;使用SWISS-MODEL对PAL蛋白进行三级结构建模;使用DNAMAN6.0软件进行同源性分析;利用MEGA6.0软件构建进化树。
1.6 冬凌草PAL基因的组织特异性表达分析
以冬凌草的根、茎、叶的cDNA为模板,以β-actin为内参,进行荧光定量PCR实验,检测PAL基因在不同组织中的表达情况。内参引物β-actin-F:TGGTGTCAGGTTGGGATGG;β-actin-R:CGTGAGAAGAACAGGGTGCT。目标基因引物PAL-F:CGGTCCATTTGCGCTACTCC;PAL-R:CGGTCCATTTGCGCTACTCC。10 μL反应体系:RNase Free dH2O 3 μL;正反向引物均为0.5 μL;SYBR Green PCR Master Mix 5 μL;最后加入cDNA模板1 μL。反应程序:95 ℃ 5 min;95 ℃ 10 s;56 ℃ 20 s;40个循环。
2 结果与分析
2.1 冬凌草总RNA的检测
使用超微量核酸蛋白分析仪检测冬凌草无菌苗总RNA的A 260/A 280值为2.02,且峰形完整明显。如图1所示,经过1%琼脂糖凝胶电泳检测可以看出,总RNA的纯度较高,可以清晰地看到rRNA的3条条带(28SrRNA,18SrRNA,5SrRNA),说明所提RNA完整性较好,可以用于后续的实验操作。
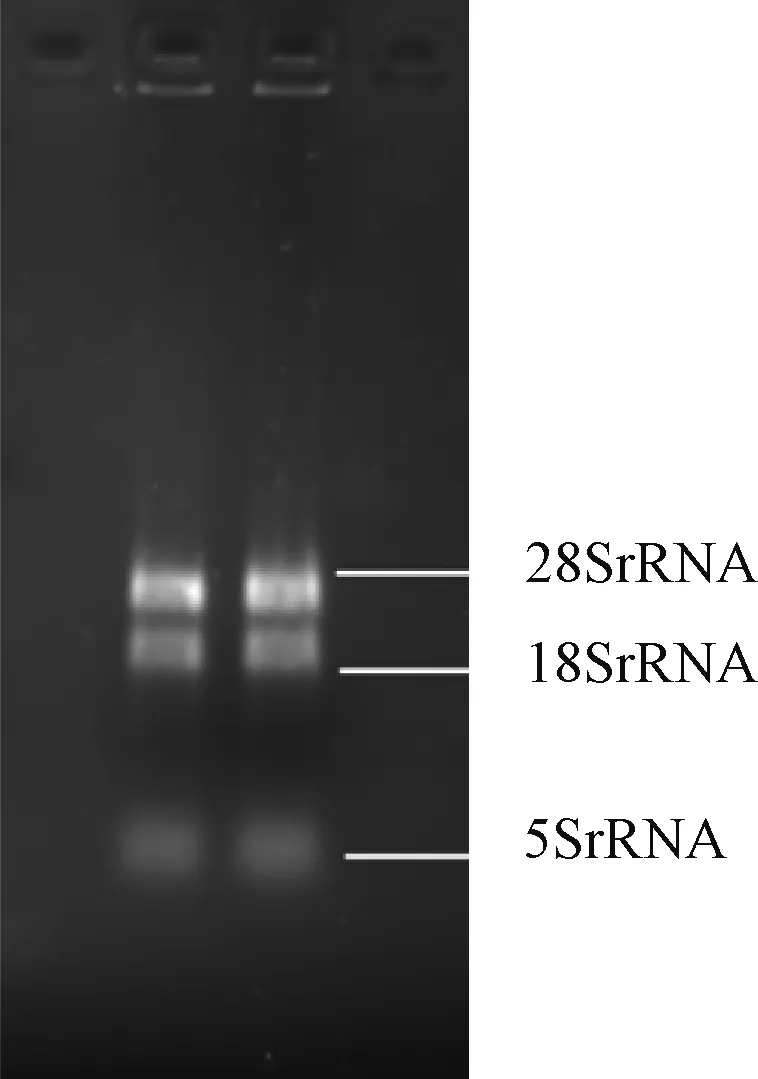
图1 冬凌草RNA凝胶电泳检测Figure 1 Detection of Isodon rubescens by RNA gel electrophoresis
2.2 冬凌草PAL基因的检测
如图2所示,以冬凌草cDNA为模板,根据所设计的引物进行PCR扩增, 1%琼脂糖凝胶电泳检测后,将回收产物送至生工生物工程公司进行测序,测得特异性条带长度为1 116 bp。通过 BLAST 程序检索,该序列与丹参、黄芩的同源性较高,分别为82%、83%,与枸杞,番茄的同源性分别达到79%、77%。

图2 冬凌草PAL基因序列扩增产物Figure 2 Amplification products of PAL of Isodon rubescens
2.3 冬凌草PAL基因的生物信息分析
经过ORF Finder 检测,该序列含有一个大小为522 bp的完整的开放阅读框,编码为173个氨基酸,开放阅读框位于337~858 bp 区域,序列内含有非编码区。利用Expasy 在线工具对序列进行理化性质分析,分子的原子组成为 C1107、H1804、N324、O340、S11,总原子数为3 586,相对分子质量为25.45 kD,理论等电点为9.01,带负电的氨基酸(Asp+Glu)有20个,带正电的氨基酸(Arg+Lys)有25个,不稳定系数是43.26,推测其为非稳定蛋白,平均亲水性为-0.240。
利用ProtScale计算PAL蛋白质的各种氨基酸的亲疏水性,从整体上来看,亲水性氨基酸比疏水性氨基酸多,因此可判定为亲水性蛋白。利用Tmhmm 2.0检测PAL蛋白质是否编码蛋白跨膜区,结果并没有发现跨膜结构。利用SignalP 4.1检测PAL蛋白质是否编码信号肽序列,结果显示其不具备信号肽序列。因此该蛋白不具备膜蛋白和分泌蛋白的特征,很可能是一种游离蛋白。利用NetPhos 3.1磷酸化位点分析工具进行分析,结果显示整个多肽链存在25个氨基酸磷酸化位点,其中丝氨酸23个、苏氨酸12个、酪氨酸4个。
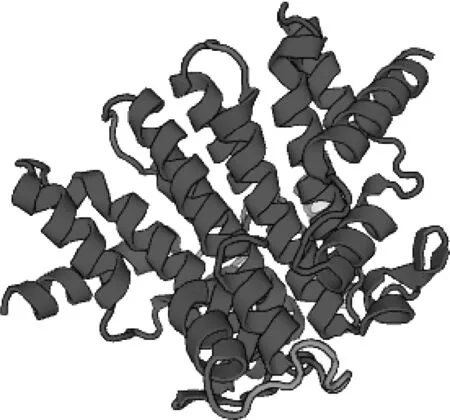
图3 PAL蛋白质三级结构预测Figure 3 Prediction of PAL tertiary structure
利用ExPaSy的psipred程序预测蛋白序列二级结构,结果显示该蛋白的二级结构主要由19段α-螺旋组成,没有β-折叠结构。如图3所示,运用SWISS-MODEL工具对PAL编码蛋白进行三级结构建模。根据同源建模的相关原理,在蛋白质数据库中选择与PAL蛋白序列一致性最高的蛋白为模板进行同源模建,得到PAL蛋白结构模型。与二级结构预测相符,含有大量α-螺旋和不规则卷曲。
选取与冬凌草同源性较高的罗勒、紫苏、丹参、黄芩、番茄、枸杞,利用DNAMAN软件分析PAL蛋白序列的同源性。如图4所示,可见在冬凌草PAL蛋白氨基酸的56~64位点,与其他序列一样含天冬氨酸聚集区,说明具有相关结构域特征。

图4 冬凌草PAL蛋白的同源性分析Figure 4 Homology analysis of PAL from Isodon rubescens
选取相似性较高的11种植物PAL蛋白同源序列,运用 Mega 6.0软件,进行多重序列比对,构建植物PAL基因的分子进化树。结果显示, 冬凌草与唇形科植物罗勒、紫苏、黄芩、丹参、藿香归于一个分支,其中与罗勒、紫苏亲缘关系较近。其他双子叶植物相思树、枸杞、番茄、板蓝根聚为一个分支。油棕与柳叶桉聚为另一大分支。可以看出冬凌草PAL蛋白序列与双子叶唇形科植物之间亲缘关系更近,与单子叶植物的亲缘关系较远。
2.4 冬凌草PAL基因的组织特异性表达分析
采用实时荧光定量PCR的方法,检测PAL基因在冬凌草不同组织中的表达情况。PAL基因在冬凌草根中的表达量最低,叶中表达量最高,叶的表达量是茎的表达量的1.24倍,是根的表达量的2.00倍。
3 讨论与结论
目前对PAL基因家族功能的多项研究发现,该基因家族具有物种多样性,在不同物种不同条件下,参与多种生物代谢。PAL蛋白参与植物次生代谢,除了在唇形科植物丹参中参与迷迭香酸代谢外,还有在咖啡中参与绿原酸代谢积累[16],在黄芩中参与胁迫诱导黄酮类化合物的合成[17],通过次生代谢揭示鲜切荸荠黄化机理[10]、在石榴中参与花青苷合成而导致果实呈色与褐变[18]。同时,研究发现PAL基因响应植物的逆境胁迫,如在柱花草中响应生物胁迫(炭疽菌侵染)与非生物胁迫(干旱和盐胁迫)[11]、在木薯中响应低温胁迫[13]、玉米抗病[12]机理、陆地棉抗病[15]与枸杞对抗干旱和盐逆境[14]的分子机理。
