基于桥接DNA的实时荧光定量PCR高灵敏检测沙丁胺醇
2020-08-24赵领娣孙铁强刘文涛贺鸿伟董博伟张迎春秦天悦宁保安李双彭媛韩殿鹏崔建升高志贤
赵领娣,孙铁强,刘文涛,贺鸿伟,董博伟,张迎春,秦天悦,宁保安,李双,彭媛,韩殿鹏,崔建升,高志贤,*
(1.河北科技大学环境科学与工程学院,河北石家庄050018;2.军事科学院军事医学研究院环境医学与作业医学研究所,天津300050)
沙丁胺醇(salbutamol,SAL),是一种短效 β-2 肾上腺素能受体激动剂,最初用于缓解哮喘和慢性阻塞性肺病等疾病中的支气管痉挛。然而,当使用剂量为治疗剂量的5倍~10倍时,沙丁胺醇可以通过减少脂肪沉积和增强蛋白质含量来提高生长速率和提高饲喂效率;因此,它在养殖业和其他相关农业中被许多商人非法使用以增加瘦肉产量,并且在动物体内富集[1-3]。研究发现β-2-肾上腺素能受体激动剂如沙丁胺醇的摄入,会增加自闭症的风险[4];导致肌纤维肥大,甚至在一定剂量下导致肌肉细胞死亡[5];沙丁胺醇的微量吸入会降低血氧饱和度[6]等。农业部公告明确指出沙丁胺醇是一种禁用药物,不应该在食物或水中检出[7]。因此建立对沙丁胺醇的超灵敏检测技术尤为重要。
针对沙丁胺醇的检测,目前已发展多种基于免疫学的检测方法。基于CdSe量子点(quantum Dot,QD)电化学发光(electro-chemiluminescence,ECL)竞争性免疫测定法[8],基于免疫磁珠和氧化石墨烯/金纳米粒子混合基质的表面增强拉曼技术[9],基于三聚氰胺探针功能化的金纳米粒子比色检测方法[10],基于碳纳米管的电化学检测方法,并通过差分脉冲伏安法(differential pulse voltammetry,DPV)测量评估该沙丁胺醇的电化学传感性能[11]。基于局部表面等离子体共振(localized surface plasmon resonance,LSPR)传感的无标记无试剂免疫法[12]等等。然而,这些检测方法灵敏度不足或设计复杂,限制了它们的开发和广泛应用。
DNA分子由于其强大的序列可编程性和准确的分子识别能力而被广泛用于生物传感[13]。目前有许多信号放大策略来开发基于DNA的敏感生物传感器[14]。其中20世纪90年代发展起来的实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)已成为一种成熟的扩增技术,广泛应用于基因检测。在传统PCR的基础上,同步实现DNA的扩增和定量,具有高灵敏性,特异性[15-16]。在DNA walker和折纸技术等不同的生物传感策略中,必须设计独特的DNA分子序列以产生独特的分子结构[17]。在本研究中,利用基于桥接DNA的邻近连接技术的普通ssDNA实现信号放大。
Cheng-ting Tsai等[18]利用抗体的双价识别抗原的能力,设计基于抗原抗体特异性识别和连接酶特异性识别的原理,从而构建低背景值的高效DNA信号放大传感器。这些传感器利用两个DNA连接的抗原分子与同一抗体分子结合,诱导短DNA结构域的互补杂交,形成全长扩增子,通过扩增反应进行信号放大。在性质上与邻近连接实验类似,通过抗体的多价结合驱动抗原DNA偶联物的凝集,抗原可以是小分子[19]、蛋白质[18]、外泌体[20]等任何可以与DNA做连接的物质。该方法不需要复杂的DNA设计,在显著降低其背景值的同时具有较高的灵敏度。
本研究结合免疫磁珠、桥接DNA-DNA连接酶介导的DNA融合技术构建了一种高灵敏检测沙丁胺醇的方法,该检测方法有效的降低背景值,提高了灵敏度,在环境、医学等领域具有良好的应用价值。
1 材料与方法
1.1 材料
1.1.1 主要仪器
TGL-16C离心机:上海安亭科学仪器厂;DYY-11型电泳仪:北京六一仪器厂;IQ350凝胶成像系统:美国GE公司;OSE-96干式恒温金属浴:北京天根生化科技有限公司;MS3 Basic涡旋振荡器:德国IKA公司;GNP-9050BS恒温培养箱:上海新苗医疗器械制造有限公司;MyGo Pro实时荧光定量PCR仪:IT-IS Life Science Ltd。
1.1.2 主要试剂
沙丁胺醇标准品(SAL)、牛血清白蛋白(bovine serum albumin,BSA):美国 Sigma-Aldrich 公司;沙丁胺醇多克隆抗体(B180517):北京博尔西科技有限公司;Dynabeads抗体偶联试剂盒:美国Thermo Fisher Scientific公司;磁珠封闭液:百迈格生物公司;PBST缓冲液(含0.05%Tween 20):北京索莱宝生物科技有限公司;DNA连接酶(A8101):美国Epicentre生物技术公司;qPCR kit:上海星汉生物科技有限公司;超纯水(>18.0 MΩcm)。所有DNA样品均由上海生工生物工程有限公司合成(经HPLC纯化),核酸序列见表1。

表1 试验所用核酸序列Table 1 DNA sequences used in this study
1.2 方法
该方法首先将磁珠偶联抗体形成免疫磁珠IAb。同时设计了一对寡核苷酸探针DNA1、DNA2,每个寡核苷酸链由40 nt碱基组成。使用SMCC连接方法,将SAL-BSA与3'SH游离末端DNA寡核苷酸(DNA 1)偶联以制备SAL探针1与5'SH游离末端DNA寡核苷酸(DNA 2)偶联制备SAL探针2,两个寡核苷酸探针同时与同一抗体分子结合,使两个探针进入相同的复合物分子,显著增加探针两个短序列的局部有效浓度。然后,这两个短序列经过与桥接DNA(bridge)碱基互补配对、在特异性DNA连接酶的作用下形成80 nt全长扩增子,即AbD的桥联结构。通过磁分离将AbD结构分离,进一步降低背景值。之后采用实时荧光定量PCR实现信号放大并进行检测。
1.2.1 免疫磁珠的制备。
准确称取5 mg的M270磁珠粉末(磁珠直径2.8 μm)放入1.5 mL离心管内,使用C1溶液洗涤后加入 20 μL(2.3 mg/mL)的兔多抗,再加入 230 μL 的 C1溶液和C2溶液250 μL至总体积500 μL。置于垂直混旋仪中37℃孵育20 h。加入缓冲液多次洗脱后加入500磁珠封闭液室温(25℃)4 h后重悬在500 μL缓冲体系中,在4℃下储存供下一步使用。
1.2.2 DM探针的制备
取 60 μL sulfo-SMCC的 HEPES缓冲液稀释(7.5 nmol/L),加入20 μL 沙丁胺醇-OVA(10 mg/mL 约222 nmol/L),避光反应 30 min。加 20 μL HS-DNA(10 μmol/L)溶液,4℃过夜。使用30 kDa超滤管10 000 r/min 离心 1 次,2 min/次。
1.2.3 检测方法的建立
取免疫磁珠储备溶液、探针1、2各5 μL体积加入一个1.5 mL离心管中,加入PBST至50 μL,其中探针浓度为10 nmol/L,将混合物在37℃孵育30 min,并用100 μL 0.05%PBST洗涤两次。重悬到120 μL含有连接酶、桥接DNA的连接缓冲体系中(20 mmol/L Tris,25 mmol/L KCl,10 mmol/L MgCl2,7.5 mmol/L DTT,0.5 μmol/L NAD,0.021 U/μL ligase,100 nmol/L bridge oligo,0.01%TritonX-100,pH 8.0),在 30℃下孵育15 min。并用130 μL 0.05%PBST洗涤两次。磁分离,PBST洗涤2次3 min/次,磁分离1 min。重悬在50 μL体系中作为模板。在10 μL qPCR Master mix中加入上下游引物(5 μmol/L)各 0.5 μL,同时加入 5 μL 模板,加入ddH2O制备20 μL体系。qPCR系统程序设置(95℃:300 s;95 ℃:10 s;60 ℃:30 s;72 ℃:30 s;45 T)。
1.2.4 特异性
应用浓度为1 ng/mL的沙丁胺醇、莱克多巴胺、特布他林、苯氧丙酚胺、克仑特罗对1.2.3建立的方法进行特异性检验。
1.2.5 模拟实际样品检测
将沙丁胺醇按500、5 000、10 000 pg/mL依次分别加入到自来水、人工尿液中,应用1.2.3建立的方法进行回收检测。
2 结果与讨论
2.1 可行性分析
成功偶联抗体与磁珠、抗原与DNA之后首先对试验的可行性进行了验证,加入免疫磁珠与只加入磁珠的对照组相比,前者具有更低的Ct值,与对照组差异明显,证明该方案可以通过加入不同浓度的沙丁胺醇竞争结合免疫磁珠而产生不同的Ct值实现对沙丁胺醇的定量检测。
2.2 条件优化
为了实现用于小分子检测的生物传感器的最佳性能,优化了免疫磁珠浓度及桥接长度。两条连接小分子的寡核苷酸链在免疫磁珠的作用下与bridge杂交是AbD的独特之处。首先对bridge的连接作用进行了测试。设计了 20、18、16、14、12nt bridge 5 个优化长度,见图1。
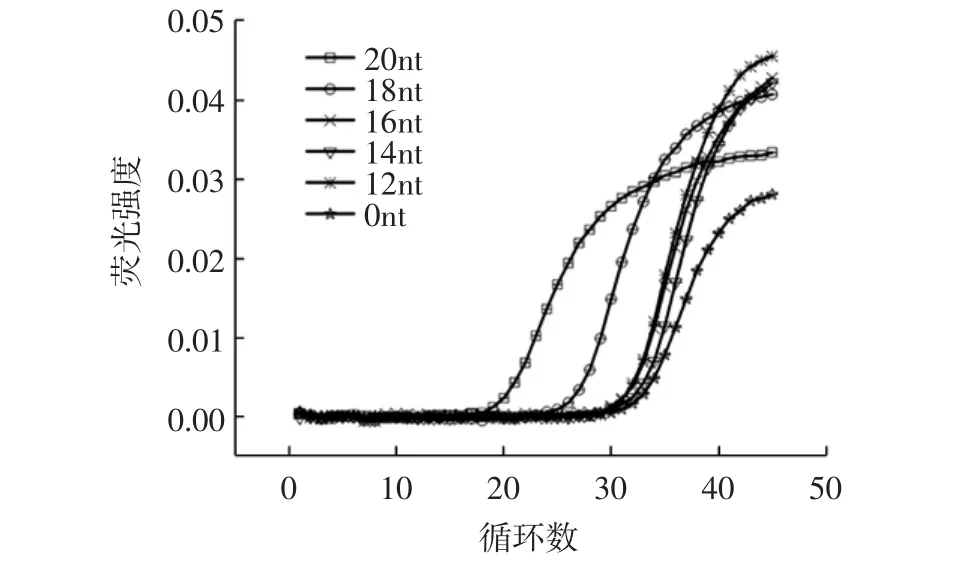
图1 不同桥接长度DNA自诱导连接的能力测定Fig.1 Determination of the ability of DNA to self-induced ligation of different bridging lengths
选用不同长度bridge,在高浓度DNA探针存在并且不加IAb时,可以通过自身高碰撞率,分子间亲和力结合在一起,bridge序列越长,连接作用越大,进行qPCR的模板越多,产生的Ct值越小。16、14、12nt的长度下产生的Ct值接近0nt(背景对照)产生的Ct值,表明bridge长度在16nt时进入平台期,连接能力几乎为零。我们使用20、18、16nt序列长度做进一步优化,将免疫磁珠调整为能形成AbD的桥联结构的最适比例,防止DNA高浓度后的自连接。一个抗体可能同时连接两个5'端修饰小分子DNA、或两个3'端修饰小分子DNA,这都是不希望出现的结合,不能形成AbD结构。优化抗体浓度及反应体系的大小避免这种潜在问题的出现。
免疫磁珠浓度梯度依次为 6、60、600、6 000 ng/mL及控制组。同一抗体浓度下加入不同长度的bridge,观察Ct值变化,见如图2。
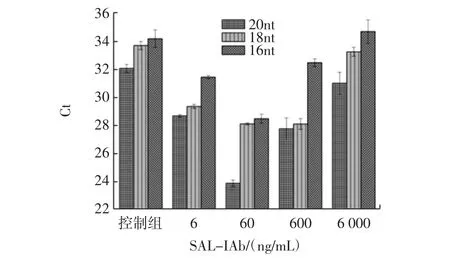
图2 在不同桥接长度下不同免疫磁珠浓度的Ct值响应Fig.2 The Ct value response for different immunomagnetic bead concentrations at different bridge lengths
更长的bridge有更高的结合效率,Ct值越小,表明增加bridge长度增强了所需AbD的形成。如果茎序列太长,它们可以在不存在与靶标结合的抗体的情况下自发地杂交在一起,这种分子间杂交会降低检测灵敏度。抗原抗体之间存在一个最佳结合浓度,抗原抗体任何一个浓度增大,都会抑制二者之间的结合。抗体浓度为60 ng/mL时,产生的Ct值最小,效果最佳。综上,该体系的最佳反应条件:抗体浓度60 ng/mL、bridge 长度 20nt。
2.3 方法性能
利用本方法检测不同浓度的沙丁胺醇标准品。将具有不同浓度的SAL添加到反应系统中以确定在优化条件下的检测范围和灵敏度,结果如图3所示。

图3 检测不同浓度沙丁胺醇工作曲线Fig.3 Linear calibration curves for detection of RT in different concentration
随着小分子浓度的增加,传感器的Ct值逐渐增大。基于Ct值的响应,获得具有在1.0×10-2ng/mL~1.0×103ng/mL范围内的良好线性关系的校准曲线,线性方程为 y=0.826lg(x)+24.29,相关系数(R2)为 0.999 2。在与分析实际样品完全相同的条件下,做不加入被测组分的重复测定即空白试验。根据空白值的平均值加3倍标准偏差计算SAL的检出限(LOD)为1.2×10-2ng/mL。该方法具有检测范围宽、操作简单、灵敏度高等优点。
2.4 特异性检测
为了测试该方法的特异性,选择沙丁胺醇的结构、功能类似物莱克多巴胺、特布他林、苯氧丙酚胺、克仑特罗作为对照物。其特异性检测结果见图4。
2.5 样品加标模拟检测
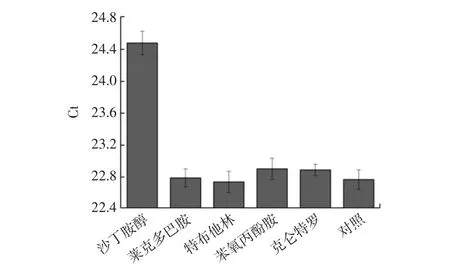
图4 方法的选择性Fig.4 Specificity test of this method
采用本方法检测自来水及人工尿液样品中的沙丁胺醇。自来水及人工尿液分别首先在10 000 r/min下离心5 min,取上清液,然后加入一定浓度的沙丁胺醇进行检测,结果见表2。
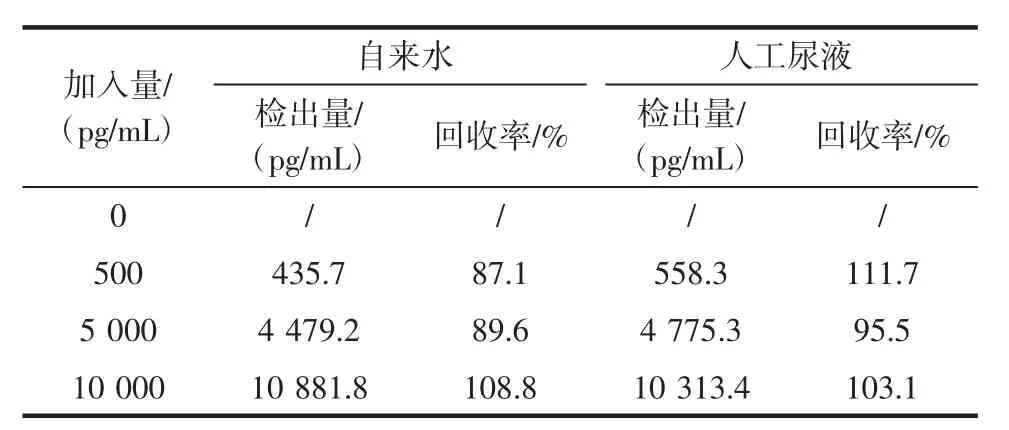
表2 自来水和人工尿液中沙丁胺醇加标回收测定结果(n=3)Table 2 Recoveries of RT in tap water and artificial urine samples(n=3)
加标回收率在87.1%~111.7%之间,根据标准偏差/计算结果的算术平均值得到相对标准偏差RSD<5.1%,表明本方法灵敏度较高,准确性较好,可用于自来水和尿液实际中沙丁胺醇的的检测。
3 结论
构建了一种基于免疫磁珠、桥接DNA-DNA连接酶介导的DNA融合技术构建了一种高灵敏检测沙丁胺醇的方法,通过抗体特异性识别两个邻位连接探针在桥接DNA的作用下,形成全长扩增子,以此为模板扩增实现信号放大,沙丁胺醇的检出限为1.2×10-2ng/mL,用于自来水及尿液中沙丁胺醇的检测,效果良好。本方法操作简单,不需要复杂的DNA设计;线性范围宽、灵敏度高。本方法适用于任何可以与DNA连接的抗原物质,对于其它目标物的检测具有一定的借鉴和参考价值。
