H2O2玉米浸泡工艺及其浸泡液中菌群结构的变化
2020-08-24刘庆艾马恒马耀宏杨俊慧史建国
刘庆艾,马恒,马耀宏,杨俊慧,史建国
(齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东省生物传感器重点实验室,山东济南250014)
我国是世界第二大玉米生产国,其加工产品涉及食品、医疗、餐饮、造纸、纺织等多个领域,年产值达1万亿以上,在国民经济发展中占有重要地位[1-3]。目前玉米淀粉生产主要采用湿磨技术,浸泡是第一道也是最重要的一道工序,浸泡质量直接影响后序工序的正常生产,影响淀粉的产量和质量[4-5]。传统的玉米浸泡工艺普遍采用亚硫酸溶液进行浸泡,存在生产周期长、成本高、效率低、能耗高等缺点[6-7],同时释放的SO2气体污染环境,还会在一定程度上造成设备腐蚀、地下水污染、产品中亚硫酸残留等问题[8-9]。Ruan曾用O3代替亚硫酸加入到玉米浸泡液中,取得了良好的浸泡效果[10],但是该研究需要增加O3发生装置,工艺较为复杂,因此本研究选用同样具有氧化作用的H2O2作为浸泡剂。乳酸在玉米浸泡液中具有重要作用,研究表明,乳酸能够促进玉米蛋白质软化和膨胀,保持溶液中的镁离子和钙离子,有利于减少不溶性物质的沉积[11-13]。乳酸和亚硫酸联合作用,可增强对玉米的浸泡效果,加速水分进入玉米籽粒,缩短浸泡时间,促进玉米中淀粉和蛋白质之间的分离,从而提高玉米淀粉的产率和质量[14]。
本研究利用H2O2与乳酸协同浸泡玉米,并通过正交试验对其浸泡工艺进行优化,获得最优浸泡条件。H2O2分解后的副产物为氧气和水,不会造成环境污染,解决了传统浸泡工艺中亚硫酸带来的环境污染问题。同时,利用Miseq高通量测序技术分析玉米浸泡过程中细菌群落的变化[15-17],了解浸泡过程中细菌的组成结构及变化规律,为玉米浸泡过程中微生物的调控提供理论基础。
1 材料与方法
1.1 材料与试剂
玉米:山东济宁菱花集团有限公司(含水量12.03%);H2O2、乳酸:国药集团药业股份有限公司;DNA提取试剂盒:Omega Soil DNA Kit(50);其他试剂均为国药分析纯。
1.2 仪器与设备
LE204E电子天平、S220多参数测试仪:梅特勒-托利多仪器(上海)有限公司;303A电热恒温培养箱:南通宏大实验仪器有限公司;电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司;JYL-C23九阳料理机:九阳股份有限公司;LXJ64-01离心机:河北省吴桥电机厂;SBA-40D生物传感分析仪:山东省科学院生物传感器重点实验室;SIGMA 1-14小型台式高速离心机:西格玛奥德里奇(上海)贸易有限公司。
1.3 试验方法
1.3.1 传统浸泡工艺(实验室模拟逆流法浸泡)
在实验室中使用8个5L大烧杯(1#-8#)模拟实际生产过程中的8个玉米浸泡罐,在新装罐玉米中加老浆,浸泡时间长的玉米加新酸,罐与罐之间每10 h进行一次循环,浸泡70 h后进行淀粉分离并计算淀粉得率。
1.3.2 H2O2玉米浸泡工艺单因素试验设计
使用乳酸与H2O2协同浸泡玉米,考察初始乳酸浓度、乳酸作用时间、H2O2浓度和H2O2作用时间4个因素对淀粉得率的影响。
1.3.2.1 乳酸浓度
称取(50±0.1)g玉米,浸泡温度为(50±2)℃,分别使用乳酸浓度为 0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%的浸泡液浸泡玉米,作用时间16 h,粉碎;然后在浸泡液中添加浓度为2%的H2O2溶液,作用时间22 h,浸泡完毕进行淀粉分离并计算淀粉得率。
1.3.2.2 乳酸作用时间
称取(50±0.1)g玉米,浸泡温度为(50±2)℃,使用浓度为 0.6%的乳酸分别浸泡玉米 6、8、10、12、14、16、18、20 h,粉碎;然后在浸泡液中添加浓度为2%的H2O2溶液,作用时间22 h,浸泡完毕进行淀粉分离并计算淀粉得率。
1.3.2.3 H2O2浓度
称取(50±0.1)g玉米,浸泡温度为(50±2)℃,使用浓度为0.6%的乳酸浸泡玉米,作用时间16 h,粉碎;然后分别在浸泡液中添加浓度为0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%的H2O2溶液,作用时间22h,浸泡完毕进行淀粉分离并计算淀粉得率。
1.3.2.4 H2O2作用时间
称取(50±0.1)g玉米,浸泡温度为(50±2)℃,使用浓度为0.6%的乳酸浸泡玉米,作用时间16 h,粉碎;然后在浸泡液中添加浓度为2%的H2O2溶液,作用时间分别为 12、14、16、18、20、22、24、26 h,浸泡完毕进行淀粉分离并计算淀粉得率。每个试验做3个平行试验。
用料理机细粉碎浸泡后的玉米,所得玉米浆依次过50、250目筛,除去胚、种皮、麸质等。滤液4℃静置过夜,3 000 r/min离心去除蛋白质后,烘干至恒重,称重并计算淀粉得率。
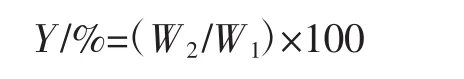
式中:Y 为淀粉得率,%;W2为淀粉质量,g;W1为玉米干重,g。
1.3.3 H2O2玉米浸泡工艺正交试验设计
在单因素试验的基础上,对初始乳酸浓度、乳酸作用时间、H2O2浓度、H2O2作用时间4个因素作3个水平的正交试验L9(34)。以淀粉得率为评价指标,研究H2O2与乳酸协同浸泡玉米的最优工艺。试验设计见表1。

表1 正交试验因素水平表Table 1 The orthogonal experiment factor level table
1.3.4 Miseq高通量测序技术分析浸泡过程中菌群结构的变化
1.3.4.1 总DNA的提取及聚合酶链式反应(polymerase chain reaction,PCR)扩增
在最优条件下利用H2O2与乳酸协同浸泡玉米,在浸泡时间为 5.5、11、16、21.5、27、32.5、38 h 时,取 100 mL玉米浸泡液,抽滤得总DNA样品,分别编号y1、y2、y3、y4、y5、y6、y7。利用土壤 DNA 提取试剂盒按照操作说明进行DNA的提取[17]。每个试验做3个平行试验。
1.3.4.2 PCR产物纯化及定量
以样品的基因组总DNA为模板,乳酸菌16S rDNA 引物为 338F:5′-ACTCCTACGGGAGGCAGCAG-3′和 806R:5′-GGACTACHVGGGTWTCTAAT-3′为引物。PCR试验采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,20μl反应体系:
5 ×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,ForwardPrimer(5μmol/L)0.8μL,ReversePrimer(5μmol/L)0.8 μL,FastPfu Polymerase0.4 μL,牛血清蛋白(bovine albumin,BSA)0.2 μL,Template DNA10 ng,补 ddH2O 至20 μL。
PCR反应参数:
1)1×(3 min 95 ℃)
2)循环数×(30 s 95 ℃;30 s 55 ℃;45 s at 72 ℃)
3)10 min 72℃,直到停止。
1.3.4.3 高通量测序
PCR产物进行连接、克隆后,送至上海美吉生物医药科技有限公司测序。
1.3.4.4 QIIME软件数据分析
使用QIIME软件来定量控制数据质量[18-20]。得到的序列进行分类单位(operational taxonomic unit,OTU)聚类分析,对所有序列进行OTU划分,对97%相似水平下的OTU进行生物信息统计分析,之后进行分类学分析,并在各个水平(门,纲,目,科,属,种)统计每个样品的群落组成。对样品的OTU进行细菌结构组成、Alpha多样性分析和环境因子典范对应分析(canonical corresponat encearalysis,CCA)相关分析,通过比对和统计分析得到浸泡过程中细菌的组成结构及变化规律。
2 结果与讨论
2.1 单因素试验结果
2.1.1 初始乳酸浓度对淀粉得率的影响
淀粉得率随初始乳酸浓度变化曲线如图1所示。
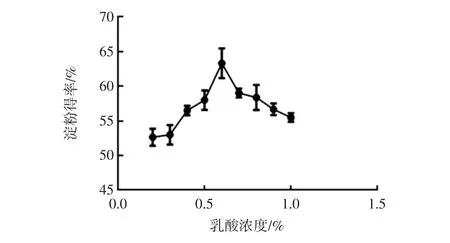
图1 淀粉得率随初始乳酸浓度变化曲线Fig.1 The curve of starch yield changing with the initial concentration of lactic acid
由图1可知,在一定浓度范围内,玉米淀粉得率随初始乳酸浓度的增加而增加,当初始乳酸浓度达到0.6%以上,玉米淀粉得率随初始乳酸浓度的增加反而下降。这可能是因为,乳酸在初始作用阶段可以促进玉米表皮软化,蛋白质疏松,保持溶液中的Ca2+/Mg2+等主要离子浓度,加速浸泡水进入玉米颗粒内部并与内部结构作用;但过高浓度的乳酸在提高蛋白质溶解度的同时会导致蛋白质变性,与淀粉颗粒的分离更加困难。因此选择0.5%、0.6%、0.7%作为正交试验的乳酸浓度因素水平。
2.1.2 乳酸作用时间对淀粉得率的影响
乳酸作用时间对玉米淀粉得率的影响如图2所示。

图2 淀粉得率随乳酸浸泡时间变化曲线Fig.2 The curve of starch yield changing with the steeping time of lactic acid
由图2可知,16 h内淀粉得率随乳酸作用时间的延长不断提高,16 h后趋于稳定。这可能是因为乳酸作用时间过长会导致蛋白质变性,使得淀粉和蛋白质的分离更加困难,因而淀粉得率降低。综合节约能源及提高淀粉得率双方面的考虑,选择14、16、18 h作为正交试验的乳酸浸泡时间因素水平。
2.1.3 H2O2浓度对淀粉得率的影响
H2O2浓度对玉米淀粉得率的影响如图3所示。

图3 淀粉得率随加H2O2量变化曲线Fig.3 The curve of starch yield changing with the content of H2O2
由图3可以看出,淀粉得率随着H2O2浓度的增加而不断提高,当H2O2浓度增加至2%之后,玉米淀粉得率趋于稳定。因此,选择2%、2.5%、3%的H2O2量作为正交试验的H2O2浓度因素水平。
2.1.4 H2O2作用时间对淀粉得率的影响
H2O2作用时间对玉米淀粉得率的影响如图4所示。
由图4可知,淀粉得率随H2O2作用时间的延长而不断提高,当H2O2作用时间延长至24 h后,玉米淀粉得率趋于平稳,原因可能是H2O2破坏蛋白质网的反应趋于平衡。因此,选择18、20、22 h作为正交试验的H2O2作用时间因素水平。
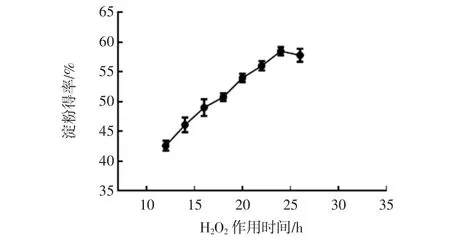
图4 淀粉得率随H2O2作用时间变化曲线Fig.4 The curve of starch yield changing with the action time of H2O2
2.2 正交试验结果
正交试验结果及分析如表2所示。
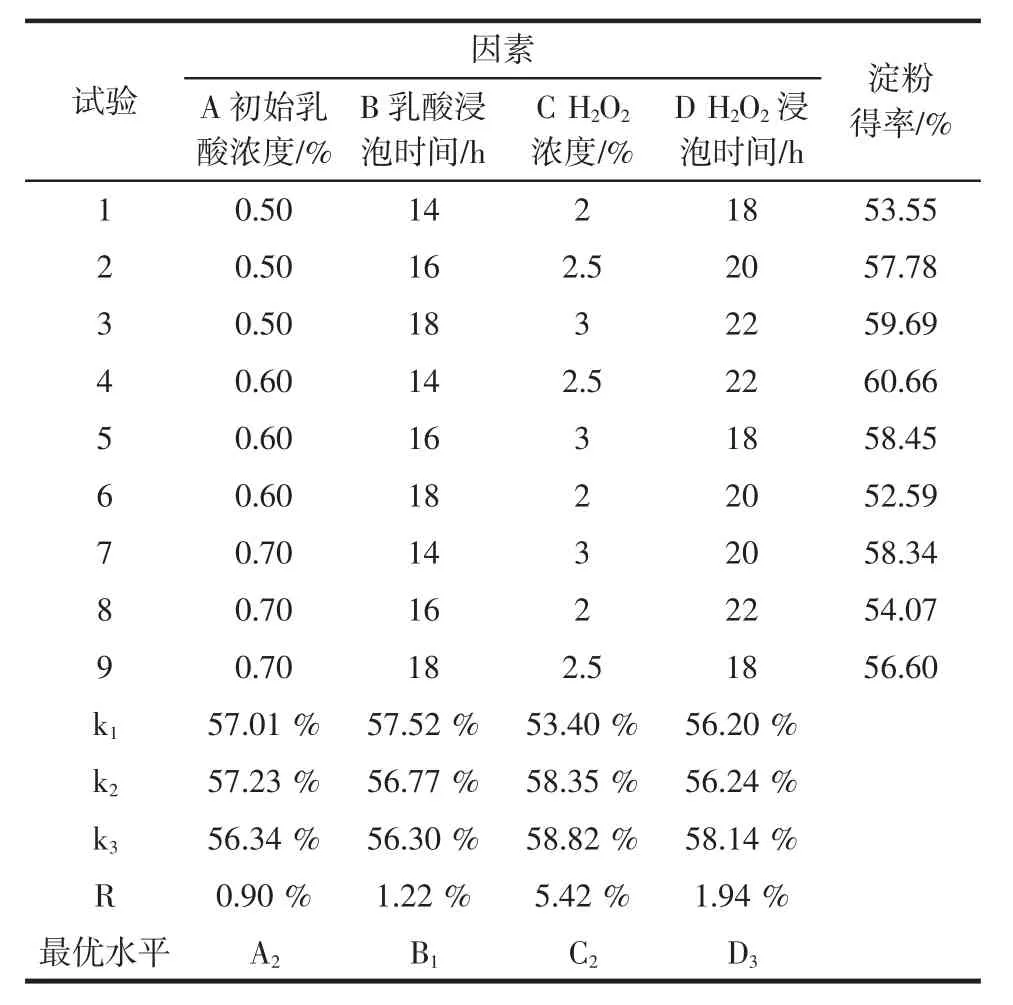
表2 正交试验结果及分析Table 2 Orthogonal test results and analysis
由表2可知,根据极差值R可知,影响H2O2玉米浸泡效果的因素顺序为:C>D>B>A,其中H2O2浓度对浸泡效果的影响最大,H2O2作用时间次之,影响最小的是乳酸浸泡时间。由正交试验结果确定H2O2玉米浸泡工艺的最佳浸泡条件为:A2B1C3D3,即乳酸浓度0.6%、乳酸作用时间16 h、H2O2浓度3%、H2O2作用时间22 h。在最优浸泡条件下,淀粉得率由传统浸泡工艺的56.02%提高到68.53%,浸泡时间缩短至38 h。
2.3 浸泡过程中细菌群落结构的变化
应用MiSeq测序平台对不同浸泡时间取得的样品进行16SrDNA基因测序,共获得56个细菌OUT,分属 于细菌的6个门、38个属。如图5所示。

图5 不同浸泡时间的玉米浸泡液细菌结构组成Circos图Fig.5 Microbial community structure by Circos of 16S rDNA genes in different time of corn steeping process
由Circos图分析可知,玉米浸泡过程中的主要菌种分别为:鸟乳杆菌(Lactobacillus-aviarius);G-芽孢杆菌(unclassified-g-Bacillus);乳酸片球菌(Pediococcus-acidilactici);G-乳杆菌(unclassified-g-Lactobacillus);人阴道乳杆菌(Lactobacillus-coleohominis)。
对不同浸泡时间的样品进行群落组成分析和Alpha多样性分析,结果如图6所示。
图6-A群落组成分析结果表明,浸泡前期,OTU10(芽孢杆菌)与OTU31(片球菌)在该样品序列组成中占主要部分,随时浸泡时间延长OTU37(乳杆菌)序列逐渐增加并成为优势菌种序列,而浸泡末期OTU10(芽孢杆菌)与OTU31(片球菌)又成为优势菌种序列。图6-B Alpha多样性分析结果表明,初期浸泡液中细菌结构组成较为丰富,浸泡5.5 h时OUT水平明显高于其他时间段,随浸泡时间的延长物种丰富度逐渐降低。造成该结果的主要原因是,初期浸泡液中细菌种类复杂,对玉米浸泡起主要作用的乳酸杆菌数量较少,随浸泡过程的进行,浸泡液中的温度、pH值等环境因素愈加适合乳酸杆菌的生长,使其成为优势菌种。
2.4 浸泡过程中群落结构与环境相关性分析
玉米浸泡过程中的细菌群落与环境因子的CCA相关分析如图7所示。
分析结果表明,细菌群落结构与浸泡温度、pH值、葡萄糖、乳酸含量等因素相关系数较高,这与浸泡条件变化有关。乳杆菌生长代谢产生乳酸,导致浸泡环境中pH的变化,浸泡初始阶段与结束阶段OTU10(芽孢杆菌)与OTU31(片球菌)生长受pH值影响较大,酸性环境对菌群结构产生影响;浸泡中期,优势菌种OTU37(乳杆菌)受酸性环境影响不明显,浸泡环境温度轻微浮动可能对细菌菌落结构产生一定影响;乳酸、葡萄糖的含量变化代表了浸泡液中主要作用细菌代谢产物及生长需求底物的变化,故乳酸、葡萄糖的含量变化对细菌菌群结构变化相关系数更高,存在差异显著性。在考察的4种环境因子中,除温度与其他3种因素呈负相关外,其他3种因素间均为正相关。
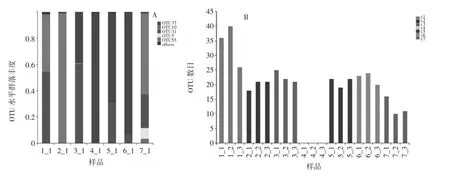
图6 玉米浸泡不同浸泡时间细菌结构群落组成分析(A)与Alpha多样性分析图(B)Fig.6 Microbial community structure by Community barplot analysis(A)and Alpha diversity estimators(B)of 16S rDNA genes in different time of corn steeping process
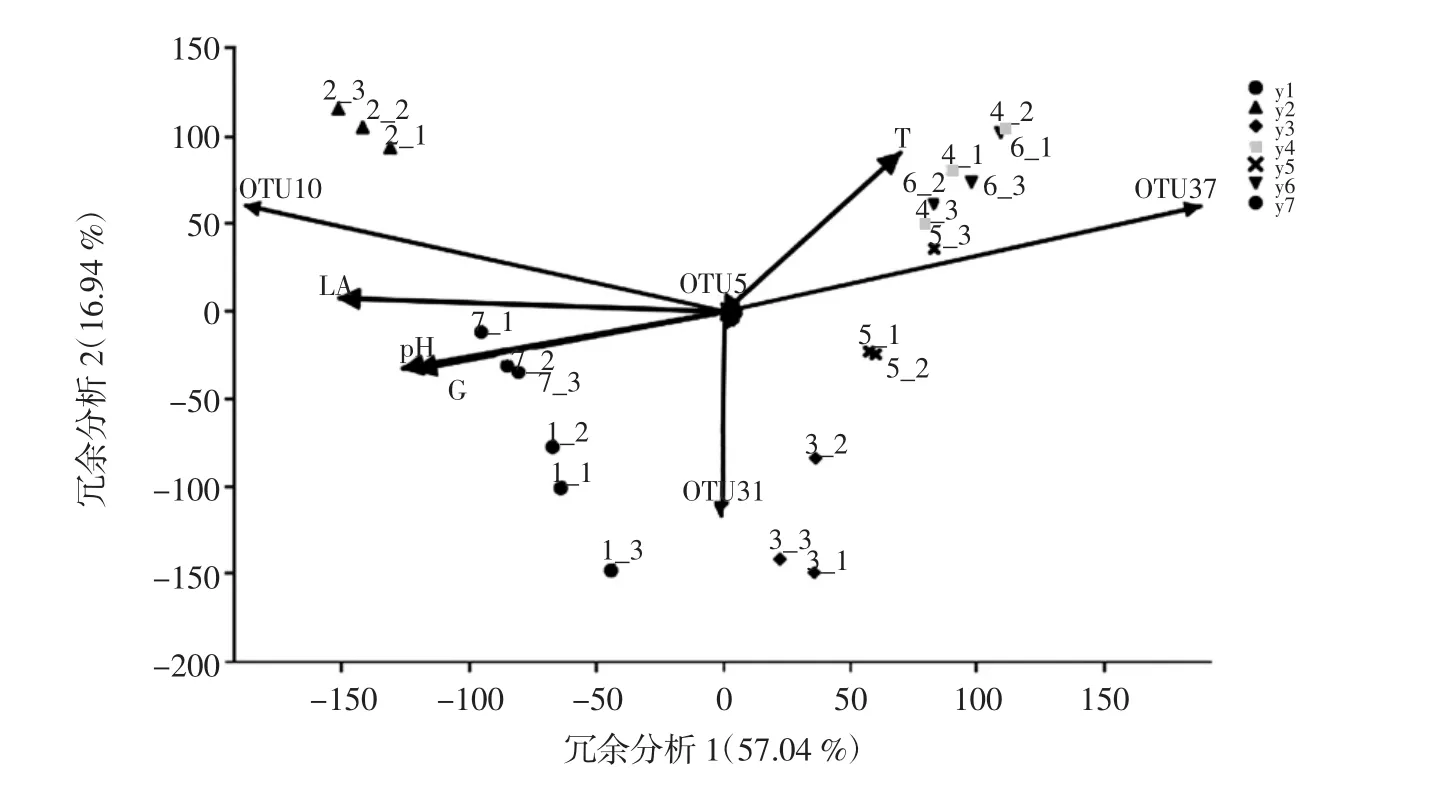
图7 玉米浸泡不同浸泡时间细菌结构与环境因子的CCA相关性分析Fig.7 Microbial community structure by RDA on OUT level analysis of 16S rDNA genes in different time of corn steeping process
3 结论
本研究利用H2O2与乳酸协同浸泡玉米,通过正交试验确定最优浸泡条件,并利用Miseq高通量测序技术对浸泡过程中的细菌进行多样性分析,从而达到优化生产工艺、提高浸泡效率的目的。对影响玉米浸泡效果的4个因素进行单因素试验和正交试验,以淀粉得率为评价指标得出最优浸泡条件。正交试验表明,玉米浸泡的最优条件为初始乳酸含量0.6%、乳酸作用时间16 h、H2O2浓度3%、H2O2作用时间22 h,在最优条件下,淀粉得率由传统工艺的56.02%提高到68.53%,浸泡时间缩短32 h。利用Miseq测序平台对不同时间段的浸泡液细菌结构进行分析,共获得51个细菌OUT。浸泡初期细菌结构组成较为丰富,片球菌属(Pediococcus)与杆菌属(Bacillus)在浸泡过程中起主要作用;随着浸泡时间的延长,乳酸杆菌(Lactobacillaceae)数量增加、作用能力增强,成为优势菌种并伴随OTU水平的降低;而浸泡末期随着浸泡环境的变化(Lactobacillaceae)进入衰亡期,其他细菌数量明显增加,片球菌属(Pediococcus)与杆菌属(Bacillus)成为优势菌种。分析浸泡液中细菌群落与环境因子的相关性,发现浸泡过程中对菌落结构差异产生影响的环境因素依次为乳酸含量、葡萄糖含量、浸泡液pH值、浸泡温度。
新型玉米浸泡技术可以提高玉米淀粉得率,缩短浸泡时间,减少环境污染,解决了传统浸泡工艺中亚硫酸带来的环境污染问题。不同浸泡时间的细菌结构中特定的细菌种类不同,利用Miseq高通量测序技术分析该浸泡条件下细菌组成结构及变化规律,可以为浸泡过程中微生物调控提供基础,从而达到优化生产工艺、提高浸泡效率的目的。
