沉默高表达CDX2胃癌细胞中HNF4α表达水平的变化*
2020-08-22沈和德杨文秀褚明亮易韦张著学
沈和德,杨文秀,褚明亮,易韦**,张著学
(1.贵州医科大学 基础医学院, 贵州 贵阳 550004;2.贵州医科大学附属医院 病理科, 贵州 贵阳 550004; 3.贵州医科大学附属人民医院 病理科, 贵州 贵阳 550002)
胃癌是来源于胃黏膜上皮细胞的恶性肿瘤,其发病率在我国居于恶性肿瘤的首位[1-2]。肠上皮化生是胃癌重要的癌前病变之一,主要分为小肠型化生(Ⅰ型肠化生)和结肠型肠化生,后者又分为Ⅱ型和Ⅲ型肠化生[3],而Ⅲ型肠化生发生胃癌的风险性较高[4-6]。在1975年,病理学家就提出胃癌的“瀑布”发展模式[7],国内外的资料也显示胃癌发生与其他恶性肿瘤一样是多基因、多阶段变异累积的结果[8-9]。尾核同源盒转录因子2(caudal-related homeobox factor 2,CDX2)由311个单氨基酸组成,通过螺旋-环-螺旋结合于DNA的相应区域调节DNA的表达[10]。Mesquita等[11]的研究表明,CDX2在正常胃黏膜无表达,在多数胃黏膜肠化生呈阳性表达,说明CDX2异位表达是发生肠化生的重要调控因子。生理状态下,CDX2 只在肠道表达,CDX2胃黏膜上调表达可诱导肠上皮化生[12-13],并认为该标志物在胃癌中起着重要的作用[14]。肝细胞核因子4α(hepatocyte nuclear factor 4α, HNF4α)是肝细胞核因子受体超家族中的一员,其编码基因位于人染色体20q13.12,包含12个外显子和11个内含子[15]。HNF4α是在多细胞动物中发现的核受体超家族的一种高度保守成员,在成人肝细胞中被称为组织特异性基因表达的主要调节因子[16-17]。HNF4α在胚胎的肝脏、肾脏、胰腺和胃肠组织中都有表达,在肠组织有较高表达[18-23]。查阅文献未见胃癌中CDX2与HNF4α相关研究报道,因此,本研究通过构建两者在胃癌细胞(AGS细胞)蛋白中表达,应用基因过表达、基因沉默及Western Blot 等方法研究两者间的关系。
1 材料与方法
1.1材料与试剂
AGS、BGC-823、 MGC-803、 MKN-45和 SGC-7901 这5种胃癌细胞购自中科院上海干细胞库,兔抗人CDX2单克隆抗体来自北京中杉金桥,二抗来自武汉三鹰生物技术有限公司,HNF4α单克隆抗体来自Abcam公司,二抗来自Santa公司,凝胶电泳仪、ClemidocTMTouch Imaging System、ClarityTMWestern Ecl substrate来自BIO-RAD公司,SDS-PAGE凝胶配制试剂盒来自于碧云天生物技术公司,彩虹180广谱蛋白Marker来自Solarbio公司,In-Fusion HD Cloning Kits为Clontech公司产品,PrimeSTRAR HS 为TaKaRa公司产品,XbaI、BamHI均为BioLabs公司产品,细胞转染试剂jetPRIME购自 Polyplus公司,质粒抽提试剂盒和凝胶DNA快速回收试剂盒购于北京天根技术有限公司。
1.2方法
1.2.1胃癌细胞的培养 从液氮中分别取出冻存的AGS、BGC-823、MGC-803、MKN-45和SGC-7901这5种胃癌细胞,立即置于37 ℃的水浴锅中,使其迅速融化,然后将彻底融化的细胞转移至3 mL含血清和双抗的DMEM高糖的完全培养液中,将800 r/min离心 5 min,弃上清;用1 mL培养液将细胞重悬,将重悬后的细胞接种至25 cm2的培养瓶中,加入完全培养液,使其体积为5 mL,把细胞置于37 ℃、5%的CO2培养箱中培养,次日换液;密切观察细胞生长状态,每隔2~3 d换液。当细胞处于对数生长期、融合度达80%的时候,进行细胞传代,然后提取细胞蛋白。
1.2.2高表达CDX2、HNF4α胃癌细胞株的筛选 采用Western blot法,将提取的5种胃癌细胞蛋白,进行凝胶电泳转膜后、TBST液洗膜3次、每次各5 min,用封闭液封闭2 h后分别加入CDX2(1 ∶1 000)或HNF4α(1 ∶500)一抗,在4 ℃冰箱孵育过夜后TBST洗3次,分别加上相应二抗,孵育1 h,TBST液摇床上洗膜6次、每次各10 min,曝光显影、观察结果。以内参GAPDH(1 ∶20 000)作为内参照。
1.2.3CDX2基因沉默胃癌细胞株的构建 根据GenBank上CDX2的基因序列,利用Primer Premier 5软件设计,CDX2上游引物为5′-CCGGGGACAGAAGATGAGTGGAATTCTCGAGAATTCCACTCATCTTCTGTCCTTTTTG-3′,下游引物为5′-AATTCAAAAAGGACAGAAGATGAGTGGAATTCTCGAGAATTCCACTCATCTTCTGTCC-3′。上述序列用Blast search检测确定无同源性,此引物由上海生工技术有限公司合成。将合成后的引物插入慢病毒snRNA线性化载体上,其慢病毒载体连接和慢病毒转染方法参考文献[24]构建沉默CDX2 AGS胃癌细胞模型(模型组),以转染空载AGS细胞作为对照。
1.2.4在沉默CDX2 AGS胃癌细胞中CDX2、HNF4α蛋白表达 以沉默CDX2 AGS胃癌细胞模型作为模型组,转染空载体AGS细胞作为对照组,分别收集培养2~3 d的2组胃癌细胞,提取总蛋白,CDX2、HNF4α蛋白表达水平检测方法同1.2.2项。
1.3统计学方法
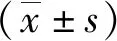
2 结果
2.1CDX2与HNF4α蛋白高表达的胃癌细胞筛选
图1显示,HNF4α、CDX2在胃癌细胞株AGS中均有高表达。因此本研究选择胃癌细胞株AGS作为后续研究的胃癌细胞株。
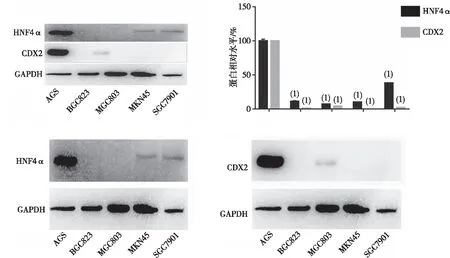
注:(1)与AGS细胞比较,P<0.05。图1 高表达CDX2与HNF4α蛋白胃癌细胞筛选(Western blot)Fig.1 High expression CDX2 and HNF4α proteins in gastric cancer cells screening (Western blot)
2.2沉默CDX2胃癌细胞模型的构建
如图2所示,与对照组比较,CDX2基因沉默后AGS胃癌细胞中的CDX2蛋白明显降低,差异有统计学意义(P<0.01),提示CDX2基因沉默AGS胃癌细胞株构建成功。

注:(1)与对照组比较,P<0.01。图2 两组胃癌细胞中CDX2与HNF4α蛋白表达(Western blot)Fig.2 Expression of CDX2 and HNF4α proteins in gastric cancer cells of two groups(Western blot)
2.3CDX2基因沉默的AGS细胞株中HNF4α蛋白表达
如图3所示,与对照组比较,CDX2基因沉默后AGS肠型胃癌细胞中HNF4α蛋白表达明显降低,差异有统计学意义(P<0.01)。
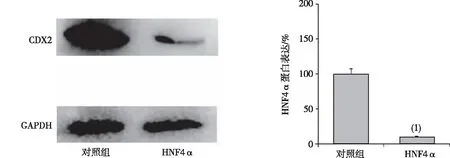
注:(1)与对照组比较,P<0.01。图3 沉默CDX2的AGS细胞中HNF4α蛋白表达(Western blot)Fig.3 Expression of HNF4α protein in AGS cells silencing CDX2(Western blot)
3 讨论
流行病学研究资料证实,胃黏膜肠化生的病人发生胃癌的风险明显增高,高达正常人的10倍[25]。Gonzalez等[26]对2 286例胃组织活检病理标本进行收集,运用前瞻性研究结合回顾性研究的研究方法,发现 91.6%的胃癌患者合并有Ⅲ型胃黏膜肠上皮化生;对胃黏膜伴有Ⅲ型肠上皮化生的患者进行随访可以提高早期胃癌的诊断率。You 等[27]收集了1989—1990年3 000多例经胃镜活检、病理诊断为胃癌癌前病变的住院病人的临床资料,并对这些病人进行随访,于1994年又对这些病人进行了内窥镜和组织病理学检查,Logistic回归分析结果显示,胃镜检查发现有轻度肠化生的病人其胃癌发生风险是正常人的 17.1 倍,对于重度肠化伴有萎缩的病人,这一风险高达 29.3 倍。这充分说明胃黏膜肠上皮化生的发生与胃癌高度相关。在近来的研究发现HNF4α在肠化生及肠型胃癌细胞核也存在阳性表达[21]。特别是在Saandi等[22]的研究发现HNF4α与CDX2在结直肠癌存在相关性。
所以本实验研究通过CDX2和HNF4α在5种胃癌细胞系中的表达发现,其两者均在AGS胃癌细胞都有较高的表达;筛选了AGS细胞蛋白作为基因沉默靶细胞,并且成功构建CDX2的沉默质粒在AGS胃癌细胞沉默表达,实验结果显示在CDX2基因沉默的AGS细胞蛋白中,HNF4α也呈低表达。
综上所述,在高表达AGS胃癌细胞中沉默CDX2后,HNF4α也出现低表达,说明CDX2和HNF4α蛋白在胃癌细胞中存在相关性表达,其具体机制有待进一步的研究。
