基于BN的疫苗全产业链质量安全监测分析
2020-08-22谢小良陈秀銮陈赛昭
谢小良,褚 琦,陈秀銮,陈赛昭
(湖南工商大学 数学与统计学院,湖南 长沙 410205)
一、文献综述
疫苗全产业链过程大致可分为研发、审批、生产、流通和上市接种5个基本阶段,每个阶段都存在不同的质量安全风险。与一般药品相比,疫苗具有如下公益性:一是对控制传染病流行、防控疫情蔓延有着十分重要的保障作用。2019年十三届全国人大常委会第十一次会议表决通过的《中华人民共和国疫苗管理法》,明确规定疫苗是国家战略性和公益性产品,是用来预防和控制传染病的一个非常有效的公共卫生手段。2020年新冠病毒爆发,成为罕见的肆虐全球的大传染病,在这样严峻的环境下,任何无法根治的治疗手段都只是暂时有效的。长远来看,若要遏制病毒进一步扩散,防止疫情卷土重来,最好的办法就是尽快研发有效的疫苗,以保证人们的生命安全(严景华,2020)[1]。二是涉及公共安全和国家安全。近年来,我国疫苗问题屡屡曝光。2016年3月,山东省公安破获一件重大非法疫苗案,疫苗未经严格冷链储存运输销往各个省份,严重影响了人民群众的身心健康。2018年长春长生生物科技有限公司生产冻干人用狂犬疫苗的过程中存在记录造假的行为,该事件曝光后引发了社会舆论的广泛关注,使得公众对疫苗丧失信任(冷光颖,2020)[2]。因此,查找疫苗监管薄弱环节与风险敏感因素,成为政府、监管部门、社会和学者们关注的热点。
国内外相关研究中,有关疫苗全产业链质量安全问题的研究主要集中在如下几个方面:一是优化规章制度管理保障疫苗质量安全的政府行为。2016 年“山东疫苗”事件(赵欣悦,姜柏生,2019)[3]后,国家制定了新的《疫苗流通和预防接种管理条例》,这项规定要求疫苗采购只能通过省级公共资源交易平台进行,规定疫苗生产企业应直接向县级疾控机构配送二类疫苗,疫苗行业改为“一票制”,并对企业规模、经营水平、组织冷链运输的能力要求更严、更高。2018 年“长生疫苗”事件发生后,习近平总书记签发《中华人民共和国疫苗管理法(征求意见稿)》,对疫苗质量安全监管提出了更细致、更全面、更严格和更规范的要求,并且对疫苗管理的相关要求由部门规章上升到法律的层面,监管力度升级,强调疫苗的战略性和公益性。二是疫苗安全质量风险评估研究。2005年由美国、日本和欧盟三方药品监管部门和制药行业发起人要求将质量风险管理与评估引入到药品生产过程中。Lorely Milá(2012)[4]将失败模式效应分析法应用于评估疫苗制造风险。Mila(2010)和Pujol(2013)[5-6]基于质量风险评估与控制方法,对转基因烟草生产疫苗的生产过程进行质量风险管理。近年来,虽然我国通过与国外的相关部门学习与交流,将药品质量风险管理与评估等内容加入到《药品生产质量管理规范》,制定了《生产质量管理规范》。但与国外相比,我国药品质量管理与风险评估起步较晚,尤其在风险评估方面还处在学习与实践阶段。张燕(2016)[7]介绍了Tasly Jenner公司如何运用质量风险评估工具来对疫苗生产过程的质量进行风险评估与控制研究。田素霞(2018)和李涛(2020)[8-9]分别利用失败模式影响分析法和质量风险管理理念,研究疫苗冷链运输过程中的质量风险。郭莹(2019)[10]采用归纳总结及分析评估方法,对疫苗产品生命周期各阶段的质量风险管理进行研究。
综上所述,国内疫苗全产业链质量安全的研究,主要集中在疫苗质量安全风险防范的政府规制、疫苗质量安全风险的影响因素,以及疫苗质量安全突发事件应急处理策略的定性分析上,而从疫苗全产业链过程定量分析疫苗质量安全风险概率的研究极其少见。为此,本文将疫苗全产业链过程视为一个相互关联、具有一定因果关系的复杂系统,通过建立基于贝叶斯网络(Bayesian Network,BN)的疫苗全产业链风险评估模型,试图为国内疫苗质量安全风险监测提出一种有效的预测和诊断方法,为进一步加强疫苗质量安全薄弱环节的监管,防范疫苗质量安全突发事件的发生提供决策参考。
二、疫苗全产业链风险评估指标体系
整体而言,我国疫苗管理体系已初步形成。2011年,我国的疫苗管理体系已经通过了世界卫生组织的评估,并且在2014年通过了复评。但从近几年的疫苗问题事件来看,我国疫苗管理体系依然存在“头重脚轻”的问题,即重审批、轻监管。目前我国疫苗监督管理包括了上市许可、批签发、上市后监管(包括监测接种后的不良反应)、实验室管理、监管检查(GMP)和临床试验监管6项职能,涵盖了疫苗从研发到接种的每个环节[11-12],如图1所示。
结合图1和疫苗监管相关法律规定及文献,对每个环节的风险因素进行分析,最后总结得到如表1所示的风险评估指标体系。
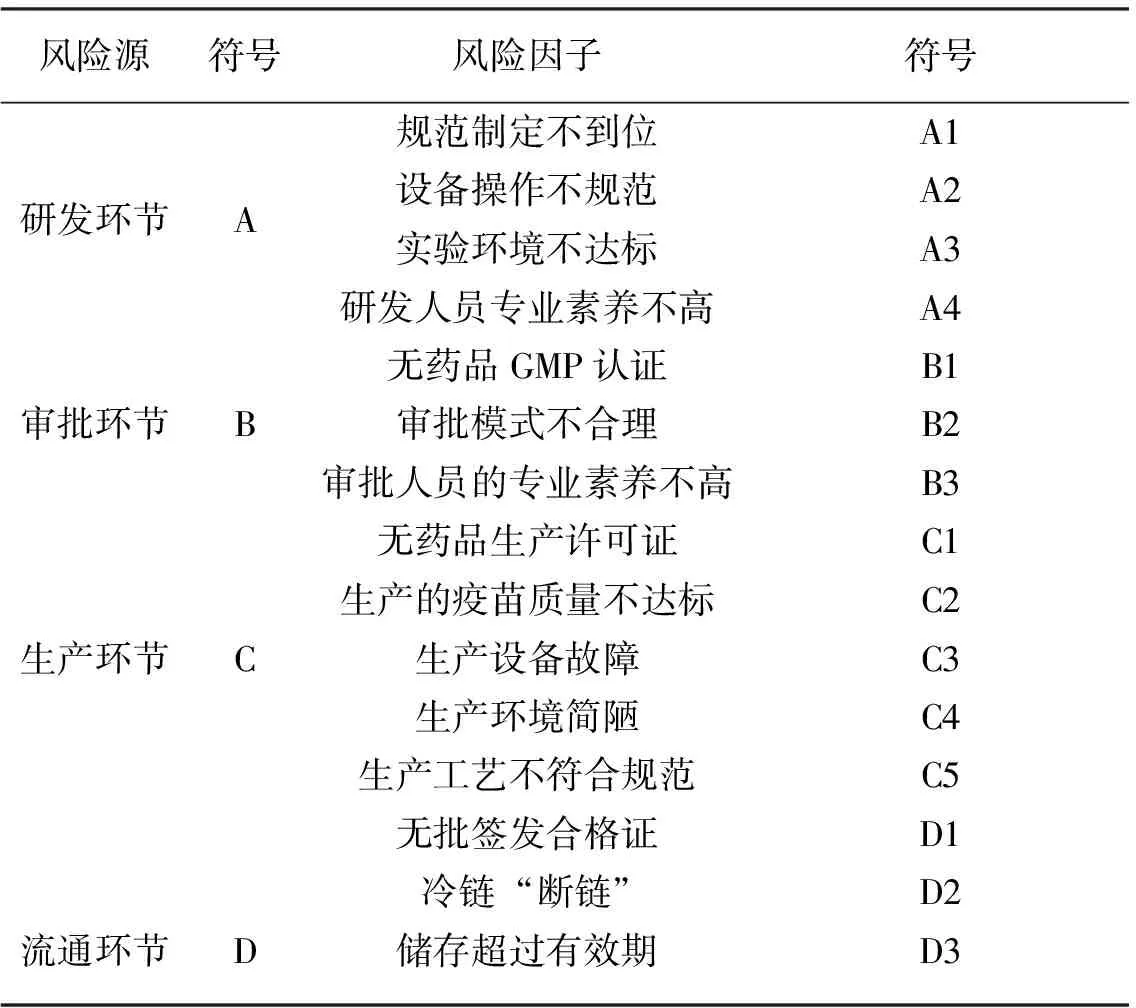
表1 疫苗全产业链质量安全风险因子(BN节点)描述

图1 我国疫苗监管职能图
(一)研发环节
在疫苗的研发过程中,除了临床设计之外,测试程序的软件必须是高要求、高标准的,进行临床试验的实验室也要符合操作规范。现行的优良实验室规范和优良临床试验管理规范,对临床试验和实验室都有详细的要求,包括疫苗研发实验室的人员专业素养、设备的操作流程等。基于此,本文将规范制定不到位、设备操作不规范、实验环境不达标、研发人员专业素养不高作为本环节的风险指标。
(二)审批环节
审批专家是审评的主体,其第三方立场十分重要。中国药检所雷殿良(2002)[13]在剖析法国、美国对生物制品的管理经验时发现,国外为了确保审评的公正性,杜绝了寻租现象,其生物制品审批采用的是内外专家共同审评的模式,并且审评专家不能与企业存在任何关系。何闽江(2011)[14]也提出了要专门设立疫苗的质量评估机构,要对上市的疫苗进行质量评价,从而促进疫苗生产企业之间的良性竞争。范晨阳等(2007)[15]提出了新的疫苗管理模式,其中包括了成立疫苗管理和论证机构,以及实行专家论证等制度。由以上研究可知,审评专家委员会所处的立场、审评人员的技术能力、专业水平及责任心将会对疫苗的审评结果产生极其重要的影响,因此本文将审批人员的专业素养不高、审批模式不合理作为本环节的风险指标。
(三)生产环节
2010年出台的《关于进一步加强疫苗质量安全监管工作的通知》中提出,必须加强疫苗生产环节监管,加强管理疫苗生产工艺、设施、环境等,逐步淘汰落后的生产方式,以及存在安全风险的防腐剂、辅料等生产的疫苗品种。因此本文将生产设备故障、生产环境简陋、生产工艺不符合规范和生产的疫苗质量不达标作为本环节的风险指标。《药品生产质量管理规范》明确了整个生产过程的安全要素,疫苗生产企业必须严格遵循此规范进行疫苗生产,包括对实验室、车间、原材料的严格把关。在这里,企业对规则的遵守程度就变得尤为重要,而药品生产许可证正是对企业生产疫苗的肯定,因此将药品生产许可证的持有作为本环节的风险之一。
(四)流通环节
有效性和安全性是衡量疫苗质量安全的两大基础。相关专家认为,效价指标不合格的疫苗虽然对人体无害,但是很有可能会影响免疫保护效果,而疫苗效价不合格可能是由于没有确保冷链的完整或是储存时间超过有效期。疫苗安全性是指在储存运输过程中,可能会由于交通事故或是装卸操作不当而导致疫苗产生异常毒性。因此本文将冷链“断链”、储存超过有效期、出库操作不规范、发生交通事故、验收不规范,以及批签发合格证书的持有作为流通环节的风险因素。
(五)上市环节
许多人认为疫苗到接种完成后就已经结束了,但却不知道能唯一发现罕见的严重预防接种不良反应的途径是疫苗上市后不良反应监测。我国上市后不良反应监测正处在起步阶段,这一环节的基本概念、评价标准、技术操作,以及信息反馈的及时性影响着疫苗安全。除了不良反应监测产生风险,公众疫苗安全意识、知识强弱也影响着疫苗安全。
三、BN理论
在现代智能技术中,贝叶斯网络通过构建有向无环图,以表达因素之间的因果关系,于是有学者将贝叶斯网络应用于评估乳制品冷链运输风险、建筑火灾风险和飞行不安全风险等[16-18]。根据因素之间是否存在时间上的风险转移关系,分为静态贝叶斯网络(BN)和动态贝叶斯网络(Dynamic Bayesian Network, DBN)。由于难以准确获得各个时刻的指标数据,因此本文选用BN来评估疫苗全产业链的风险。
BN是依据贝叶斯统计的思想,从历史数据资料中分析出其中所蕴含规律信息的一种数学模型。BN依据总体信息、样本信息和先验信息来进行统计推断,在这点上与传统的经典统计学派有所不同。BN适用于对复杂网络的风险评估,它能处理具有因果关系的复杂结构数据,在预测变量之间相互独立,以及有限时间内概率不随时间的变化而变化的假设条件下,将疫苗质量安全风险预测与识别体系用贝叶斯网络表示为:B=(G,P),其中G=(V,E),表示有n个节点V={X1,X2,…,Xn}的有向无环图,其中n表示疫苗全产业链质量安全风险因子所对应的节点数量,V表示风险因子(节点)的集合,E为风险因子之间的直接依赖关系。
对于∀Xi,如果∃φ(Xi),使得给定的φ(Xi),均有Xi与{X1,X2,…,Xi-1}条件独立,且φ(Xi)最多包含k(k≤n)个变量,则有(1):
P{Xi|X1,X2,…,Xi-1}=P[Xi|φ(Xi)]
(1)
这样就不难得到联合分布的分解式(2):
(2)
当所有变量均取对立二分值时,按排列组合原理,(2)式右端所含的独立参数最多为n2m个,这样,相对原来联合分布的2n-1个独立参数而言,其BN所含参数更少,模型更简洁。
四、案例分析
(一)数据来源及描述
本文在中国食品药品检定研究院等网站中收集2014—2018年国内一、二类疫苗每年批签发量、销售额,以及每年国内疫苗涉事案件等数据,并在python中调用pyecharts库对这些指标进行描述性分析。
根据是否需要自费,疫苗可分为一类、二类疫苗。一类疫苗无需公民自费,它是由政府提供的,而二类疫苗是根据公民自身意愿需求,是自费接种的疫苗。其中,一类疫苗的生产流通由国家制订计划统一公开招标采购,通过省疾控中心的冷链运输系统配送至全省各个接种单位,在各个环节中由政府层层把关;而二类疫苗的生产流通监管没有一类疫苗的监管严格[19]。一般情况下,二类疫苗先从企业销售到省疾控部门,再到市疾控部门、县疾控部门,层层筛选,最后到达接种点。在新的《疫苗管理法》发布前,一些接种点为了避免层层销售的加价情况,选择跳过疾控部门直接从厂家或经销商购买。
为了避免层层加价的情况而产生的多种流通方式,不法分子应运而生。因此二类疫苗的市场占比越大,其生产监管存在的风险也就越大。本文对一、二类疫苗每年的批签发量和销售额进行数据可视化,如图2、图3(图中虚线表示序列的平均值)。

图3 2014—2018年疫苗销售额
由图2、图3可以得知,对于二类疫苗,2018年的批签发量达到五年来的最低值,而销售额却达到了五年来的最高值。一类疫苗的批签发量和销售额则逐年降低。这说明二类疫苗在疫苗市场中所占的比重越来越大,质量安全风险也就随之增大。
因此针对二类疫苗的全产业链进行质量安全风险评估,以找出风险监测重点。在OpenLaw网站收集2014—2018年的涉人用二类疫苗案件,总共有689件,案由描述见图4。
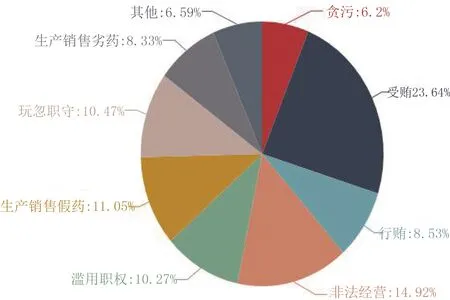
图4 2014—2018年涉人用二类疫苗案由图
(二)构建贝叶斯网络模型
基于表1确定BN网络的输入节点,其中,20个二级风险指标在贝叶斯网络的最外层,分别作为A、B、C、D、E的父节点。节点X表示疫苗全产业链质量安全风险,这里的疫苗质量风险指代有效性、安全性受到影响。所有节点都对应两个相互对应的随机状态Y和N:Y表示所描述的事件发生的概率,N表示未发生的概率。最后根据各节点间的关系,构建如图5所示的BN网络拓扑结构模型。
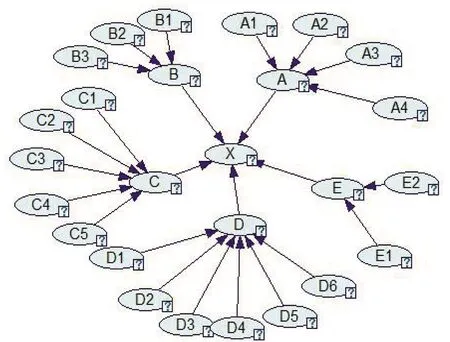
图5 BN网络模型
(三)模型学习结果
将689件案例信息手动转化为对应的数据信息,并将这些数据输入模型,利用GeNIe 2.0软件进行贝叶斯网络的学习,学习的对数似然值为-325.7263,即模型解释度高,拟合较好,得到结果如图6所示。由结果可见,疫苗生产环节风险(C)最高,其次是流通环节风险(D)和审批环节风险(B)。在生产环节中,生产的疫苗质量不达标(C2)的发生概率最高;在流通环节中,冷链“断链”(D2)的发生概率最高;在审批环节中,审批人员的专业素养不高的发生概率最高。

图6 贝叶斯网络结构图
(四)模型敏感性分析
将GeNIe2.0作为敏感度分析的主要工具,得到结果如图7所示。图中节点颜色越深,代表此节点的敏感程度越高,对疫苗质量安全风险的影响程度也就越大。由图可知,以节点X为目标,发现各个环节的敏感程度都较高且相当。从二层结构上看,对于审批环节B而言,节点B1(无药品GMP)的敏感程度远高于其他节点。对于生产环节C而言,节点C3(生产设备故障)的敏感程度要高于其他节点。对流通环节D而言,节点D3(储存超出有效期)和D5(交通事故)的敏感程度最高。
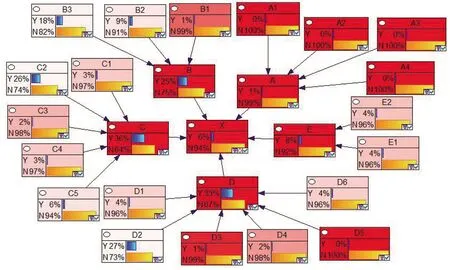
图7 敏感度分析结果图
(五)失效模式影响分析
失效模式影响分析(Failure Mode and Effects Analysis,FMEA)是较常用的质量风险管理工具。FMEA是根据风险因子发生概率(P)和发生后的影响程度(L)予以分级的,用数据公式表示为:R=P×L,然后根据R值,风险可以分为低风险(R≤4)、中等风险(R>4,R≤9)、高风险(R>9,R≤12)、极高风险(R>12)。为了进一步对指标进行分析,本文利用FMEA对各个风险因子进行分级,以明确监管重点。
根据BN模型结果,将风险因子发生概率分为5类:[0,1%]、(1%,2%]、(2%,3%]、(3%,4%]、4%以上,依次赋予评分1~5,代表发生可能性依次增大。依据敏感度值,将风险因子的影响程度分为5类:0以下、(0,5]、(5,10]、(10,15]、15以上,依次赋予评分1~5,表示发生影响程度依次增大。随后计算各个风险因子的R值,进行FMEA分析:高风险的有审批模式不合理(B2)、审批人员的专业素养不高(B3)、生产设备故障(C3)、生产工艺不符合规范(C5)、无批签发合格证(D1)、验收不规范(D6)、上市后不良反应监测不足(E1)、公众疫苗安全知识弱(E2),其余都为中等风险。
五、研究结论
本文主要从疫苗的研发、审批、生产、流通、上市使用这五个环节出发,构建疫苗全产业链质量安全风险评估指标体系,随后建立基于贝叶斯网络的疫苗质量安全风险预警模型,找出疫苗质量安全风险监测的痛点,为相关部门提供决策参考。主要结论有以下三个方面:(1)在这五个环节中,风险最大的依次是生产、流通、审批,在各个环节节点的子节点中,发生概率最高的分别是生产的疫苗质量不达标、冷链“断链”、审批人员专业素养不高。(2)进行敏感度分析发现,对于审批、生产、流通环节,敏感度最高的分别是无药品GMP、生产设备故障、储存超过有效期、交通事故,说明这些风险因素对于疫苗质量安全影响最大,一旦发生,极有可能造成不可挽回的损失。(3)通过FMEA分析,风险监测重点为审批模式是否合理、审批人员是否专业、生产工艺是否规范、生产设备是否及时维护、是否持有批签发合格证、疫苗验收是否规范、上市后不良反应的监测是否到位以及公众对疫苗安全知识认识是否全面等。
通过以上研究,对政府及相关部门提出如下对策建议:(1)对不法疫苗商贩建立严格的惩罚体系,对有损疫苗质量的行为做出严肃的处理。(2)生产企业要加强内部监管,普及法律知识,积极开展自查自纠活动。生产人员必须严格按照疫苗生产规程制造疫苗,以确保疫苗的质量。(3)对流通环节中的储存和运输环节进行严格监督,建立有效的电子监管和温度控制措施,并加强对冷链设备的维护和人员的培养,保障疫苗上市前的最后一步。(4)向公众普及疫苗安全知识等。
