多模态MRI 技术在乳腺非肿块性强化病变良恶性鉴别中的临床研究
2020-08-22伍建林
刘 靓,朱 丹,沈 晶,伍建林
(大连大学附属中山医院放射科,辽宁 大连 116011)
乳腺非肿块性强化 (Non-mass-like enhancement,NMLE) 病变是美国放射学会 2003 年乳腺影像报告和数据MRI 系统 (Breast imaging and reporting data system magnetic resonance imaging,BI-RADS-MRI)提出的概念[1],系指乳腺内无肿块区域的强化特征,其范围可较小或较广泛,病灶内可夹杂乳腺腺体、脂肪或间质成分,导致强化影互不连续的一类乳腺病变[2]。 该特殊表现形式的乳腺疾病既可为良性,亦可为恶性[3],有时其鉴别诊断十分困难。本研究利用多模态MRI 技术基于形态学表现与功能学特点对90 例NMLE 病变进行回顾性研究,旨在提高应用3.0T MRI 鉴别乳腺NMLE 病变良恶性的临床诊断水平。
1 材料与方法
1.1 一般资料
根据BI-RADS-MRI 诊断标准, 回顾性分析大连大学附属中山医院于2013 年10 月—2015 年 3月期间行乳腺MRI 检查并表现为NMLE 病变,最终均经手术和病理学证实的乳腺疾病患者90 例,其中良性病变31 例(良性组),恶性病变59 例(恶性组)。全部为女性患者,平均年龄(46.3±9.1)岁。
1.2 MRI 检查与图像分析
本研究应用Siemens 3.0T Magnetom Verio 超导MRI 仪,16 通道乳腺专用相控阵表面线圈。 所有患者均采用头先进俯卧位,自然悬垂双乳于线圈内。扫描序列:①横轴位快速反转恢复抑脂T2WI 序列,TR/TE=4 000/70 ms,层厚 5.0 mm,间距 0.5 mm,视野(FOV)=340 mm×340 mm,矩阵 448×448,激励次数(NEX)=1。②横轴位 FLASH-3D T1WI 序列,TR/TE=6/2.3 ms,层厚 1.2 mm,间距 0.2 mm,FOV=340 mm×340 mm,矩阵 448×380,反转角 10°,NEX=1。 ③横轴位 EPI-DWI,TR/TE=8 300/85 ms,层厚 4 mm,层间距 2 mm,FOV=360 mm×147 mm, 矩阵 220×220,NEX=3,b=50、800 s/mm2。 ④DCE-MRI,TR/TE=4.5/1.6 ms,反转角 10°,层厚 1 mm,间距 0.2 mm,矩阵448×344,FOV=340 mm×340 mm,NEX=1。 使用高压注射器以3.0 mL/s 流速静脉团注Gd-DTPA 对比剂20 mL,共采集5 期增强图像,单期扫描时间77 s,全部时间为487 s。
根据 BI-RADS-MRI 标准, 由 2 名 5 年以上乳腺疾病放射诊断医师在不知道其良恶性结果情况下双盲法在后处理工作站对其MRI 征象分析, 包括:形态学表现、DCE-MRI 强化特征及时间-信号曲线(Time-intensity curve,TIC)等;并采用 b=800 s/mm2在工作站生成的 ADC 图, 设置 3~5 个 ROI 测量病变强化区域ADC 值,取其平均值为终值。
1.3 统计学分析
采用SPSS 19.0 统计软件分析。 符合正态分布的计量资料采用表示,计数资料以百分数表示。采用独立样本t检验比较两组间均数。 以病理结果为“金标准”,选取 b=800 s/mm2,以 ADC 值=0.1×10-3mm2/s 为节点,计算各节点NMLE 良恶性的敏感度与特异度,根据两者相交点,确定ADC 值的最佳阈值。 以P<0.05 为差异有统计学意义。
2 结果
2.1 NMLE 在MRI 上分布类型比较
本组90 例患者中,良性组31 例(腺病14 例、导管内乳头状瘤12 例、化脓性炎4 例、囊性增生病1例),占34.4%;恶性组59 例(浸润性导管癌22 例、导管原位癌19 例、乳腺小叶癌10 例、导管内乳头状癌8 例),占65.6%。 两组病例在增强MRI 上分布类型为:导管型、节段型、区域型和弥漫型,其中节段型分布在两组间差异有统计学意义(P<0.05),其余分布类型在两组间差异无统计学意义(P>0.05)。 见表1 和图 1。
2.2 NMLE 良恶性病变在DCE-MRI 强化特点比较
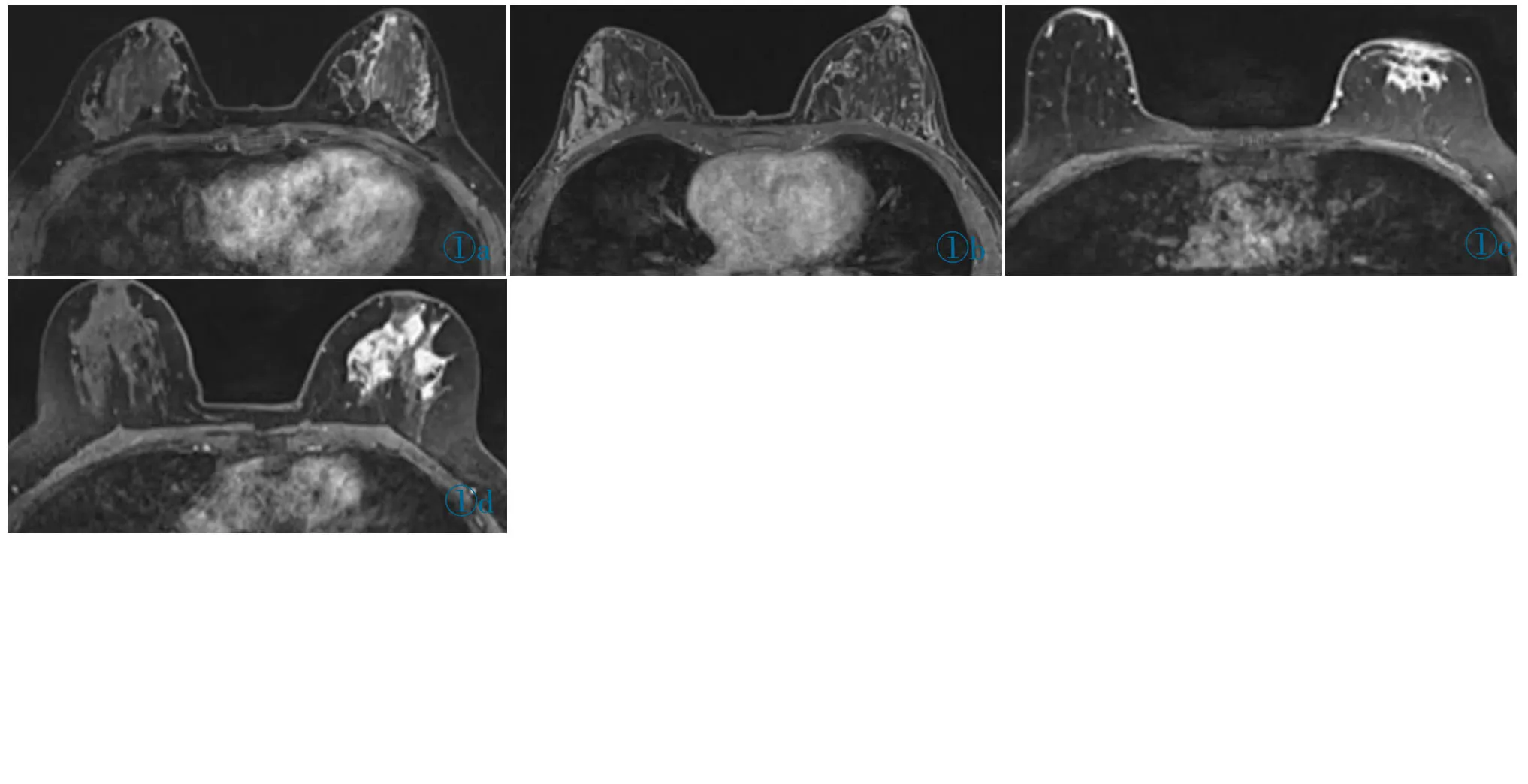
图1a~1d NMLE 在增强MRI 上的4 种表现类型。 图1a:导管型,左侧乳腺内上象限局部病变的强化呈导管型,术后病理诊断“导管内乳头状瘤”。 图1b:节段型,右侧乳腺外上象限病变的局部强化呈节段型,术后病理诊断“导管原位癌”。 图1c:区域型,左侧乳腺乳头后方病变的局部强化呈区域型,术后病理诊断“浸润性导管癌”。 图1d:弥漫型,左侧乳腺弥漫分布病变的强化呈弥漫型,术后病理诊断“浸润性导管癌”。Figure 1a~1d. Four manifestations of NMLE on enhanced MRI. Figure 1a: Ductal type,enhancement of the local lesions in the inner upper quadrant of the left breast was ductal type, and postoperative pathological diagnosis was“intraductal papilloma”. Figure 1b: Segmental type, the local enhancement of the lesions in the external upper quadrant of the right breast presented segmental type, and the postoperative pathological diagnosis was “ductal carcinoma in situ”. Figure 1c: Regional type, the local enhancement of the lesions behind the left mammary gland papilla was regional type. And the postoperative pathological diagnosis was “invasive ductal carcinoma”. Figure 1d: Diffuse type, the enhancement of the diffuse distribution lesion in the left breast was diffuse type, and the postoperative pathological diagnosis was “invasive ductal carcinoma”.
在NMLE 良恶性两组病变中的增强MRI 内部强化特点包括:均匀、不均匀、集丛样强化、簇样环形强化, 其中集丛样强化在两组间差异具有统计学意义(P<0.05),即恶性组病变中集丛样强化明显高于良性组; 其余强化形式在两组间差异无统计学意义(P>0.05),见表 2 和图 2。
2.3 NMLE 良恶性病变的TIC 比较
在NMLE 良恶性两组病变中, 恶性组TIC 类型:17 例Ⅰ型(28.8%),38 例Ⅱ型(64.4%),4 例Ⅲ型(6.8%);良性组 TIC 类型:15 例Ⅰ型(48.4%),14 例Ⅱ型(45.2%),2 例Ⅲ型(6.5%)。 其曲线类型在两组间差异不具有统计学意义(P>0.05)。 见表3。
2.4 NMLE 良恶性病变ADC 值比较与最佳阈值
在本研究59 例恶性病变中,有46 例(51.1%)ADC 值≤1.3×10-3mm2/s, 其余 13 例 (14.4%)ADC值>1.3×10-3mm2/s; 在 31 例良性病变中, 有 20 例(22.3%)ADC 值>1.3×10-3mm2/s,其余 11 例(12.2%)ADC 值≤1.3×10-3mm2/s, 两组间 ADC 值差异有明显统计学意义(P<0.001)。 两组的平均 ADC 值分别为 (1.11±0.32)×10-3mm2/s、(1.47±0.37)×10-3mm2/s,差异亦有统计学意义(P<0.05)。
NMLE 两组病变的 ADC 值介于(0.050~2.275)×10-3mm2/s 之间, 以 0.100×10-3mm2/s 为节点计算各组ADC 值分布例数及百分比,并计算其敏感度与特异度和绘制折线图(图3)。 取最大敏感度与特异度的相交点(1.3×10-3mm2/s)为最佳有效 ADC 阈值,当ADC 值≤1.3×10-3mm2/s 诊断 NMLE 为恶性病变时,敏感度与特异度为71.8%、78.8%。
3 讨论

图2a~2d NMLE 良恶性病变在MRI 上强化表现特点。 图2a:均匀强化,左侧乳腺内病灶呈片状较均匀性强化,术后病理诊断“浸润性导管癌”。 图2b:不均匀强化,右侧乳腺内象限呈节段样非均匀性强化,术后病理诊断“乳腺小叶癌”。 图2c:集丛样强化,右侧乳腺内上象限见簇状与环形强化,术后病理诊断“浸润性导管癌”。 图2d:簇样环形强化,左侧乳腺内下象限见节段样分布网格状强化,术后病理诊断“化脓性炎症”。Figure 2a~2d. MRI enhancement features of benign and malignant lesions of NMLE.Figure 2a: Homogeneous enhancement. The lesion in the left breast presented flaky more homogeneous enhancement. Postoperative pathological diagnosis was “invasive ductal carcinoma”. Figure 2b: Heterogeneous enhancement, segmental non-uniform enhancement in the right inner quadrant of the breast, postoperative pathological diagnosis of “lobular carcinoma of breast”. Figure 2c: Clumped enhancement, which can be seen in the upper quadrant of the right breast, postoperative pathological diagnosis of“invasive ductal carcinoma”. Figure 2d: Clustered ring enhancement, segmental distribution grid enhancement in the lower quadrant of the left breast, postoperative pathological diagnosis of “suppurative inflammation”.
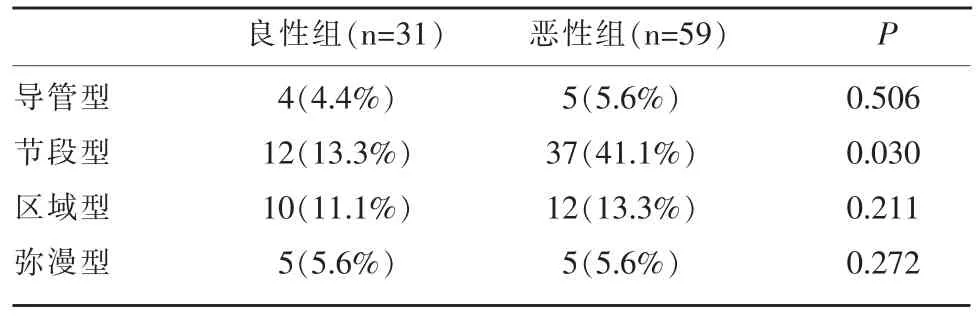
表1 NMLE 良性组与恶性组的MRI 分布类型比较
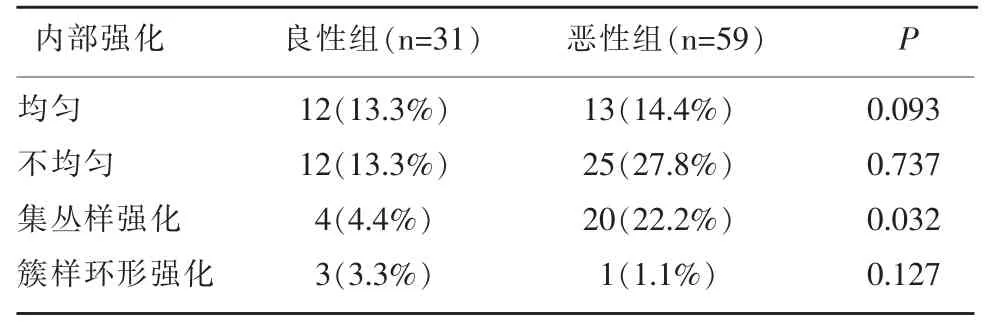
表2 NMLE 良性组与恶性组在增强MRI 上强化特点比较

表3 乳腺NMLE 病变TIC 类型

图3 两组NMLE 病变各节点ADC 值计算其敏感度与特异度折线图。Figure 3. Calculation of sensitivity and specificity of ADC values at each node of the two groups of NMLE lesions.
乳腺MRI 检查具有优越的软组织分辨率[4],且一次检查同时可完成双乳显像, 在乳腺疾病检出和定性诊断中发挥越来越重要的作用。随着MRI 技术的不断应用[5],逐渐发现NMLE 良恶性的鉴别诊断较为困难。 本研究采用多模态MRI 技术如常规序列、DCE-MRI 与DWI 扫描基于形态学与功能学两方面信息进行联合诊断,获得了较好的临床诊断效果。
3.1 NMLE 病变分布类型及鉴别诊断价值
由于NMLE 在增强MRI 上无明显的肿块区域,常混杂乳腺腺体、脂肪组织或间质成分,故导致其强化阴影的模式与分布类型较为复杂。 本研究中主要概括以下4 型:即导管型、节段型、区域型和弥漫型;本组良恶性病变中尤以节段型分布为多见 (共占54.4%),其病理类型多为浸润性导管癌及导管内原位癌; 如以节段型分布提示为乳腺恶性病变的阳性预测值(PPV)为75.5%,与多数研究报道的67%~100%基本相符[6-7]。NMLE 表现的导管内原位癌出现节段型强化具有一定特征性[8-10],其可能病理基础为肿瘤先局限于某一导管束分支, 继而浸润不同的范围或持续进展累及整个导管束等[11]。 但少数良性病变如乳腺导管扩张症亦可出现相类似表现, 应仔细辨认征象和正确解读病理基础以提高鉴别诊断准确率。有学者[12]研究认为,导管型分布是预测NMLE 为恶性病变的高危因素,但本组该分布类型较少,结果尚缺乏说服力。 区域型及弥漫型分布主要见于乳腺腺病,但Ballesio 等[13]研究显示区域型强化在浸润性导管癌中表现较多; 本研究后两种类型在良恶性组分布基本均衡, 其鉴别诊断价值有待扩大样本深入研究。
3.2 NMLE 在增强 MRI 上强化特点 (包括 TIC)及鉴别诊断价值
DCE-MRI 图像不仅可更加清晰显示乳腺病变形态学表现, 还可反映病变内部血供信息与病理改变特征, 有助于提高NMLE 的良恶性鉴别诊断效能。 本组病变显示的强化特点主要包括以下4 种类型:即均匀、不均匀、集丛样强化及簇样环形强化,还发现集丛样强化主要见于恶性病变 (占22.2%),这与国内学者等[14-15]研究结果一致,以导管原位癌或浸润性导管癌多见。通常,集丛样强化多提示病变位于导管内伴或不伴微小浸润, 与肿瘤是否累及乳腺导管壁及周围间质有关; 本组集丛样强化主要见于导管内原位癌(40.3%)、浸润性导管癌(50%)等,但少数良性病变亦可表现此种强化(本组占4.4%),工作中应加以鉴别。 当部分正常乳腺腺体或脂肪组织位于强化区内时则可形成簇样环形强化,谭红娜等[15]研究发现该类型强化多出现在乳腺良性病灶中;本研究也主要见于良性病变,如乳腺炎性病变等。然而磁共振对比剂能够透过细胞外间隙以及血管随机分布在体内,并不针对肿瘤本身具有生物学特异性,故血流动力学中TIC 可作为参考, 但不应将其做为相对重要的鉴别诊断参考。 本研究恶性组中DCIS 强化曲线多为Ⅰ、Ⅱ型,当供血血管数量较少时,多数病灶强化中后期对比剂并不会快速退出。本组10 例乳腺小叶癌中80%为Ⅱ型曲线,这可能与乳腺小叶癌含有纤维成分多,肿瘤细胞少,可只通过周边弥散的毛细血管网获取充足营养相关。 因此TIC 可初步评估病灶血流流入和流出因素, 却不能有效的定性乳腺NMLE 病变。
3.3 NMLE 良恶性病变ADC 值比较及鉴别诊断价值
基于DWI 的ADC 值测量对判断乳腺病变的良恶性具有重要价值[16]。 在本研究中,77.9%(46/59)的恶性组病例ADC 值减低,64.5%(20/31)的良性组病例 ADC 值增高[17];如以 0.100×10-3mm2/s 为节点计算和绘制两组ADC 值分布折线图,则敏感度与特异度相交点为 1.3×10-3mm2/s (最佳阈值), 以 ADC值≤1.3×10-3mm2/s 诊断NMLE 为恶性病变的敏感度与特异度分别为71.8%、78.8%。 但本组病例平均ADC 值高于相关报道[18],可能与NMLE 病变结构疏松引起ADC 值测量出现偏倚,且部分病例为导管内原位癌,其内水分子运动未明显受限等因素有关[19]。此外, 本研究也发现NMLE 良恶性病变ADC 值存在一定重叠而导致特异度偏低(78.8%),且导管内乳头状瘤及炎性病变ADC 值也低于其他良性病变[20],可能与其肿瘤细胞及炎性细胞弥散受限有关。
由于体内扩散运动复杂多样, 不仅有单纯水分子扩散,还有毛细血管血液微循环灌注所致的“假扩散”,故有学者提出基于毛细血管微循环灌注的体素内不相干运动(Intravoxel incoherent motionimaging,IVIM)模型[21-22]。 目前,IVIM 技术已逐步应用于乳腺病变的诊断与鉴别诊断并显示出一定效果[23];邹雪雪等[24]还将DCE-MRI 与IVIM-DWI 技术联合应用提高了乳腺良恶性病变鉴别诊断效能。 但本文由于条件与时间所限未能开展该方面的系统或对照性研究,有待于今后进一步深入研究。
总之, 乳腺NMLE 是较为特殊的一组病变,其良恶性鉴别诊断具有一定挑战性。本研究显示,基于多模态的MRI 技术联合形态学表现与功能性学信息, 有助于提高乳腺NMLE 良恶性病变的诊断效能,并对临床治疗方案制定提供可靠的生物学依据。
