铁锰氧化物复合吸附剂的制备及其对多种离子的吸附性能试验研究
2020-08-21李胜英冯建海蒋鹏杰李俊宇张晖英
李胜英,冯建海,蒋鹏杰,李俊宇,张晖英
(河池学院 化学与生物工程学院,广西 宜州 546300)
废水中的重金属污染具有致毒性、隐蔽性、长期性、不可降解性等特点[1],已引起广泛关注。目前,在国内外处理废水重金属污染的方法中,吸附法因原料来源广、价格低廉、效率高,已成为研究热点之一[2-4]。
铁、锰氧化物复合吸附剂在吸附治理污水方面性能优异[5-8]。Mn3O4和Fe3O4都属于由M2+和M3+组成的尖晶石型结构氧化物[9],用于污染处理方面的研究有很多[10-14]:添加Mn3O4的复合材料对Pb2+和Cu2+的吸附量比单碳成分材料提高2.2倍和6.1倍[14];用酸改性的Fe3O4除氟效果更佳,适用的pH范围更宽[15]。Mn3O4、Fe3O4或二者的复合材料可以人工制备[16-19],但有关复合材料用于吸附废水中的重金属离子的研究鲜见报道。
根据氧化还原原理,试验采用一步真空法制备铁锰氧化物复合吸附剂,并将其用于吸附废水中的单一金属离子和混合离子(mixCu2+、mixZn2+、mixCd2+),探讨了不同温度及离子浓度条件下该吸附剂对金属离子的吸附效果,以期为治理含重金属离子的废水找到一种适合的吸附剂。
1 试验部分
1.1 仪器与试剂
FA1004B型电子天平(上海越平科学仪器有限公司),DHG-9245A电热鼓风干燥箱(上海凯朗仪器设备厂),DF-101S集热式恒温加热磁力搅拌器(河南省予华仪器有限公司),NICOLET6700傅立叶红外变换光谱仪(美国赛默飞世尔),200FEG场发射环境扫描电镜(荷兰飞利浦公司),X射线衍射仪(深圳市莱雷科技发展有限公司),GGX-800原子吸收光谱仪(北京海光仪器有限公司),双层恒温培养震荡器(上海智城分析仪器制造有限公司)。
FeSO4·7H2O(广东汕头市西陇化工厂),KMnO4(西陇化工股份有限公司),3CdSO4·8H2O(天津市光复精细化工研究所),CuSO4·5H2O(天津市光复科技发展有限公司),Zn(NO3)·6H2O(西陇化工股份有限公司),KBH4(国药集团化学试剂有限公司),Cu、Zn、Cd标准溶液(国家有色金属及电子材料分析测试中心,1 000 μg/mL),均为分析纯。
1.2 铁锰复合吸附剂的制备
取20 mL一定质量浓度的FeSO4·7H2O溶液于特制圆底烧瓶中,用抽滤泵持续抽滤模拟真空环境,在一定温度下水浴加热,缓慢加入10 mL一定质量浓度硼氢化钾溶液,水浴反应0.5 h后缓慢加入30 mL一定质量浓度高锰酸钾溶液,继续反应适宜时间,得到灰黑色产物;将产物过滤,水洗至溶液pH不再变化,80 ℃下干燥24 h,得到铁锰氧化物复合吸附剂。
1.3 铁锰氧化物复合吸附剂样品的表征
铁锰氧化物复合吸附剂表面官能团、微观形貌和晶体结构分别采用NICOLET6700傅立叶红外光谱仪(美国赛默飞世尔科技有限公司)、200FEG场发射环境扫描电镜(荷兰飞利浦公司)、X射线衍射仪(深圳市莱雷科技发展有限公司)进行分析。
1.4 铁锰氧化物吸附剂对金属离子的吸附
分别配制100 mL质量浓度为100 mg/L的Cu2+、Zn2+、Cd2+溶液及质量浓度各为100 mg/L的Cu2+、Zn2+、Cd2+混合溶液,并向各溶液中加入0.100 0 g铁锰氧化物复合吸附剂,置于摇床中,分别在25、35、45 ℃下以150 r/min速度恒温振荡。取振荡不同时间的吸附液,过滤,用原子吸收光谱法测定各金属离子质量浓度,按式(1)计算金属离子吸附量(qt)。
(1)
式中:qt—复合吸附剂对金属离子的吸附量,mg/g;ρ0—金属离子初始质量浓度,mg/L;ρt—吸附t时间后金属离子质量浓度,mg/L;V—溶液体积,L;m—复合吸附剂质量,g。
在25 ℃下,控制3种离子溶液中离子质量浓度、混合溶液中金属离子质量浓度分别为80、120 mg/L, 重复上述步骤,测定吸附剂对金属离子的吸附量。
2 试验结果与讨论
2.1 复合吸附剂的表征
2.1.1 SEM表征
图1为铁锰氧化物复合吸附剂在不同倍率下的SEM照片。可以看出:复合吸附剂的形貌为片状或类球状,进而相互叠加形成“串状结构”,颗粒大小相对较均一。

a—20 000倍;b—50 000倍。
2.1.2 FT-IR表征
综上所述,压力超负荷和容量超负荷分别作用于心动周期的不同时段,引起向心性和离心性心脏肥大。但是,由于均为机械应力超负荷诱发,压力超负荷和容量超负荷心脏肥大在病因和病理改变上,并非泾渭分明的两类心脏重构,而是呈现相互交叉的特点,且在病变的不同阶段呈现动态变化。本文揭示了一些肥大相关信号在两类超负荷心脏重构中的差异,并初步提出了CaN和Akt信号通路可能分别是针对两类超负荷精准化治疗的靶点。其上下游调控因子在两类超负荷心脏重构中的调控差异,尚需进行深入研究。
图2为铁锰氧化物复合吸附剂的FT-IR分析结果。可以看出:在3 550 cm-1处的吸收峰对应—OH伸缩振动峰;840 cm-1处的吸收峰为掺杂水分的杂峰;1 480 cm-1处的2个弱峰对应M—O键的弯曲振动峰;1 645 cm-1和538 cm-1处的峰对应Fe—O弯曲振动吸收峰;668 cm-1处的峰对应Mn—O特征吸收峰[20]。
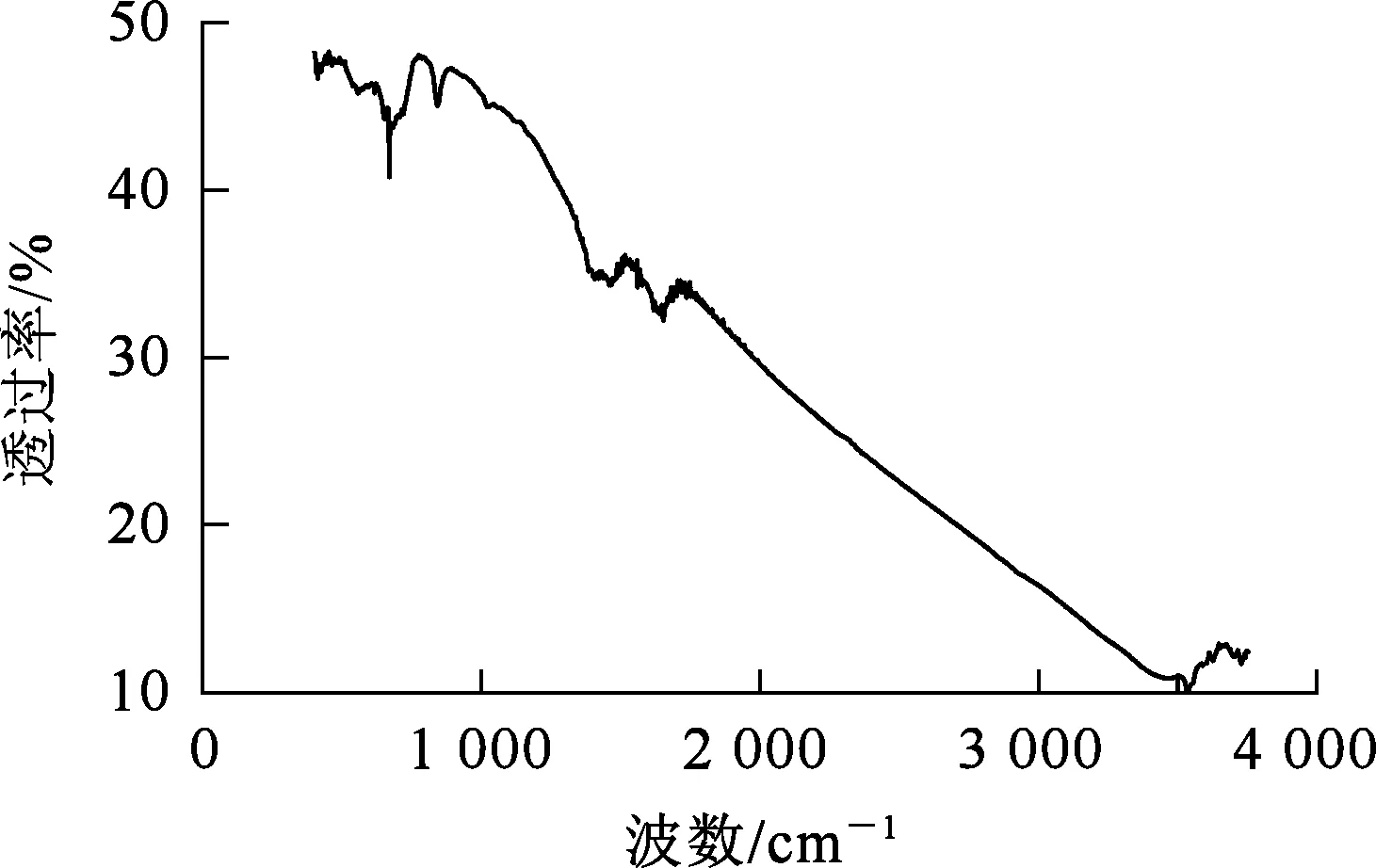
图2 铁锰氧化物复合吸附剂的FT-IR分析结果
2.1.3 XRD表征
图3为铁锰氧化物复合吸附剂的XRD分析结果。标准物质Mn3O4的特征峰(JCPSD 13-0162)在2θ分别为18.24°、29.96°、35.3°、43.0°、53.3°、56.78°、62.3°处出现衍射峰,分别对应(111)、(220)、(331)、(400)、(422)、(511)和(440)晶面;标准物质Fe3O4(JCPSD 65-3107)的特征峰在2θ分别为18.3°、30.1°、35.5°、37.08°、43.1°、53.5°、57.0°、62.6°分别对应(111)、(220)、(311)、(222)、(400)、(422)、(511)和(440)晶面。
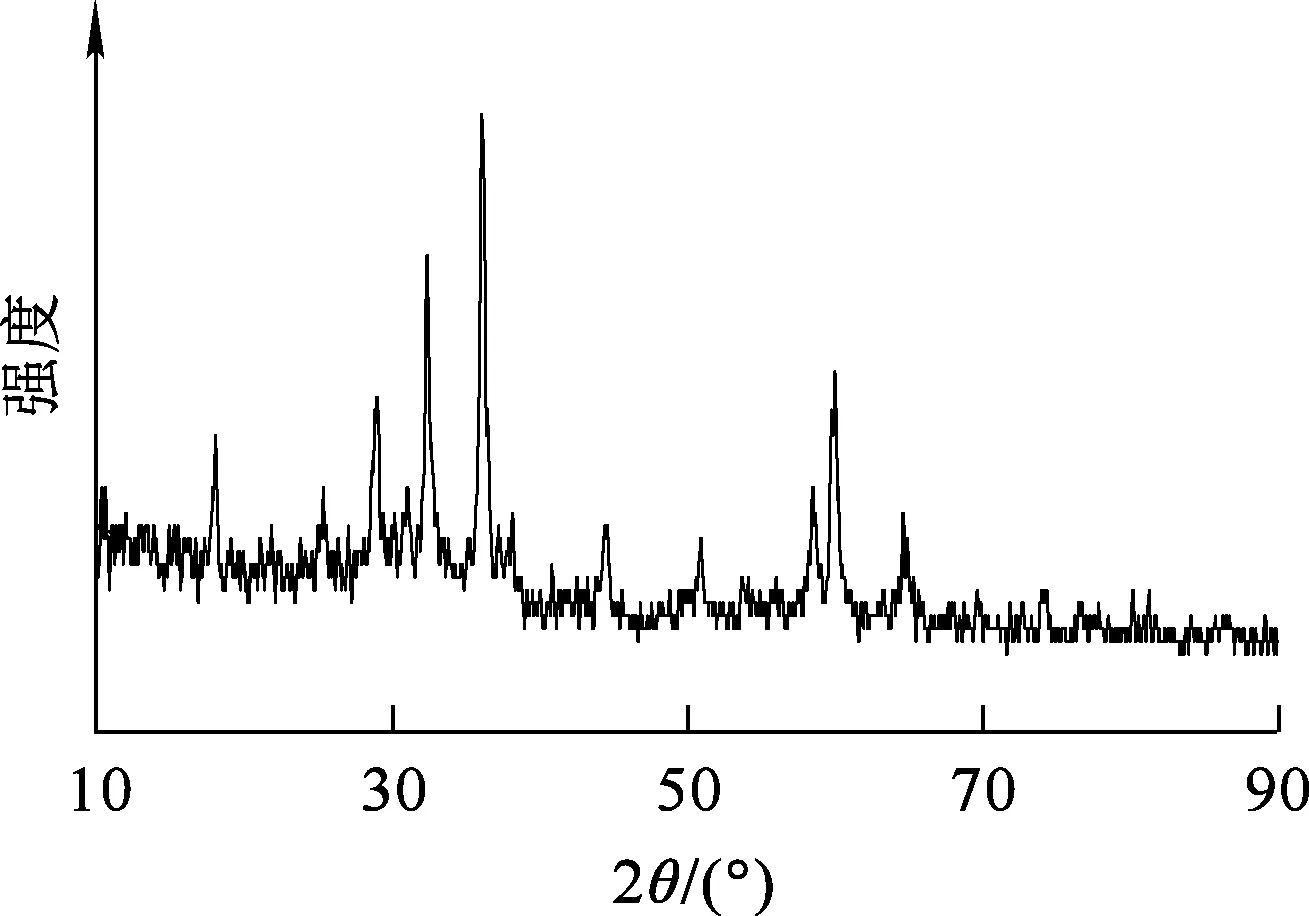
图3 铁锰氧化物复合吸附剂的XRD分析结果
所制备的铁锰氧化物复合吸附剂的XRD图谱与Mn3O4、Fe3O4的标准卡片图谱对比可知,二者衍射峰出现位置(2θ为35.3°)基本吻合,推断所制备材料基本成分为Mn3O4和Fe3O4,但峰出现位置略有偏移,可能是所制备材料晶相成分互相干扰且有其他锰、铁氧化物杂质所致。
2.2 复合吸附剂对金属离子的吸附
2.2.1 温度对金属离子吸附量的影响
溶液中金属离子质量浓度均为100 mg/L,温度对复合吸附剂吸附不同溶液中金属离子的影响试验结果如图4所示。

—◀—Cu2+;—■—Cd2+;—●—mixCu2+;—▲—Zn2+;—▶—mixCd2+;—▼—mixZn2+。图4 温度对复合吸附剂吸附不同溶液中金属离子的影响
由图4看出:吸附反应在吸附1 h后基本达到平衡;温度对吸附剂吸附单一和混合溶液中各金属离子的影响并无明显规律;不同温度下,吸附剂对金属离子的吸附量大致排序为qe(Cu2+)>qe(Cd2+)>qe(mixCu2+)>qe(Zn2+)>qe(mixCd2+)>qe(mixZn2+);吸附剂对单一溶液中Cd2+和Cu2+的吸附量较为相近,对Zn2+的吸附量较低;而对混合溶液中Cu2+的吸附量较高,远高于对Cd2+和Zn2+的吸附量,说明Cu2+的存在对吸附Cd2+、Zn2+有抑制作用。复合吸附剂对单一溶液中金属离子的吸附量均高于对混合溶液中金属离子的吸附量,对Cu2+的吸附效果较好。
2.2.2 金属离子初始质量浓度对吸附量的影响
在25 ℃下,用0.1000 g复合吸附剂从溶液中吸附金属离子,金属离子质量浓度对吸附量的影响试验结果如图5所示。可以看出:复合吸附剂对溶液中金属离子吸附量随离子质量浓度变化不明显;但相同质量浓度下,吸附剂对金属离子的吸附量大致排序为qe(Cu2+)>qe(Cd2+)>qe(mixCu2+)>qe(Zn2+)>qe(mixCd2+)>qe(mixZn2+);复合吸附剂对单一溶液中金属离子的吸附量较高且较为接近,对混合溶液中的Cu2+有选择性吸附,说明Cu2+的存在对Cd2+、Zn2+的吸附有较大抑制作用。

—◀—Cu2+;—■—Cd2+;—●—mixCu2+;—▲—Zn2+;—▶—mixCd2+;—▼—mixZn2+。图5 金属离子初始质量浓度对复合吸附剂吸附金属离子的影响
2.3 等温吸附方程
采用Langmuir方程(见式(2))和Freundlich方程(见式(3))拟合不同温度下铁锰氧化物复合吸附剂对3种金属离子的吸附等温线。
(2)
(3)
式中:qm—饱和吸附量,mg/g;qe—平衡吸附量,mg/g;ρe—吸附平衡时溶液金属离子的质量浓度,mg/L;b—Langmuir吸附常数,L/mg;kF—Freundlich吸附常数;n—Freundlich吸附强度系数。
等温吸附模型拟合结果见表1。可以看出:Langmuir等温模型的相关系数高于Freundlich等温模型的相关系数;根据Langmuir等温模型计算出的最大吸附量与试验所得的吸附量相一致。表明铁锰氧化物复合吸附剂对3种金属离子的吸附不仅存在单分子层吸附,还存在多分子层吸附,但以单分子层吸附为主[21]。

表1 等温吸附模型的拟合结果
2.4 吸附动力学
通过吸附动力学模型对数据进行拟合,可以判断复合吸附剂对金属离子的吸附速度,推理吸附机制。用以下2种动力学模型对温度35 ℃、金属离子质量浓度100 mg/L条件下的试验数据进行拟合,试验结果见表2。
准一级动力学方程为
ln(qe-qt)=lnqe-k1t;
(4)
准二级动力学方程为
(5)
式中:qt—吸附时间t时吸附量,mg/g;qe—吸附平衡时吸附量,mg/g;k1—准一级扩散系数;k2—准二级扩散系数;t—吸附时间,min。

表2 动力学方程拟合结果
由表2看出:吸附动力学模型相关系数均有一定相关性;准二级动力学方程拟合结果更佳,其线性相关系数接近1,且qe也与试验值接近。表明复合吸附剂对这3种金属离子的吸附过程较为符合准二级动力学模型,吸附过程中既有物理吸附又有化学吸附,但以化学吸附为主[22-23]。
3 结论
以FeSO4、KBH4和KMnO4为原料,在模拟真空水浴环境下,通过氧化还原法制备了铁锰氧化物复合吸附剂。SEM、FT-IR和XRD表征结果表明,复合吸附剂为串珠状结构,主要成分为Fe3O4和Mn3O4;对金属离子的吸附量排序为qe(Cu2+)>qe(Cd2+)>qe(mixCu2+)>qe(Zn2+)>qe(mixCd2+)>qe(mixZn2+),单一溶液中对Cu2+和Cd2+的吸附量较接近,且前者略大于后者,对Zn2+的吸附量较低;混合溶液中,对Cu2+的吸附较优;Cu2+的存在对Cd2+和Zn2+的吸附有抑制作用,且两者吸附量较一致。铁锰氧化物复合吸附剂吸附Cu2+、Zn2+、Cd2+的行为更符合Langmuir等温吸附模型,以单分子层吸附为主;其吸附过程更符合准二级动力学模型,吸附机制为化学吸附控制反应步骤。
