前列腺癌分子探针68Ga-DOTA-ANCP-PSMA的初步评价
2020-08-21邓雪松赵海龙罗田伟陈孟毅秦翔宇于菁菁崔海平
温 凯,胡 骥,邓雪松,赵海龙,罗田伟,陈孟毅,许 林,秦翔宇,于菁菁,崔海平,*
1.中国原子能科学研究院,北京 102413;2.原子高科股份有限公司,北京 102413
前列腺癌是最常见的恶性肿瘤之一,是男性癌症中发病率第二、死亡率第五的癌症[1-3]。近年来国内前列腺癌发病率也呈显著升高趋势,2015年,前列腺癌新增患者6.03万人,因前列腺癌死亡2.66万人[4]。前列腺特异性抗原(PSA)筛查可以为大部分患者提供早期诊断,但对于会出现高风险或转移灶的部分患者,导致无法给出准确的诊断[5-6]。早期准确的诊断和分期对于选择有效的治疗至关重要。传统的成像方式如计算机断层扫描(CT)和核磁共振(MRI)存在一定的缺陷[7],特别是在低前列腺特异抗原(PSA)水平下,漏诊和误诊率较高。使用正电子发射断层扫描(PET)对于诊断前列腺癌有非常好的前景,使用传统诊断试剂,如胆碱(11C/18F-Choline)或氟脱氧葡萄糖(18F-FDG)进行正电子发射断层扫描对于中晚期前列腺癌的诊断有很好的效果,但对于早期前列腺癌及其转移性病灶的诊断仍存在一定的局限性。
前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)是Ⅱ型跨膜糖蛋白,最早在人类前列腺癌细胞系LNCaP中发现[8]。PSMA在前列腺癌细胞中显著升高,可以作为诊断和治疗的理想靶点。谷氨酸-脲-赖氨酸(Glu-Urea-Lys)是靶向PSMA的小分子抑制剂,尤其是含谷氨酸-脲-赖氨酸序列的小分子抑制剂,能高效、特异性地与PSMA结合。Glu-Urea-Lys有生物学活性稳定、体内循环半衰期短、组织渗透性好的特点,在前列腺癌分子影像学诊断方面具有更好的应用价值[9-10]。使用正电子核素68Ga标记PSMA小分子抑制剂可以与前列腺癌细胞特异性结合,通过PET-CT显像对前列腺癌及其转移灶的诊断有重要意义,68Ga-PSMA已成为国际研究的热点[11-15]。
为了开发一种新型的具有较好体内、体外性质的68Ga标记的PSMA小分子化合物,并适当提升标记物的亲脂性、延长肿瘤摄取时间[16], 选择1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(DOTA)作为螯合剂。DOTA是68Ga标记物应用最广泛的螯合剂,具有易于标记、稳定性好的特点。在已有的研究[17]基础上,保持化合物核心结构不变,设计了以谷氨酸-脲-赖氨酸(Glu-Urea-Lys)为核心基团,以1-萘基丙氨酸、4-胺甲基环己甲酸、苯丙氨酸(Ala(Nap)-Cyh-Phe,以下简称ANCP)为侧链,以DOTA为螯合基团的新型PSMA小分子抑制剂DOTA-ANCP-PSMA,如图1所示。首先合成前体化合物,使用直接标记法进行68Ga标记;对标记物的体内外性质开展评价,分别测定体外稳定性、脂水分配系数,开展正常小鼠和荷LNCaP肿瘤裸鼠的生物分布的实验,最后通过PET-CT显像测定其显像效果。
1 实验方法
1.1 材料和仪器
68Ge-68Ga发生器(740 MBq),德国ITM公司;盐酸、醋酸、醋酸钠,加拿大Alfa Aesar公司;4-羟乙基哌嗪乙磺酸(HEPES),纯度98%,美国Sigma Aldrich公司;无水乙醇,分析纯,国药化学试剂有限公司;乙醇,分析纯,纯度95%,国药化学试剂有限公司;乙腈,色谱纯,德国Merck;超纯水,德国Millipore纯水仪制造;Sep-Pak C-18柱,美国Waters公司;异氟烷,纯度99.998%,深圳市瑞沃德生命科技有限公司。

图1 PSMA-ANCP-DOTA的分子结构Fig.1 Structure of PSMA-ANCP-DOTA
CRC-55TW活度计,美国Capintec公司;2470全自动伽马计数器,美国Perkin Elmer公司;VORTEX3螺旋振荡器,德国IKA公司;JHX-100恒温加热器,上海净信实业发展有限公司;雷磁PHS-3E pH计,上海仪电科学仪器股份有限公司;ML303电子天平,精度0.001 g,德国Mettler Toledo公司;LC-20AT高效液相色谱、BPD-20A HPLC紫外检测器、CTO-10AS HPLC柱温箱,日本岛津公司;Bioscan色谱仪伽马计数器,德国Eckert&Ziegler公司;Iertsil ODS-SP C18 RP-HPLC色谱柱,φ4.6 mm×250 mm,粒径5 μm,日本岛津公司;Avance 400M核磁共振仪,瑞士Bruker公司;3200Q TRAP质谱仪,美国ABSCIEX公司;Iris PET-CT,法国Inviscan公司;动物麻醉机,法国Minerve公司。
昆明小鼠,6~8周,23~25 g。裸鼠,SPF级、4~6周龄、体重(22±2) g,雄性。
肿瘤接种方法:将对数生长期的源前列腺癌细胞系用胰酶消化、离心、清洗3遍后,收集细胞,使用1640培养基重悬细胞,将细胞悬浊液浓度调整为每毫升5×106个细胞。接种肿瘤细胞于裸鼠右侧腋窝皮下,每只接种5×106个细胞。正常条件饲养,待肿瘤直径达1 cm以上时处死,在无菌条件下剥离肿瘤,用生理盐水清洗数次,剔除坏死的组织,选择生长良好的肿瘤组织,切割成3.4 mm大小的肿瘤块,以特制的组织接种器将肿瘤组织移植到右侧腋窝皮下。肿瘤生长至直径0.8~1.0 cm时用于实验。
1.2 前体化合物的合成
前体化合物的合成按照已有的合成工艺路线[17]开展,合成标记流程示于图2。以 Fmoc-Lys(Dde)-Wang Resin(化合物1)为起始原料,加入N,N-二甲基甲酰胺(DMF)浸泡,加入3倍体积的哌啶(Pip)质量分数为20%的DMF溶液,用以脱除Fmoc。抽干20%Pip/DMF,DMF洗涤5次。投入N,N′-琥珀酰亚胺基碳酸酯(DSC)、N,N-二异丙基乙胺(DIPEA)和4-二甲氨基吡啶(DMAP),反应1 h。将H-Glu(OtBu)-OtBu·HCl加入至反应器中,加入适量DMF,反应1 h。用切割液E液(纯TFA、茴香硫醚、水、苯酚、1,2-乙二硫醇)切割反应1 h,使用茚三酮检测是否完全连接。加入3倍体积的DMF溶液(w(水合肼)=2%),反应30 min,脱去1-(4,4-二甲基-2,6-二氧代环己亚基)乙基(Dde)保护基团,DMF洗涤5次,获得化合物2。

图2 68Ga-DOTA-ANCP-PSMA的合成路线Fig.2 Synthesis of 68Ga-DOTA-ANCP-PSMA
依次连接1-萘基丙氨酸、4-胺甲基环己甲酸、苯丙氨酸,加入氨基酸(n(氨基酸)∶n(化合物2)=3∶1)。加入侧链所需的氨基酸、化合物2、苯并三氮唑-N,N,N′,N′-四甲基异脲六氟磷酸盐(HBTU)、N-甲基吗啡啉(NMM)。将合成产物转移至切割管中,加入E液,振荡切割反应1 h,得到化合物3。加入螯合剂DOTA(n(DOTA)∶n(化合物3)=3∶1),加入适量DMF,反应1 h;将合成产物转移至切割管中,加入E液振荡切割反应1 h。将切割液收集至离心管中,加入6倍体积的冰乙醚,低速离心机沉淀。将沉淀的粗品用乙醚洗三遍,通过半制备色谱柱纯化得到化合物4,如图2所示。
1.3 68Ga的放射性标记
取冷冻的DOTA-ANCP-PSMA制剂,用超纯水配制成5 g/L溶液。取4 μL溶液置于EP反应管中,向DOTA-ANCP-PSMA中加入65 μL 1.0 mol/L醋酸钠溶液。取3.5 mL 0.05 mol/L HCl溶液,淋洗68Ge-68Ga发生器;取1.0 mL淋洗68Ga的 0.05 mol/L HCl溶液(约37~185 MBq),加入反应管,并置于95 ℃的恒温加热器中,200 r/min下反应15 min。将反应溶液用2 mL注射器取出并用活度计测量总活度,注入到活化的Sep-Pak C18柱(预处理后)中,以3.0 mL纯水冲洗杂质;在C18柱上安装0.22 μm微孔滤膜,以1.0 mL 95%乙醇溶液淋洗,收集到无菌真空瓶中。
1.4 体外稳定性研究
68Ga-DOTA-ANCP-PSMA的放射化学稳定性研究在磷酸缓冲液(PBS)和小牛血清(BSA)两种体系中开展。
PBS法:置于0.5 mL的磷酸缓冲液(pH=7.4)中,37 ℃下孵育30、60、90、120、150 min后,采用HPLC测定其放射化学纯度,以测定其体外稳定性。
血清法:置于0.5 mL的小牛血清溶液(pH=7.0)中,37 ℃下孵育30、60、90、120、150 min时,采用HPLC测定其放射化学纯度,以测定其体外稳定性。
1.5 脂水分配系数的测定
标记物通过Sep-Pak C18柱分离纯化得到,使用95%乙醇洗脱。将获得的标记物通过干燥的氮气吹干,使用相同体积的(0.5 mL∶0.5 mL)正辛醇和磷酸缓冲溶液(pH=7.4)将得到的标记物溶于1.5 mL EP管(约3.7 MBq)中。充分振荡5 min,在离心机中离心5 min,转速为2 000 r/min,静置分层。分别取有机相和水相各100 μL于EP管中,在井型γ探测器中分别测量其放射性计数,由有机相和水相的放射性计数率的比值来计算脂水分配系数P:
P=lg(No/Nw)
式中,No和Nw分别为有机相和水相样品的放射性计数率,s-1。重复操作3次,取平均值为该标记物的脂水分配系数。
1.6 正常鼠的生物分布
取正常鼠16只,4只一组,取0.15 mL(1.11~1.85 MBq)的68Ga-DOTA-ANCP-PSMA通过尾静脉注射。在15、30、60、90 min时取血,断颈处死,处死后分别取心脏、肺、肝、脾、肾、胰腺、胃、小肠、大肠、膀胱、骨、肌肉等器官。将各器官进行称重,测放射性计数,计数通过标准液进行标准校正,经过计算得到每克组织的放射性摄取。
1.7 荷瘤裸鼠的生物分布
取荷瘤裸鼠12只,3只一组,取0.15 mL(1.11~1.85 MBq)的68Ga-DOTA-ANCP-PSMA通过尾静脉注射。在5、15、30、60 min时断颈处死,处死后分别取心脏、肺、肝、脾、肾、胰腺、胃、小肠、大肠、膀胱、骨、肌肉、肿瘤等器官,并进行取血。将各器官进行称重,测放射性计数,计数通过标准液进行标准校正,经过计算得到每克组织的放射性摄取。
1.8 PET-CT显像
小型PET显像研究时,取0.15 mL(1.85~3.7 MBq)的68Ga-DOTA-ANCP-PSMA通过尾静脉注射到荷瘤裸鼠中。异氟烷麻醉后的动物俯卧式固定在动物PET扫描仪上,从注射后15 min开始扫描15 min静态PET-CT影像;之后从注射后60 min开始扫描15 min静态PET-CT影像。
阻断显像实验,首先按照2 mg/kg给小鼠注射2-(膦酰甲基)戊二酸(2-(phosphonomethyl)pentanedioic acid,2-PMPA), 每只约50 μL。2-PMPA是高效选择性的谷氨酸羧肽酶Ⅱ抑制剂,对PSMA具有较强的抑制作用。之后取0.15 mL(1.85~3.7 MBq)68Ga-DOTA-ANCP-PSMA,通过尾静脉注射到荷瘤裸鼠中。异氟烷麻醉后的动物俯卧式固定在小型PET扫描仪上,从注射后15 min开始PET扫描15 min,CT扫描1 min;之后从注射后60 min开始扫描15 min,CT扫描1 min,获得静态PET-CT影像。
2 结果与讨论
2.1 前体化合物的表征
化合物DOTA-ANCP-PSMA的质谱图示于图3。由图3可知:593.4处为(M-2H)/2峰,1 187.0处为M-H峰,其实际分子量为1 188.6,根据质谱结构确证其结构正确。前体化合物DOTA-ANCP-PSMA的HPLC图谱示于图4。由图4可知,DOTA-ANCP-PSMA的纯度大于95%。色谱的流动相:0.1%(体积分数,下同)TFA的水和含0.1%TFA的乙腈溶液,0—13 min,20%—55%乙腈相;13—15 min,55%乙腈相;15—18 min,55%—20%乙腈相。

图3 DOTA-ANCP-PSMA的质谱图Fig.3 Mass spectrum of DOTA-ANCP-PSMA
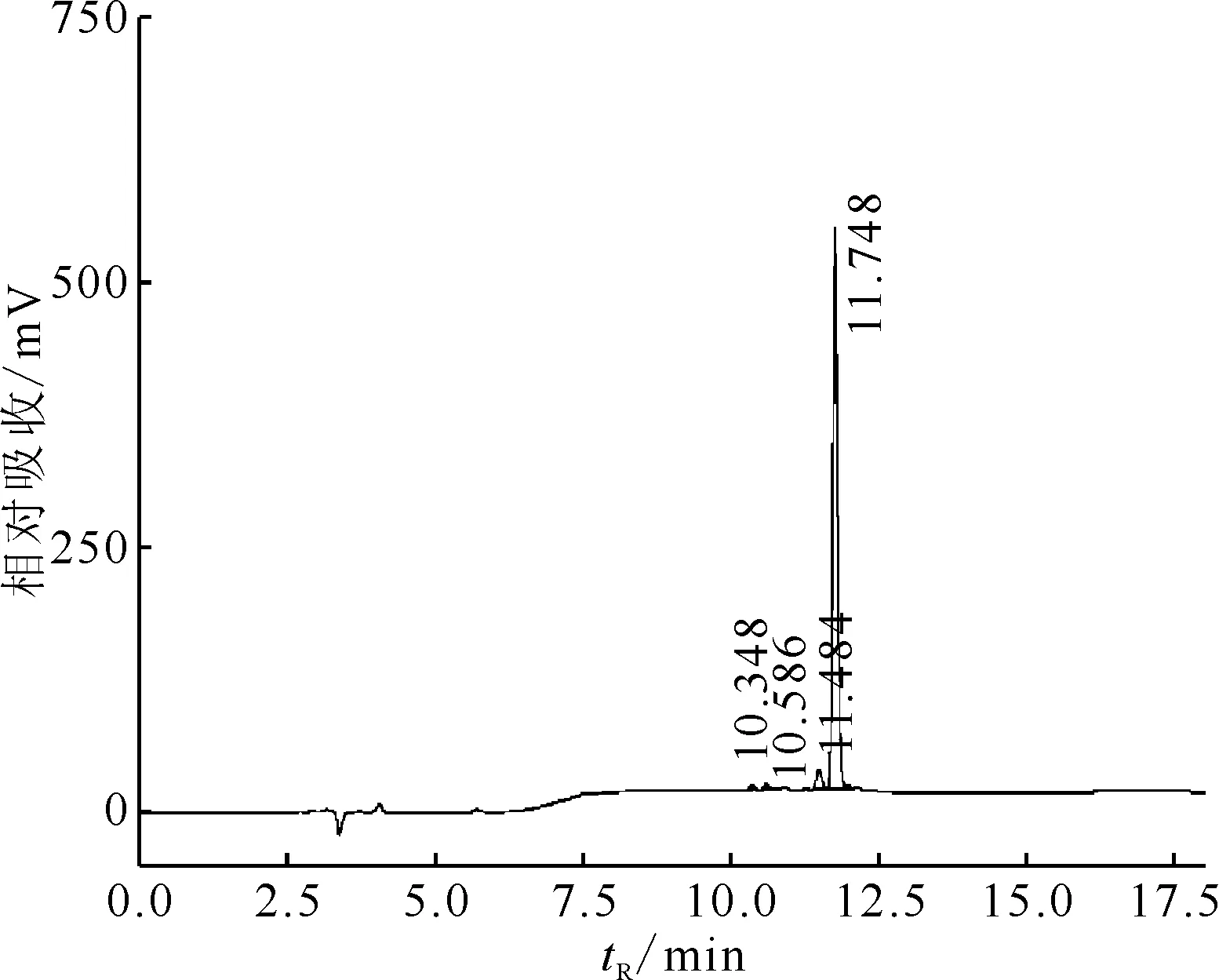
图4 DOTA-ANCP-PSMA的HPLC图谱Fig.4 HPLC chomatography of DOTA-ANCP-PSMA
2.2 68Ga标记结果
纯化后68Ga-DOTA-ANCP-PSMA的HPLC图谱示于图5。由图5可知,纯化后的68Ga-DOTA-ANCP-PSMA在放射性检测器上显示的保留时间为12.104 min。由图4可知,前体化合物的保留时间为11.748 min。由于色谱仪的紫外检测器与放射性检测器为串联方式,同一化合物的保留时间相差0.3~0.4 min,即放射性标记物的保留时间与前体化合物的保留时间一致。68Ga-DOTA-ANCP-PSMA的标记率大于95%,纯化后放射化学纯度可达95.3%,其中保留时间约2.8 min处为游离的68Ga3+,峰面积比为1.4%,约11.8 min处的杂质为前体化合物中的多肽杂质与68Ga3+螯合形成的放射性杂质,峰面积比为3.3%。纯化后的产品收率为75%~81%(衰变校正后)。

图5 纯化后68Ga-DOTA-ANCP-PSMA的HPLC图谱Fig.5 HPLC chomatography of 68Ga-DOTA-ANCP-PSMA
2.3 体外稳定性研究

◆——PBS,■——BSA图6 两个体系下68Ga-DOTA-ANCP-PSMA的放射化学稳定性Fig.6 Radiochemistry purity stability of 68Ga-DOTA-ANCP-PSMA in two systems
对PBS和BSA体系中68Ga-DOTA-ANCP-PSMA的放射化学纯度进行了稳定性测试,结果示于图6。由图6可知:PBS体系中,从30 min开始至150 min,68Ga-DOTA-ANCP-PSMA的放射化学纯度略有降低,但稳定性始终保持在95%以上,说明其在PBS中的稳定性良好;对于BSA体系,从30 min开始,放射化学纯度持续略微下降,至90 min,已略低于95%。这说明68Ga-DOTA-ANCP-PSMA在BSA中的稳定性比PBS条件下略差,也预示在生物体内的稳定性会有一定的降低,但在90 min维持在95%左右,可以满足PET显像的需求。
2.4 脂水分配系数结果
68Ga-DOTA-ANCP-PSMA的脂水分配系数为-1.42±0.02(n=3)。与结构类似的标记物68Ga-NOTA-ANCP-PSMA的脂水分配系数-1.36[17]相比,亲脂性相似。与68Ga-PSMA-617脂水分配系数-2.00[12]相比,具有更高的亲脂性,符合结构设计的预期。
2.5 正常鼠生物分布结果
68Ga-DOTA-ANCP-PSMA在正常小鼠的生物分布结果列入表1。由表1可知:在15 min内,血液中的放射性摄取达到最高值,血液清除较快;标记物主要通过肾脏代谢,在15、30 min时肾脏的放射性摄取达到(135.54±8.36)%ID/g、(61.11±5.29)%ID/g;肝脏的放射性摄取较低,15、30 min时的放射性摄取仅有(2.10±0.20)%ID/g、(1.67±0.72)%ID/g,肾脏摄取达到肝脏的20~50倍,该化合物在体内代谢速度较快;在心脏、肺、脾、胰腺、胃、小肠、大肠中放射性摄取均较低,低于血液摄取;肌肉、骨等非靶组织等的摄取也较低,可以保证肿瘤显像时的低背景水平。膀胱中有一定的摄取,这是由于标记物主要通过尿液排泄,膀胱显示出较高的摄取值。肾脏的高摄取符合PSMA小分子抑制剂亲水性好的特点。
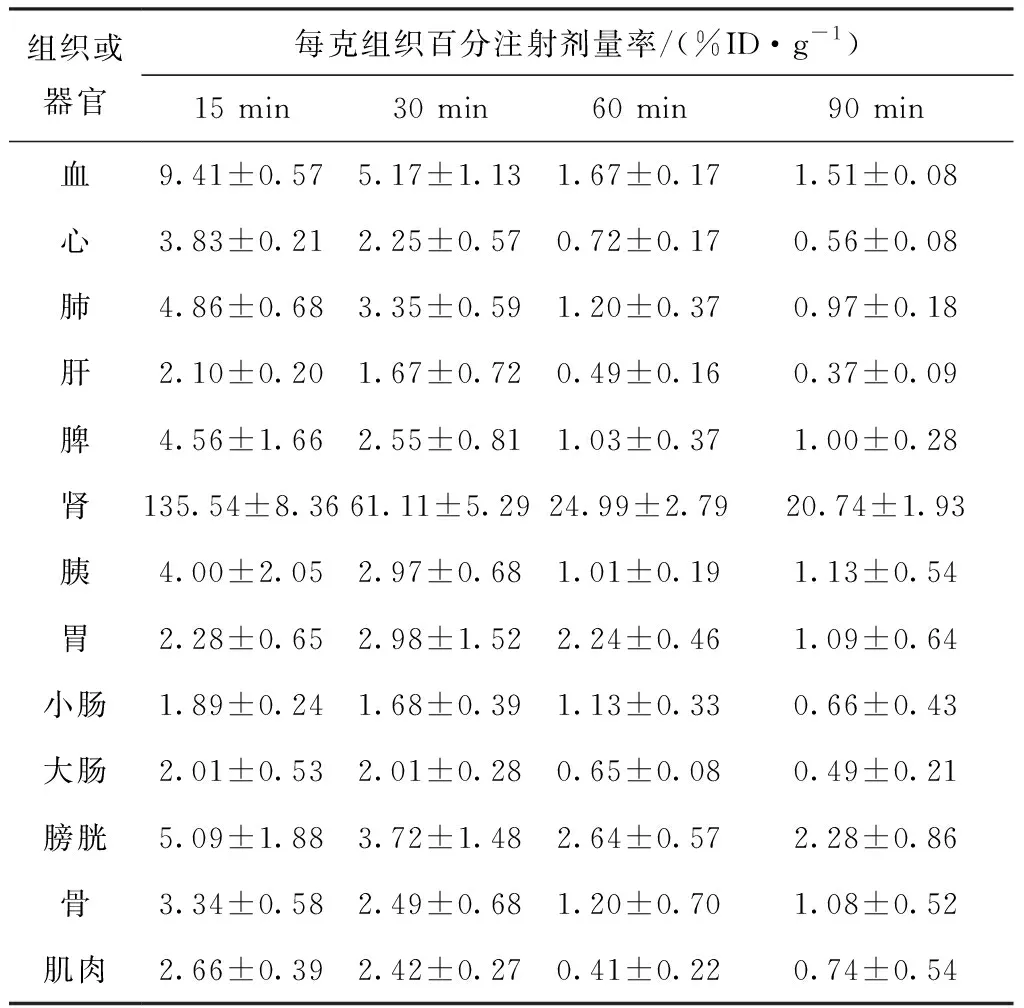
表1 68Ga-DOTA-ANCP-PSMA的正常小鼠生物分布Table 1 Biodistribution of 68Ga-DOTA-ANCP-PSMA in normal mice
2.6 荷瘤裸鼠生物分布结果
68Ga-DOTA-ANCP-PSMA在荷瘤裸鼠体内分布结果列入表2。由表2可知:68Ga-DOTA-ANCP-PSMA在血液中清除较快,主要通过肾脏代谢,肝脏的放射性摄取较低,在心脏、肺、脾、胰腺、胃、小肠、大肠中放射性摄取均较低,远低于血液中的值;肌肉、骨等的放射性摄取也较低,代谢的速度与特点基本与正常小鼠的生物分布结果一致。在肿瘤中有较高的摄取,在5、15、30 min的放射性摄取值分别可达(11.51±1.12)、(6.13±0.75)、(2.30±0.06)%ID/g,随着时间变化,肿瘤的放射性摄取有一定下降,在5 min左右摄取达到最高值,之后逐渐开始降低。这些生物分布的特点符合68Ga半衰期短的特点,有利于在短时间内完成PET-CT扫描。

表2 68Ga-DOTA-ANCP-PSMA的荷瘤裸鼠生物分布Table 2 Biodistribution of 68Ga-DOTA-ANCP-PSMA in nude mice bearing LNCaP
68Ga-DOTA-ANCP-PSMA的靶/非靶比列入表3。由表3可知:瘤/血比在15 min时达到最高,为0.71;瘤/肌肉比和瘤/骨比均较高,15 min时达到最高,分别达到3.41和2.26,15 min后随着时间延长而逐渐降低。
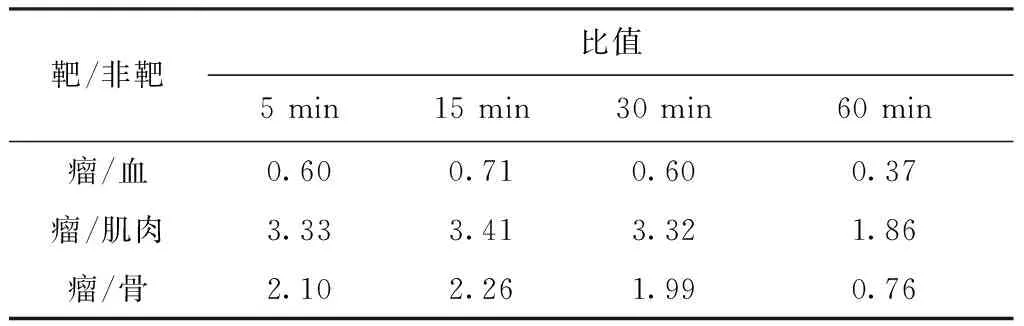
表3 68Ga-DOTA-ANCP-PSMA的靶/非靶比Table 3 Target/non-target ratio of 68Ga-DOTA-ANCP-PSMA
2.7 PET-CT显像结果
15 min时,68Ga-DOTA-ANCP-PSMA 在荷LNCaP裸鼠上进行的PET-CT显像结果示于图7。由图7可知:标记物在膀胱、肾脏有较高摄取,在肝、肺、脾脏等器官均有一定的摄取,与裸鼠的体内分布实验结果一致;在心脏位置摄取较高,这是由于该时相血药浓度较高,血液中的摄取导致在心脏位置的影像,显示高摄取;在肿瘤位置有明显的摄取。在阻断显像实验中,可以看到在肾脏、膀胱仍有较高摄取,在其它器官摄取较少,在肿瘤位置无摄取。该药物的特异性和灵敏度较好。

(a)、(c)——注射1.85 MBq 68Ga-DOTA-ANCP-PSMA;(b)、(d)——注射1.85 MBq 68Ga-DOTA-ANCP-PSMA和抑制剂0.05 mg 2-PMAP;(a)、(b)——注射15 min后显像;(c)、(d)——注射60 min后显像图7 68Ga-DOTA-ANCP-PSMA在荷瘤裸鼠的PET-CT显像Fig.7 PET-CT imaging of 68Ga-DOTA-ANCP-PSMA in nude mice bearing LNCaP after injection
60 min的显像结果显示,68Ga-DOTA-ANCP-PSMA在荷瘤裸鼠体内主要分布在肾脏和膀胱,与动物分布实验结果一致,该化合物主要通过肾脏排泄。在其它非靶器官摄取较低,在肿瘤部位有较高摄取,可以清晰看到肿瘤的位置。在阻断实验中,荷瘤裸鼠体内的肿瘤摄取较低,其它器官摄取与非阻断模型一致。在该时相下,由于非靶器官和组织摄取降低,肿瘤摄取明显,适合在此时相进行PET-CT的显像诊断,具有较好的灵敏度和代谢周期。
3 小 结
68Ga标记的68Ga-DOTA-ANCP-PSMA具有标记速率快、标记率高的特点,20 min可完成标记与纯化,放射化学纯度大于95%。标记物稳定性好,在2 h内放射化学纯度保持在95%左右,并且有较好的亲水性。68Ga-DOTA-ANCP-PSMA主要通过肾脏排泄,其它非靶器官的放射性摄取均较低,在肿瘤中有一定的摄取。在PET-CT的诊断研究中,显示出较好的灵敏度和特异性,肿瘤位置影像清晰,除了肾脏和膀胱外,其它器官和组织的放射性摄取均较低。68Ga-DOTA-ANCP-PSMA在注射15 min后肿瘤已有较高的放射性摄取,但由于非靶器官的放射性摄取和血液浓度较高,影响PET-CT图像效果,选择在注射60 min后进行显像,可以获得清晰的影像。68Ga-DOTA-ANCP-PSMA具有较好的体内外性质,有望成为新型的前列腺癌特异性靶向诊断试剂。
