混合澄清槽萃取过程的瞬态行为及瞬态数学模型
2020-08-21刘占元赵皓贵叶国安
于 婷,何 辉,刘占元,张 岚,李 峥,赵皓贵,叶国安,*
1.中国原子能科学研究院 放射化学研究所,北京 102413 2.中国科学院 上海应用物理研究所 放射化学与工程技术部,上海 201800
萃取过程瞬态模型可反映萃取设备从启动到最终动态平衡,设备内两相液体流速、组成、组分浓度等的变化及分布。稳态模型则为设备达到动态平衡时组成、组分浓度的分布,稳态模型实质上是一种特殊情况的瞬态模型。混合澄清槽是核化工领域普遍采用的一类级式萃取设备,对其瞬态行为进行研究,建立瞬态数学模型,对混合澄清槽启动至萃取平衡以及停车过程等进行过程透视,可对实际操作过程进行优化,对于工艺运行过程有指导意义[1-2]。
混合澄清槽瞬态模型主要对设备内流体流动行为(物理模型)和萃取行为(化学模型)进行模拟[3]。模型按照模拟对象不同可以分为三类:流体力学行为模拟,萃取行为模拟,同时对流体力学行为和萃取行为进行模拟。兼顾流体力学行为和萃取行为的瞬态模拟因数学模型复杂、难以求解的问题,模拟效果并不理想。流体力学行为瞬态模型多借助商用流体力学软件,对设备内两相流体在物理搅动下的混合、分散、聚合以及分相等行为进行模拟,对此过程建模无需考虑传质行为,流体力学行为最终会体现在对级效率、传质系数等传质过程参数的影响上[4]。传质行为瞬态模拟出于模型简化、降低计算复杂度的目的,多会忽略流体力学行为影响[5-6]。
国外研究人员针对混合澄清槽的流体力学瞬态模型,开展了一系列研究工作,如Gomes针对澄清室提出的“浅层澄清室模型”(shallow-layer settler),该模型主要针对澄清室中分散带行为进行模拟,后期Gomes又对模型算法进行了优化[3]。
后处理混合澄清槽萃取过程的数学模拟软件鲜见详细报道。可对后处理混合澄清槽萃取行为进行瞬态模拟的模拟软件仅有SEPHIS系列[7-8]、SOLVEX[9]、PUBG[10]和MIXSET系列[11]。SEPHIS是20世纪80年代美国橡树岭国家实验室开发的系列软件,所建立的混合澄清槽瞬态模型对同一级的混合室和澄清室分别计算,假设传质仅在混合室发生,对于混合室中与时间相关的微分方程使用龙格-库塔数值算法求解,澄清室与时间相关的微分方程简化成为有限差分形式迭代求解。国际原子能机构(IAEA)开发的模拟软件PUBG,该软件中瞬态模型对混合室和澄清室分开计算,其中澄清室的数学模型中与时间相关的微分方程使用龙格-库塔数值方法求解,混合室瞬态模型则简化成为稳态形式进行求解。SOLVEX是萨凡纳河实验室开发的一款可以对萃取过程稳态和瞬态计算的流程模拟软件,建立的瞬态模型与SEPHIS相似。
化工行业也有进行混合澄清槽瞬态行为模拟研究的,建立的瞬态模型对于组分在两相间分配比恒定的萃取体系,对各级联立线性方程组进行求解;分配比变化时则使用数值方法求得数值解。后者的瞬态模型中使用传质速率方程(双膜模型)求解分配比,但实际上各种组分的传质速率难以确定且计算耗时,模型求解困难[6]。化工行业现在针对蒸馏、吸收等过程已经开发了大量的稳态和瞬态模拟软件,如ASPEN、PROII、CHEMCAD等,但这些软件目前针对级式逆流萃取只能进行稳态模拟,不能进行瞬态模拟计算[2,4]。
掌握混合澄清槽从启动到稳态运行各级浓度变化以及运行稳态的实现,甚至包括料液流速的变动、组成、浓度变化,以及其他参数变化时混合澄清槽的动态响应,均离不开混合澄清槽瞬态行为的研究和瞬态模型的建立。因此有必要开展混合澄清槽瞬态行为及模型研究,为后续工艺模拟提供技术支持。
1 混合澄清槽瞬态模拟数学模型
1.1 单级模型
混合澄清槽是一种物理界限划分非常明显的级式萃取设备,其最小的萃取单元为一级,因此首先对萃取单元进行分析。对混合澄清槽、离心萃取器等级式设备进行稳态模拟时,不需要考虑时间的因素,因此两相液体在槽子中的停留时间、混合室以及澄清室体积等均不需要考虑;而在瞬态模拟中,这些参数均是预测混合澄清槽性能所需要的参数[4]。
一般认为在混合室发生传质反应、氧化还原反应等,澄清室一般只发生两相的分离,则两相液体在一级中的平均停留时间为:
(1)
其中:t′表示一级的停留时间,Vm为混合室体积,Vs为澄清室体积,L为有机相流速,V表示水相流速。
在实际操作中,料液在混合室中的平均停留时间一般为1~2 min[2],在一级中停留时间为4~8 min,在本模型中选择一级的停留时间作为最小的时间计算单元,则对于单元时间而言,萃取单元内符合物料守恒,具体浓度表达式如下式:
xj+1,t-1V+yj-1,t-1L+R=xj,tV+yj,tL
(2)
(3)
(4)
式中:x表示水相组分浓度,y表示有机相组分浓度,V为水相流速,L为有机相流速,R表示化学反应项,D为组分在两相中的分配比,E表示级效率,下标j表示第j级,t表示停留时间单元数。在此需要说明,若是传质速率控制或者存在化学反应的萃取体系(如硝酸羟胺(HAN)还原反萃Pu(Ⅳ)),其对化学反应项或传质反应项计算所采用的时长应为实际平均停留时间。第j级萃取模型概念图示于图1。

图1 第j级萃取模型概念图Fig.1 Conceptual graph of stage j
1.2 级联瞬态模型
混合澄清槽瞬态模型所需要的参数有:级数、进料口和出料口、混合室体积、澄清室体积(确定停留时间)、级效率(计算得到或者由用户输入)等。如图2所示,一个N级的混合澄清槽,有机相料液AX从第一级进料,水相AF从第N级进料,有机相AP从第N级出料,水相料液AW从第一级出料。

图2 逆流萃取混合澄清槽瞬态模型概念图Fig.2 Conceptual graph of counter-current mixer-settler transient model
经过对混合澄清槽运行过程分析,模型假设:启动时使用不含组分的空白料液充槽,即混合澄清槽中每一级均按照运行相比填充水相和有机相料液;不存在氧化还原反应的萃取过程,每一级的停留时间按照式(1)计算,存在氧化还原反应的萃取过程,在进行反应动力学模型计算时,反应时间按照式(1)计算;以每个停留时间t′作为一个时间间隔进行计算,每个时间间隔结束后,第n级的有机相和水相作为下一时间间隔第n+1级和第n-1级的有机相输入和水相输出;假设各级水相和有机相体积在传质前后无变化。
对于每一级则按物料守恒计算方程求解得到水相和有机相中物料组成。
1.3 瞬态模型算法
以图2所示的萃取流程,即先使用有机相充槽,之后进含有待萃取组分的水相,瞬态模型的算法具体如下,其中t表示一个停留时间,t=0~N为混合澄清槽充槽阶段的瞬态模拟,N+1~∞即为从瞬态到稳态运行的计算过程:
(1)t=0时刻:水相和有机相空白料液按照正常运行时流比充满混合澄清槽,此时是混合澄清槽开始传质的临界时间;
(2)t=1:第N级进行传质反应,并完成两相间的传质,该时间段第N级的水相和有机相输入组分浓度分别为x和y,流入速率分别为V和L,水相和有机相输出组分浓度分别为xN,1和yN,1,流出速率不变仍为V和L,下同;
(3)t=2:第N级和第N-1级进行传质反应,其中第N-1级的水相和有机相输入组分浓度分别为xN,1和y,输出组分浓度分别为xN-1,2和yN-1,2,第N级的水相和有机相输入组分浓度分别为x和y,输出组分浓度分别为xN,2和yN,2;
(4)t=N:除第N级外,各级的水相输入均是水相流入方向上一级t=N-1的输出,第N级的水相输入组分浓度是x,水相输出组分浓度为xN,N,除第1级外的各级有机相输入均是有机相流入方向上一级t=N-1的输出,第1级的有机相输入组分浓度为y,有机相输出组分浓度为yN,N;
(5)t=∞:对于混合澄清槽相邻两个停留时间的两相出口组分浓度进行比较,当浓度差小于设定的某个极小值ε时,则认为混合澄清槽达到稳态运行(或判断混合澄清槽内是否达到物料守恒,即进入混合澄清槽的物质的量等于流出混合澄清槽的物质的量,则认为混合澄清槽的运行达到动态平衡),输出不同停留时间的各级浓度。
2 混合澄清槽瞬态行为研究及模型验证
实验所用硝酸铀酰由中国原子能科学研究院提供,其他试剂均为市售分析纯。
2.1 HNO3萃取瞬态行为研究
2.1.1HNO3萃取台架试验 采用4级5 mL混合澄清槽开展HNO3萃取实验。有机相为30%(体积分数,下同)TBP/正十二烷,水相为3.20 mol/L HNO3溶液。有机相∶水相(O∶A)体积比为1∶1。采用酸碱滴定法分析HNO3。具体实验步骤如下:
(1) 使用HNO3浓度为3.20 mol/L的水溶液充槽,水相从水相出口(第1级)流出的时间设为t=0(运行槽体积为0);
(2) 初始时刻为空白有机相进料时刻,有机相从混合澄清槽第4级流出时记为一个槽体积运行时间,分别对各级水相和有机相取样;
(3) 此后每隔2个停留时间(0.5个槽体积)对4级取水相以及有机相平行样,直至混合澄清槽稳态运行为止(酸萃取一般3~4个槽体积即可平衡,故需要运行4个槽体积以上),要求水相和有机相取样量要足够小,尽量减少对混合澄清槽运行的影响。
(4) 停车后取得各级稳态样品。
2.1.2结果与讨论 混合澄清槽瞬态→稳态实验结果及同等条件模拟结果列于表1和2。由表1可知,不同运行槽体积下水相酸度计算值与实验值相对误差均低于|5%|,有机相酸度计算值与实验值相对误差低于|15%|,计算值与实验值符合良好,从而证明提出的瞬态→稳态算法的可靠性。图3为4级混合澄清槽萃取实验浓度剖面图。由图3可知,混合澄清槽中30%TBP/正十二烷萃取HNO3达到稳态速度较快,以水相充槽,运行3.0个槽体积即可达到萃取平衡,此时混合澄清槽内各级有机相和水相中HNO3浓度不再发生变化。图4是混合澄清槽运行不同槽体积时出口水相和出口有机相中HNO3浓度的计算值与实验值的比对,由图4可知,实测值和计算值符合良好。

表1 4级混合澄清槽台架试验各级水相HNO3浓度(cA(HNO3))计算值与实验值比对Table 1 Concentration profiles of aqueous HNO3 (cA(HNO3)) in 4-stage mixer-settler contactor

表2 4级混合澄清槽台架试验各级有机相HNO3浓度(cO(HNO3))计算值与实验值比对Table 2 Concentration profiles of organic HNO3 (cO(HNO3)) in 4-stage mixer-settler contactor
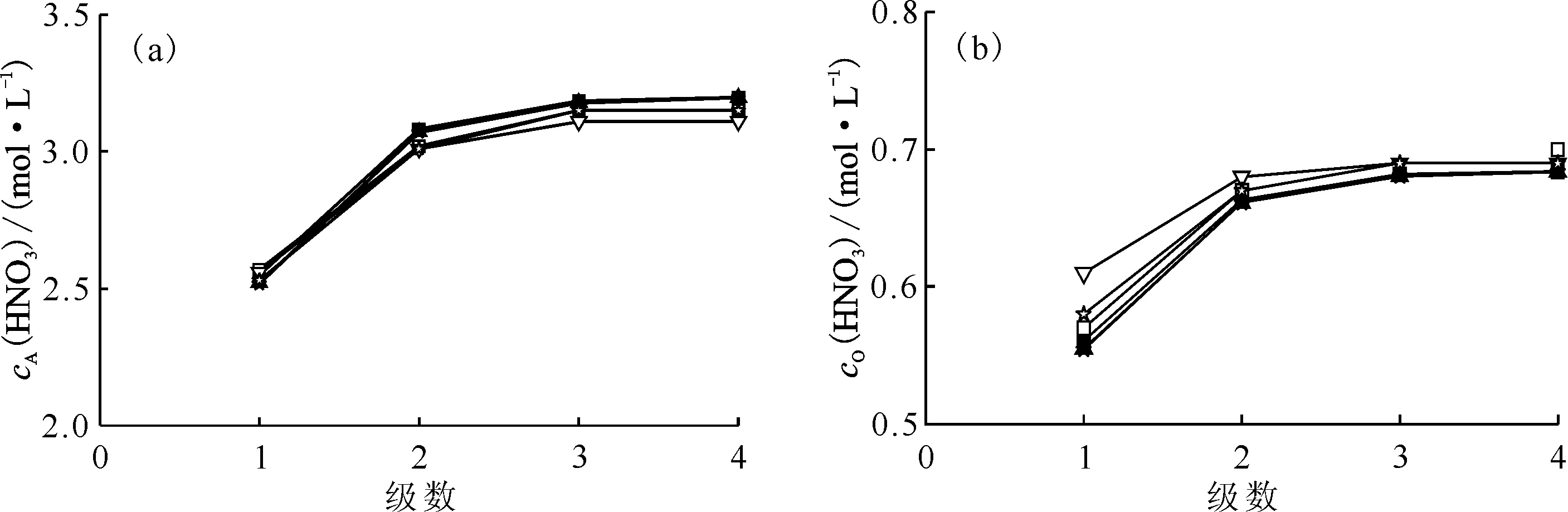
■、▲、★分别表示运行1.0、2.0、3.0个槽体积时的浓度计算值;□、▽、☆分别表示运行1.0、2.0、3.0个槽体积时的浓度实验值(a)——水相,(b)——有机相图3 4级混合澄清槽萃取实验HNO3浓度剖面Fig.3 Concentration profiles of HNO3 in 4-stage mixer-settler contactor
2.2 HNO3-U(Ⅵ)萃取瞬态行为研究
2.2.1HNO3-U(Ⅵ)萃取台架试验 采用8级9 mL混合澄清槽(混合室体积为9 mL,澄清室体积为22.5 mL)进行HNO3萃取实验。有机相为30%TBP/正十二烷,水相为3.03 mol/L HNO3、44.6 g/L U(Ⅵ)溶液;O∶A体积比为1∶1。采用酸碱滴定法分析HNO3浓度。常量U的水相样品使用METTLER TOLEDO T70电位滴定仪,利用硫酸亚铁还原-重铬酸钾氧化滴定法(GB 11841-89)进行分析;微量U的水相样品用w=2% HNO3稀释适当倍数后,使用电感耦合等离子体发射光谱仪(ICP-OES)分析。有机相U浓度分析,先使用0.5 mol/L(NH4)2CO3溶液反萃有机相U(反萃相比A∶O体积比10∶1),后按水相U浓度分析方法进行分析。具体实验步骤如下:
(1) 使用3.03 mol/L HNO3、44.6 g/L U(Ⅵ)溶液充槽,水相从水相出口(第1级)流出的时间设为t=0(运行槽体积为0);
(2) 初始时刻为空白有机相进料时刻,有机相从混合澄清槽第8级流出时记为一个槽体积运行时间,分别对各级水相和有机相取样;
(3) 此后每隔4个停留时间(0.5个槽体积),对8级取水相以及有机相平行样,直至混合澄清槽稳态运行为止(共运行6个槽体积),要求水相和有机相取样量要足够小,尽量减少对混合澄清槽运行的影响;
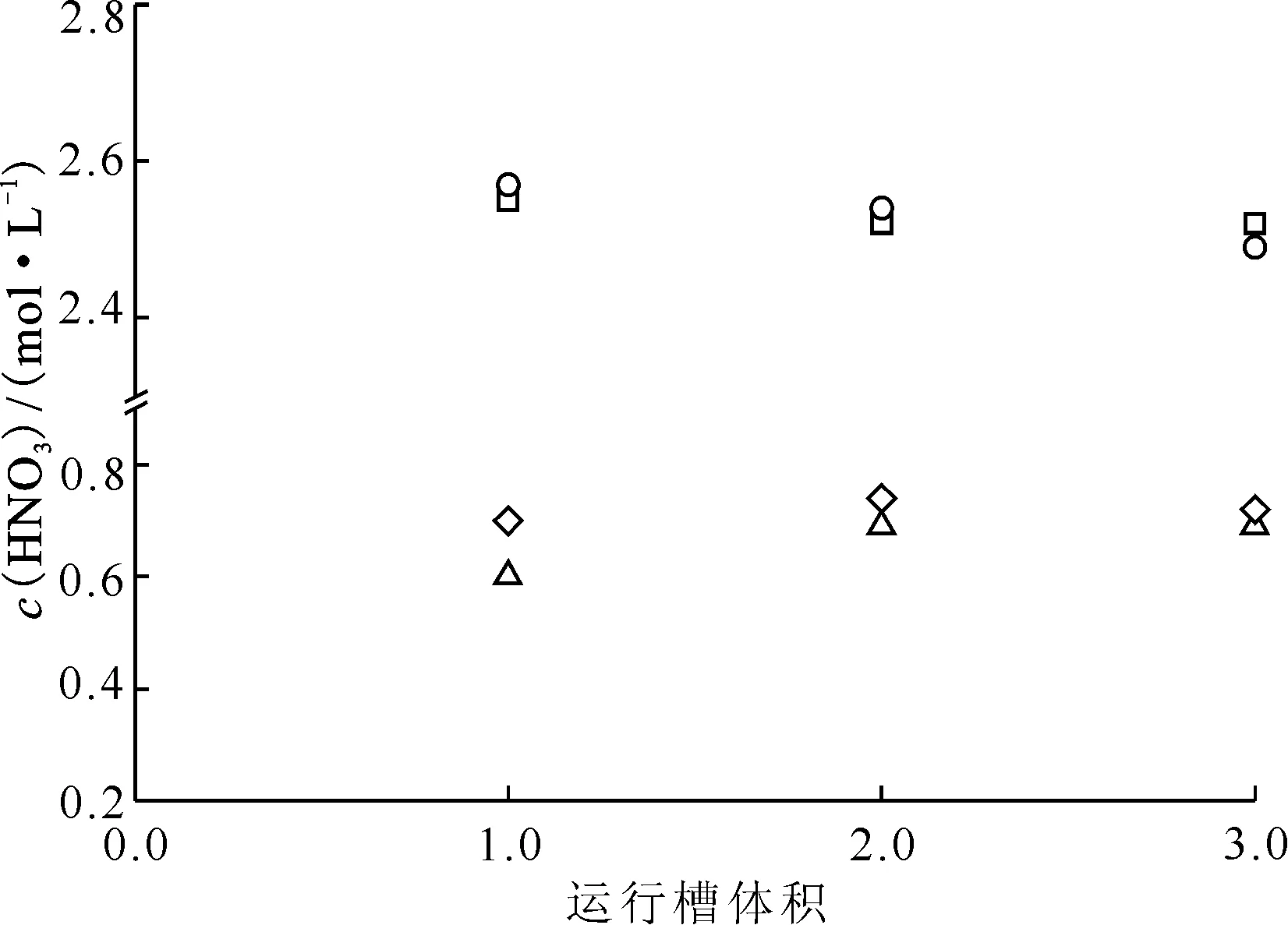
○——水相出口料液HNO3浓度的实验值,□——水相出口料液HNO3浓度的计算值,◇——有机相出口料液HNO3浓度的实验值,△——有机相出口料液HNO3浓度的计算值图4 4级混合澄清槽两相出口HNO3浓度计算值与实验值比对Fig.4 HNO3 concentrations in outlet of 4-stage mixer-settler contactor
(4) 台架试验结束后取各级平衡态样品,分析其中的U浓度及酸浓度。
2.2.2结果与讨论 HNO3-U(Ⅵ)萃取混合澄清槽瞬态→稳态实验运行不同槽体积的实验结果及同等条件模拟计算结果列于表3—6。由表3和表5可知,在不同运行槽体积时,各级水相酸度计算值和实验值相对误差低于|6%|,各级有机相酸度计算值和实验值相对误差基本低于|10%|,计算值与实测值符合良好。由表4和表6可知,水相及有机相中U浓度的计算值和实验值相对误差随混合澄清槽运行槽体积的增大逐渐降低,最终稳态时有机相出口端水相及有机相U浓度计算值和实验值基本符合,通过计算发现模型计算比混合澄清槽实际运行更快达到稳态,分析原因是在实际实验过程中混合澄清槽每一级级效率低于100%导致实际结果偏离理论计算值所致。图5是萃取实验运行不同槽体积时水相及有机相出口HNO3、U浓度值。由图5可知,两相出口HNO3浓度基本不随槽体积的变化而变化,U浓度受运行槽体积的变化影响较大,这说明在HNO3-U(Ⅵ)萃取体系中,酸较U更快达到萃取平衡,HNO3-U(Ⅵ)萃取体系基本在运行2~3个槽体积即可达到稳态运行。实验值和计算值基本符合良好,证明了所提出的瞬态→稳态模型算法的正确性。图6为8级混合澄清槽运行达到稳态时,各级水相和有机相中HNO3、U浓度剖面。由图6可知,计算软件的稳态计算值和实验值符合良好。

表3 8级混合澄清槽台架试验各级水相HNO3浓度计算值与实验值比对Table 3 Concentration profiles of aqueous HNO3 in 8-stage mixer-settler contactor

表4 8级混合澄清槽台架试验各级水相U浓度计算值与实验值比对Table 4 Concentration profiles of aqueous U in 8-stage mixer-settler contactor

表5 8级混合澄清槽台架试验各级有机相HNO3浓度计算值与实验值比对Table 5 Concentration profiles of organic HNO3 in 8-stage mixer-settler contactor

表6 8级混合澄清槽台架试验各级有机相U浓度计算值与实验值比对Table 6 Concentration profiles of organic U in 8-stage mixer-settler contactor
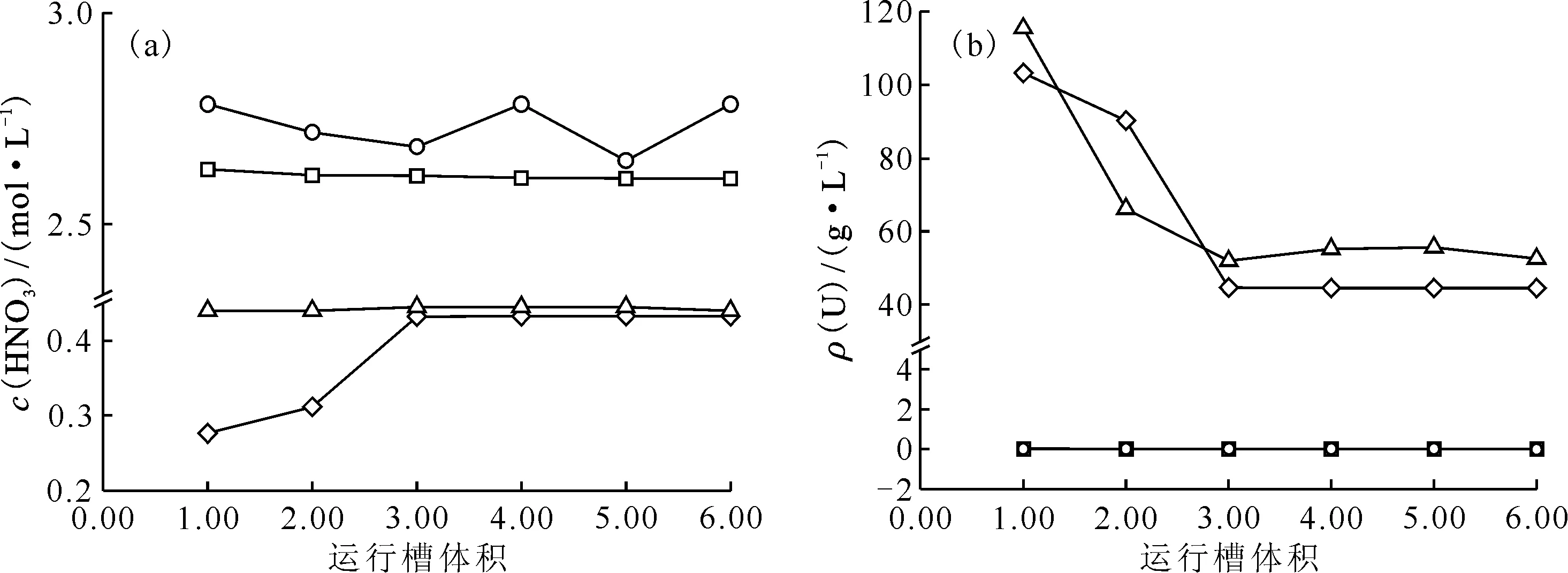
(a)——HNO3,(b)——U○——水相出口浓度实验值,□——水相出口浓度计算值,◇——有机相出口浓度计算值,Δ——有机相出口浓度实验值图5 8级混合澄清槽萃取实验运行不同槽体积时出口组分浓度Fig5 Concentrations in outlet of 8-stage mixer-settler contactor in different flow volumn

(a)——HNO3,(b)——U○——水相出口浓度实验值,□——水相出口浓度计算值,Δ——有机相出口浓度计算值,◇——有机相出口浓度实验值图6 8级混合澄清槽萃取实验稳态时各物质浓度剖面Fig.6 Equilibrium concentration profile of 8-stage mixer-settler contactor
3 计算研究
3.1 酸萃取计算研究
使用编写的混合澄清槽瞬态模拟计算程序对混合澄清槽运行瞬态→稳态的影响因素进行了研究,首先进行了HNO3萃取的计算,在8级混合澄清槽、操作温度为25 ℃条件下,分别对使用水相充槽和有机相充槽所需要的平衡槽体积进行研究,计算初始条件以及计算结果列于表7。由表7结果可知,对于单HNO3萃取而言,使用含有萃取组分的水相或使用空白萃取相充槽,混合澄清槽达到稳态所需要的运行槽体积是不同的,有机相充槽所需要的槽体积要比水相充槽所需的槽体积要多,即萃取过程中使用萃取相(有机相)充槽,所需要的槽体积要比使用水相充槽的槽体积要多。图7(a)—(e)分别表示表7编号为1、2、3、4、5萃取条件时的混合澄清槽运行达到稳态后的各级水相和有机相中HNO3的浓度分布。由图7可知,使用有机相充槽和水相充槽,混合澄清槽运行达到稳态(动态平衡)后各级有机相和水相中HNO3浓度值相同。使用水相和有机相充槽到达混合澄清槽稳态运行时所需要的时间不同,但最终稳态结果相同。

表7 HNO3萃取混合澄清槽瞬态→稳态运行所需槽体积Table 7 Flow volumn needed to achieve mass-transfer equilibrium

◇——有机相充槽时平衡水相浓度,□——水相充槽时平衡水相浓度,Δ——有机相充槽时平衡有机相浓度, ▽——水相充槽时平衡有机相浓度萃取条件:(a)——表7编号1,(b)——表7编号2,(c)——表7编号3,(d)——表7编号4,(e)——表7编号5图7 不同萃取条件下8级混合澄清槽稳态运行时HNO3浓度剖面Fig.7 Equilibrium concentration profile of HNO3 in 8-stage mixer-settler contactor at different extraction conditions
3.2 铀、钚萃取计算研究
使用编写的混合澄清槽萃取瞬态模拟计算程序对混合澄清槽运行瞬态→稳态的影响因素进行了研究(表8),使用有机相充槽,混合澄清槽为8级,操作温度为25 ℃,计算对象为HNO3、U(Ⅵ)-HNO3、Pu(Ⅳ)-HNO3。
将一个槽体积运行时间作为一个计算时间单元,由计算得到不同运行槽体积的HNO3浓度,以及U(Ⅵ)、HNO3、Pu(Ⅳ)的浓度剖面,具体示于图8—12。
由图8可知,表8中编号7的萃取条件下,30%TBP/正十二烷对HNO3的萃取运行3.00个槽体积时即达到稳态,即运行3.00个槽体积后,各级有机相中HNO3浓度不再随时间变化而变化,整个混合澄清槽达到动态平衡(进入混合澄清槽的HNO3的量等于流出槽体的HNO3的量)。
HNO3和U(Ⅵ)混合体系的萃取(萃取条件如表8中编号21)模拟计算结果示于图9和图10。从图9、10可以看出,各级有机相中酸浓度随着萃取时间变长而增大,萃取运行4.00个槽体积时,整个混合澄清槽达到稳态,实现动态平衡,各级有机相中HNO3浓度剖面和U(Ⅵ)浓度剖面不再改变。且对比图9和图10可知,HNO3和U(Ⅵ)共萃时,各级有机相中HNO3达到萃取平衡所需要的时间要比U(Ⅵ)达到萃取平衡所需要的时间更长。由图9、10可知,不同槽体积时各级有机相中HNO3浓度变化较大,而U(Ⅵ)浓度对运行槽体积并不敏感,运行槽体积为2.00、3.00、4.00时,各级浓度无太大差异。分析原因是HNO3浓度是U(Ⅵ)萃取的主要影响因素,不同运行槽体积时,水相入口端(第8级)的HNO3浓度并无明显变化,则对于U(Ⅵ)萃取影响有限,虽然从第8级到第1级HNO3浓度变化范围较大,然而理想萃取条件下(级效率为100%),第5级至第1级的水相中U(Ⅵ)浓度已经很低,此时酸度对于U(Ⅵ)的萃取影响程度有限。

表8 金属M(U(Ⅵ)、Pu(Ⅳ))萃取混合澄清槽瞬态→稳态运行所需槽体积Table 8 Flow volumn needed to achieve mass-transfer equilibrium in extractions of metal ions(U(Ⅵ), Pu(Ⅳ))
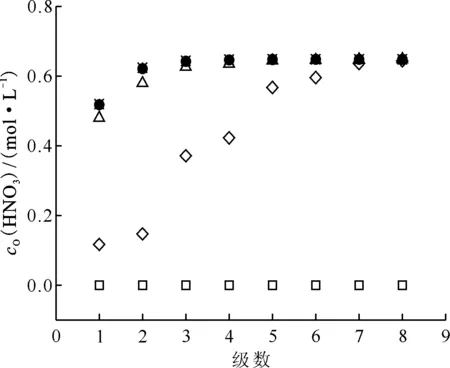
运行槽体积:□——0,◇——1.00,Δ——2.00,●——3.00,×——4.00,*——4.50图8 表8编号7萃取条件下运行不同槽体积时有机相HNO3浓度剖面Fig.8 Concentration profiles of organic HNO3in mixer-settler contactor at different flow volumn at No.7 of table 8

运行槽体积:□——0,◇——1.00,Δ——2.00,●——3.00,×——4.00,*——4.50图9 表8编号21萃取条件下运行不同槽体积时各级有机相HNO3浓度剖面Fig.9 Concentration profiles of organic HNO3 in mixer-settler contactor at different flow volumn at No.21 of table 8
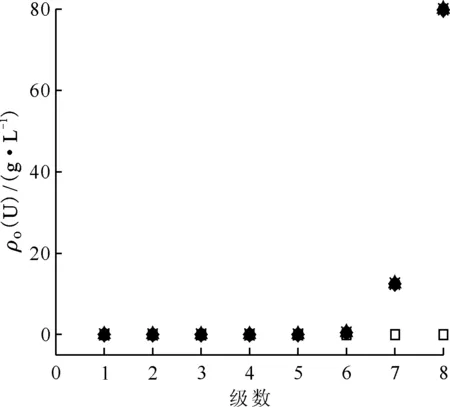
运行槽体积:□——0,◇——1.00,Δ——2.00,●——3.00,×——4.00,*——4.50图10 表8编号21萃取条件下运行不同槽体积时各级有机相U(Ⅵ)浓度剖面Fig.10 Concentration profiles of organic U(Ⅵ) in mixer-settler contactor at different flow volumn at No.21 of table 8
HNO3和Pu(Ⅳ)混合体系的萃取(萃取条件如表8编号15)模拟计算结果示于图11、12。从图11、12可以看出,各级有机相中酸浓度随着时间增长而增大,运行4.00个槽体积时,整个混合澄清槽达到稳态,实现动态平衡,各级HNO3浓度剖面和Pu(Ⅳ)浓度剖面不再改变。与HNO3-U(Ⅵ)萃取过程相似,各级有机相中HNO3达到萃取平衡所需要的时间要比Pu(Ⅳ)达到萃取平衡所需要的时间更长,运行不同槽体积时,有机相中HNO3浓度变化较大,如在运行1.00个槽体积时,第1级中有机相HNO3浓度为0.1 mol/L,运行2.00个和3.00个槽体积时,第1级HNO3浓度为0.55 mol/L和0.6 mol/L,而第1级有机相中Pu(Ⅳ)浓度基本无变化,第5级至第1级的Pu(Ⅳ)浓度无明显变化,原因与前文U(Ⅵ)萃取过程浓度变化原因相似。

运行槽体积:□——0,◇——1.00,Δ——2.00,●——3.00,×——4.00,*——4.50图11 表8编号15萃取条件下运行不同槽体积时各级有机相HNO3浓度剖面Fig.11 Concentration profiles of organic HNO3 in mixer-settler contactor at different flow volumn at No.15 of table 8
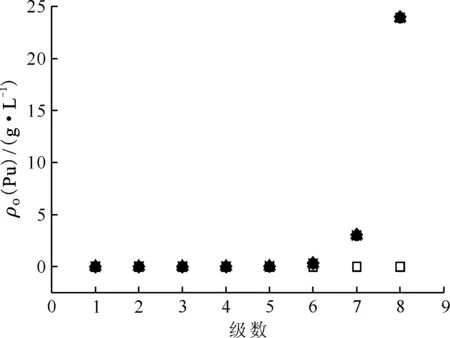
运行槽体积:□——0,◇——1.00,Δ——2.00,●——3.00,×——4.00,*——4.50图12 表8中编号15萃取条件下运行不同槽体积时各级有机相Pu(Ⅳ)浓度剖面Fig.12 Concentration profiles of organic Pu(Ⅳ) in mixer-settler contactor at different flow volumn at No.15 of table 8
由图8—12、表8可知,以8级混合澄清槽为萃取设备,各级级效率为100%理想情况下,瞬态→稳态的过渡主要受酸度影响,HNO3浓度为3 mol/L时,不同萃取体系达到稳态运行所需要的运行槽体积基本为4个,分析原因是酸度是金属M两相分配比的主要影响因素。
4 结 论
(1) 使用4级及8级小型混合澄清槽台架试验数据对混合澄清槽瞬态→稳态过程数学模型进行验证,模型计算结果与实验结果吻合良好,证明提出的瞬态模型及算法可靠;
(2) 使用模型计算研究发现,萃取过程使用水相和有机相充槽达到稳态(动态平衡)所需要的运行槽体积不同,水相充槽所需要的槽体积要小于有机相充槽所需要的槽体积;
(3) 模型计算发现,30%TBP/正十二烷萃取HNO3-U(Ⅵ)、HNO3-Pu(Ⅳ)过程,HNO3是萃取平衡主要的影响因素。
