渔源解淀粉芽孢杆菌CQN-2菌株培养基及发酵条件优化
2020-08-21杨求华
杨求华
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
肠道内源性细菌是定殖在健康生物肠道内,并与宿主建立密切联系的一类微生物,具有促进宿主生长、提高宿主免疫力及帮助宿主抵御外界病原刺激等多种生物学功能。通过来源于健康动物自身环境的正常优势菌或次优势菌,以抑制特定病原菌为目的的拮抗筛选法,是益生菌株最常用的筛选方法[1-4]。
解淀粉芽孢杆菌(Bacillusamyloliquefaciens)作为芽孢杆菌属的重要成员,在其培养过程中会产生多种具有抗菌功能的次级代谢产物,包括小肽和蛋白类、聚酮类化合物和非核糖途径形成的脂肽类等,具有广谱的抑菌活性,可以抑制真菌、细菌等多种病原[5-9]。解淀粉芽孢杆菌可以从土壤、植物、畜禽和水生动物肠道中被分离培养[10-13],且营养要求简单、非致病性、环境适应能力强[14],可作为潜在的抗生素替代物,在农业病虫害防治和益生菌添加剂开发等生物防治领域发挥重要作用[13]。已有报道表明,解淀粉芽孢杆菌可作为一种仿刺参肠道内源性益生菌[11-12]。
为提高菌株的生物量和抑菌物质产量,提高其生物防治效果,也为进一步的产业化应用开发提供基础资料,近年来已有众多学者对解淀粉芽孢杆菌的培养基和发酵条件进行了优化[15-16]。汪晶晶等[17]确定解淀粉芽孢杆菌GM-1-2的最适培养基配方为马铃薯200 g/L、葡萄糖17.5 g/L、酵母膏12.5 g/L、硫酸亚铁0.12 g/L;最佳发酵条件为初始pH 7.0、温度28℃、转速180 r/min,装液量60 mL/250 mL、接种量10%、发酵时间30 h。王勇等[18]等研究发现,解淀粉芽孢杆菌GZ-5的最适碳源为葡萄糖,最适氮源为牛肉膏+蛋白胨+酵母粉,最佳发酵条件为初始pH 7.0、温度30℃,装液量200 mL/500 m、接种量0.3%、发酵时间48 h。葛慈斌等[19]分析了解淀粉芽孢杆菌FJAT-8754发酵过程中菌体数量、pH、底物浓度,以及纤维素酶和淀粉酶等动态变化,采用Logistic方程和Luedeking-Piret方程构建了菌株FJAT-8754的发酵动力学模型,指出其发酵过程中产物的合成属于生长部分偶联型。
海参(仿刺参,Apostichopusjaponicus),自2003年开展“北参南养”试验以来,经过十多年的发展,至2018年福建省海参养殖产量达到29 829 t[20],占全国总产量的17.11%,位列全国第三大海参养殖省份。解淀粉芽孢杆菌CQN-2菌株从南移池塘养殖仿刺参肠道中分离得到,其对仿刺参病原菌灿烂弧菌、哈维氏弧菌以及水产常见病原菌创伤弧菌等[21-23]具有较好的拮抗作用,经生理生化和16S rRNA鉴定为解淀粉芽孢杆菌。为进一步提高其生物量、降低发酵成本、开发其应用价值,通过对其培养基和发酵条件进行参数优化,以期为该菌株的规模化生产和应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
解淀粉芽孢杆菌CQN-2菌株为本所分离纯化菌种,分离自福建莆田池塘养殖健康仿刺参前肠,并保藏于中国普通微生物菌种保藏管理中心(保藏编号:CGMCC No.12420)和福建省水产研究所海洋生物疾病防治研究中心。
1.1.2 供试培养基
种子培养基(1 L):马铃薯200 g、葡萄糖20 g、蛋白胨3 g、KH2PO41 g、MgSO40.5 g,pH 7.0。
LB固体培养基(1 L):蛋白胨10 g、酵母粉5 g、NaCl 10 g、琼脂20 g,pH 7.0。
基础发酵培养基(1 L):糖蜜20 g、酵母粉20 g、KH2PO40.5 g、MgSO40.5 g、NaCl 0.3 g,pH 7.0。
1.2 试验方法
1.2.1 CQN-2菌株种子液的制备
取100 μL CQN-2甘油菌种接种于装有100 mL种子培养基的250 mL三角瓶中,30℃、200 r/min振荡培养12 h;取活化后的CQN-2菌株1 mL转接于100 mL新鲜种子培养基中,30℃、200 r/min摇瓶培养24 h。
1.2.2 CQN-2菌株生物量测定
用紫外分光光度计,在波长600 nm处测定CQN-2菌株发酵液的吸光值(OD600),以无菌培养液作为对照,吸光值超过1时,使用双蒸水进行适当稀释。
1.2.3 CQN-2菌株生长曲线测定
在超净工作台中按接种量的5%取种子液转接于30 mL/250 mL基础发酵培养基中,在30℃、200 r/min摇床中培养48 h,每隔6 h取样测定菌体浓度OD600,每次3个重复。
1.2.4 培养条件优化
利用基础发酵培养基对影响CQN-2菌株生长的关键因子,包括初始pH(7.0)、装液量(30 mL/250 mL)、接菌量(5%)等发酵条件进行优化。发酵初始pH分别为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5;装液量分别为20、25、30、40、50、60、75、100、125 mL/250 mL;接菌量分别为1%、3%、5%、7%、9%。每个处理3次重复,测定菌体浓度OD600,测定不同发酵条件对CQN-2菌株生长的影响。
1.2.5 发酵培养基成分优化
以基础发酵培养基为基础培养基,以初始pH 7.0、接种量5%、装液量30 mL/250 mL、发酵温度30℃、转速200 r/min、发酵时间36 h为基础发酵条件,对培养基中几种重要成分及其浓度进行筛选优化。设置不同碳源成分(蔗糖、木糖、葡萄糖、可溶性淀粉、糊精,浓度为20 g/L)、不同氮源成分(细菌学蛋白胨、酵母膏、鱼粉蛋白胨、牛肉膏、NH4Cl,浓度为20 g/L)、不同金属离子成分(Fe2+、Fe3+、Zn2+、Ca2+、 Mn2+、Ba2+、Al3+,设置2个终浓度梯度,1 mmol/L和5 mmol/L)等,同时,设置不同最优碳源浓度(5、10、15、20、25、30、35 g/L)、不同最适氮源浓度(20、30、40、50、60、70、80 g/L)和不同糖蜜浓度(5、10、15、20、30、40、50、60、70、80 g/L)。每个处理3次重复,测定菌体浓度OD600,测定不同发酵培养基成分及其浓度对CQN-2菌株生长的影响。
1.2.6 正交试验分析
为了获得最优培养方法,在1.2.4和1.2.5单因素试验的基础上,以菌体浓度OD600为指标,利用软件Minitab 7.0设计7因素3水平正交试验(表1)。

表1 试验因素水平
1.2.7 优化后发酵条件验证试验
将CQN-2菌株接种于优化后的培养基中,并在优化后的培养条件下发酵,以基础培养基和培养条件为对照,每6 h取样一次测定OD600值,每组3个重复,并绘制菌株生长曲线,共测定48 h,菌株生长进入稳定期。
1.2.8 CQN-2菌株上罐发酵
按5%接种量取种子液转接至3 L(5 L发酵罐)最优发酵培养基中,设置温度30℃、通气量0.5 VVM、转速600 r/min条件下进行发酵培养,同时设计控制pH试验组(调节pH控制在6.0)和不控pH试验组,每8 h取样一次测定OD600值,每组3个重复,吸光值超过1时,使用双蒸水进行适当稀释。取适量发酵液于超净工作台用灭菌双蒸水梯度稀释至10-11;取稀释至10-9、10-10、10-11三个梯度的稀释液100 μL平板涂布于LB固体培养基,在30℃倒置培养48 h后计数。
1.3 数据统计与分析
试验数据用SPSS软件进行差异显著性分析,用Microsoft Excel软件和Origin 8.0软件作图并进行分析。
2 结果与分析
2.1 CQN-2菌株生长曲线
为了解试验菌株CQN-2生长的基本特征,采用OD600值测定菌株生长规律[24]。试验结果如图1所示,CQN-2菌株接种后迅速生长,随着培养时间的延长,菌体浓度迅速升高,培养至30 h后生长速度逐渐减缓,36 h以后菌体浓度基本稳定,此时测得菌株的浓度OD600值为18.80。
2.2 CQN-2菌株发酵条件优化
pH、接种量、装液量等发酵条件均会对微生物的生长产生较大的影响。本文对pH、接种量和装液量等发酵条件进行优化(图2)。结果显示,CQN-2菌株生物量随pH的升高呈现先升高后下降的趋势(图2A),当pH大于8.5时会抑制菌株的生长,而初始pH维持在5.5~8.0时均可获得较大的生物量,其中当pH为6.5时的菌株生物量最高,菌液OD600值为19.78。从图2B可以看出,当接种量为1%和3%时,CQN-2菌株的生物量均要高于接种量大于5%时的生物量。图2C可以看出,随着锥形瓶中装液量的提高,CQN-2菌体的生物量逐渐降低,表明该菌株为好氧型细菌,当装液量为25 mL/250 mL时,发酵液的OD600值为20.46,是装液量为100 mL/250 mL的3.28倍。
2.3 CQN-2菌株发酵培养基成分优化
2.3.1 碳源对CQN-2菌株生长的影响
试验结果(图3A)显示,以可溶性淀粉、糊精为碳源,CQN-2菌株的细胞生物量显著高于其他试验组,其36 h培养后的OD600值分别为20.03和19.35。本文以OD600值最高的可溶性淀粉作为碳源进行后续浓度优化试验,从图4A可以看出,随着可溶性淀粉浓度的提高,CQN-2菌体生物量也逐渐提高,当可溶性淀粉浓度提高至20 g/L后菌体浓度逐渐稳定,因此确定可溶性淀粉浓度为20 g/L为宜。
2.3.2 氮源对CQN-2菌株生长的影响
试验结果(图3B)显示,CQN-2菌株在有机氮源条件下的生物量显著高于无机氮源,说明有机氮源更有利于CQN-2菌株的生长。在有机氮源中,细菌学蛋白胨、酵母膏和鱼粉蛋白胨为氮源的CQN-2菌株生物量差异不显著,OD600值分别为17.88、17.42和17.80,其中细菌学蛋白胨的生物量最高,因此选用细菌学蛋白胨继续进行氮源浓度优化试验。结果显示(图4B),随着氮源浓度的增加,CQN-2菌株的生物量呈现先提高后降低的趋势,表明适宜的氮源浓度更有利于CQN-2菌株的生长,其中当细菌学蛋白胨浓度为60 g/L时,CQN-2菌体生物量最大,OD600值为21.20。
2.3.3 金属离子对CQN-2菌株生长的影响
试验结果(图3C)显示,添加Fe2+、Mn2+、Al3+三种金属离子的发酵液有助于CQN-2菌株生物量的提高,其中添加1 mmol/L水平的菌液OD600值分别为17.04、19.93和17.74,添加5 mmol/L水平的OD600值分别为16.59、19.84和16.32。因此在后续正交试验中选择Fe2+、Mn2+、Al3+三种离子。
2.3.4 糖蜜浓度对CQN-2菌株生长的影响
试验结果(图4C)显示,糖蜜作为一种添加剂对CQN-2菌株的生长具有明显促进作用,随着发酵液中糖蜜浓度的提高,CQN-2菌株的生物量也迅速增加,而后保持基本稳定。当糖蜜添加量为50 g/L时,CQN-2菌体的生物量最大,OD600值达到21.03。
2.4 正交试验优化
单因素筛选结果显示,装液量、初始pH、金属离子、糖蜜和氮源对CQN-2菌株的生长具有较大的影响,因此本文选择装液量、pH、Fe2+、Mn2+、Al3+、糖蜜和氮源等7个因素作为正交试验因素进行正交试验。结果(表2)显示,不同正交组合之间CQN-2菌株的生物量差异显著,进一步进行均值效益分析结果表明,最适装液量为15 mL/250 mL、最适初始pH为7.0、最适Mn2+浓度为5 mmol/L、最适Al3+浓度为1 mmol/L、最适糖蜜浓度为50 g/L、最适氮源浓度为30 g/L,不需要添加Fe2+。
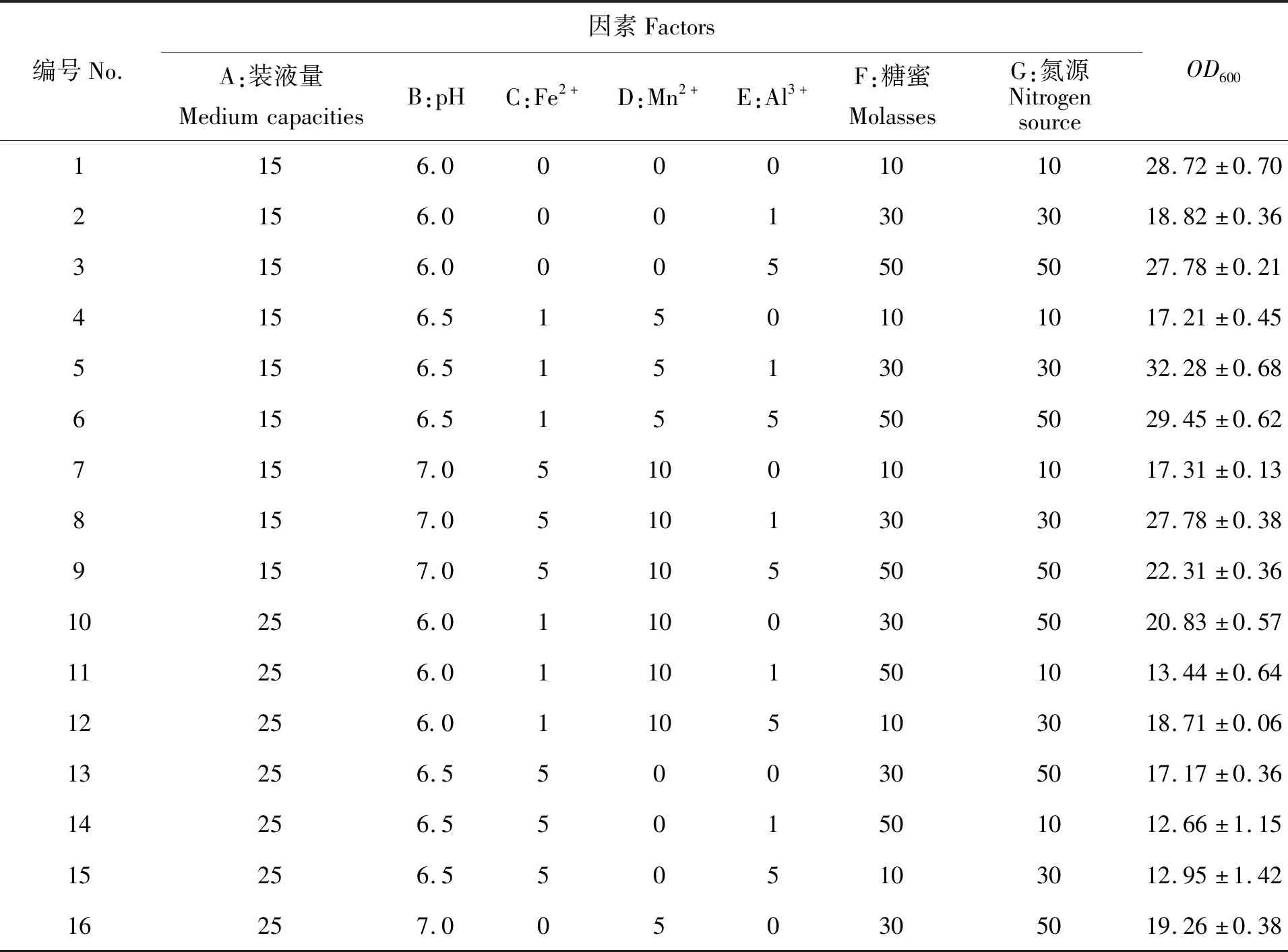
表2 不同正交试验组合对CQN-2生长的影响表

续表2
2.5 优化后发酵条件验证试验
将CQN-2菌株接种于优化后的培养基(可溶性淀粉20 g/L、细菌学蛋白胨30 g/L、糖蜜50 g/L、KH2PO40.5 g/L、MgSO40.5 g/L、NaCl 0.3 g/L、Mn2+5 mmol/L、Al3+1 mmol/L),在优化后的培养条件(初始pH 7.0,装液量15 mL/250 mL、接种量为3%)进行发酵,同时以优化前的培养基和培养条件为对照,绘制CQN-2菌株生长曲线(图5)。结果显示,在优化后的培养条件下,CQN-2菌株生长速度明显快于优化前,在培养至24 h时,优化前培养基中CQN-2生长开始进入稳定期,而优化后培养基中的CQN-2菌株仍在继续生长直至42 h后开始进入稳定期,此时二者的OD600值分别为21.33和39.00,优化后较优化前提高了82.84%。
2.6 上罐发酵后CQN-2菌株生长曲线
根据摇瓶优化培养基和培养条件的结果,在5 L罐上进行CQN-2发酵工艺的放大,其生长代谢曲线如图6所示。结果表明,在装液量3 L、温度30℃、转速600 r/min条件下,pH对CQN-2菌体生物量有重要影响,不控制pH试验组的CQN-2生长要优于控制pH试验组,从发酵开始随着时间推移,CQN-2菌体浓度就迅速增加,24 h后开始逐渐放缓,至36 h时CQN-2菌体OD600值达到72.45,而同期控制pH试验组的OD600值为63.54。取适量发酵液进行梯度稀释并平板涂布计数,得到不控pH试验组CQN-2菌株发酵36 h后的菌体浓度为3.03×1012CFU/mL。
3 结论与讨论
芽孢杆菌广泛存在于自然环境中,对人畜无害,不污染环境,又具有极好的抗菌活性和抗逆性,且繁殖能力强、便于工业化生产,因此近年来作为重要的生防菌种来源受到普遍关注。解淀粉芽孢杆菌是重要的生防菌和益生菌菌种[12-14],本研究以提高渔源解淀粉芽孢杆菌CQN-2菌体生物量为目标,通过单因素、正交试验优化CQN-2的发酵条件,结果显示,CQN-2菌株的最适碳源为可溶性淀粉,最适氮源为细菌学蛋白胨,经优化后的最佳培养基配方为可溶性淀粉20 g/L、细菌学蛋白胨30 g/L、糖蜜50 g/L、KH2PO40.5 g/L、MgSO40.5 g/L、NaCl 0.3 g/L、Mn2+5 mmol/L、Al3+1 mmol/L。权春善等[14]、汪晶晶等[17]、王勇等[18]、钱文静等[25]学者的研究结果均显示葡萄糖为解淀粉芽孢杆菌的最优碳源,而最优氮源包括牛肉膏、蛋白胨和酵母粉等。杨冬静等[26]指出解淀粉芽孢杆菌XZ-1的最佳碳源、氮源分别为糊精和蛋白胨。无机盐方面,KCl、MgCl2、CaCl2和FeSO4等均被筛选为最适培养基的组成成分[14,17,25-26]。可见,不同学者根据不同来源的解淀粉芽孢杆菌菌株进行发酵条件优化,但由于菌株本身特征存在一定差异,其最适的发酵培养基组成可能存在差异[26]。
此外,温度、pH、接种量、培养时间等都会影响到细菌发酵过程中的生物量[18]。菌体自身生长和产物的代谢都与温度密切相关,在适宜的温度下,微生物快速生长,而温度不适时会抑制细菌的正常生长,甚至杀灭菌体。此外,菌体自身体内的酶合成和能量代谢都受到温度的影响。发酵液pH可以通过影响菌体的细胞膜上电荷,以及培养液的离子化过程等影响微生物的生长[25]。本研究结果显示,CQN-2菌株的最佳发酵培养条件为初始pH值7.0、温度30℃,250 mL锥形瓶中装液量为15 mL、接种量为3%、发酵时间42 h。这与汪晶晶等[17]、王勇等[18]的研究结果类似,而与其他学者[25-26]得到的最适培养条件存在一定的差异。因此,根据自身的菌种和菌株类型,选择适合菌株本身生长的培养基成分和发酵条件,才能更有利于菌体生物量的增加。
本研究只是对CQN-2菌株的发酵培养基成分、培养条件进行优化,以及小试规模发酵条件的初步探究,今后还需要进行中试和规模化生产,将发酵工艺进一步完善,获得应用于工业化的发酵工艺,为其产业化生产提供依据。目前,解淀粉芽孢杆菌已被广泛应用于植物生防领域[27],可作为微生物肥料[28]、微生物种子处理剂、微生物杀菌剂和微生物保鲜剂[29]等;同时解淀粉芽孢杆菌作为益生菌在畜禽领域的应用也受到越来越多的关注[13,30]。此外,解淀粉芽孢杆菌也将作为新的益生菌添加剂被应用于水产领域,前景广阔。
