沉默PRMT5基因对人肝癌细胞生物学行为的影响
2020-08-20陈雪健孙振宇徐力善
周 健 陈雪健 王 伟 李 宁 孙振宇,2 徐力善
肝细胞肝癌(HCC)是肝癌中最常见的原发性恶性肿瘤,是全球癌症相关死亡的第三大主要原因[1-2]。数据统计显示,全世界每年有782 500新发肝癌病例和745 500死亡病例,仅中国就占病例总数和死亡总数的50%以上[3]。以目前的增长速度来看,HCC发病率有超过乳腺癌和结直肠癌发病率的趋势[4]。手术切除和肝移植是治疗HCC的有效方法[5]。但是,外科手术后的高复发率以及转移影响了HCC患者的预后[6-8]。由于对终末期HCC的治疗手段有限,因此,探究致癌基因在HCC发生发展过程中的作用机制显得格外重要,并为寻找新的治疗靶点提供理论依据。
在哺乳动物中,根据甲基化产物可将蛋白精氨酸甲基转移酶(PRMTs)分为Ⅰ、Ⅱ及Ⅲ三种类型,PRMT5属于其中的Ⅱ型,位于哺乳动物细胞质和细胞核中,是一种可以将甲基转移到组蛋白和一些非组蛋白精氨酸残基上的酶,催化精氨酸残基上蛋白质底物的对称二甲基精氨酸的形成,其活性在肿瘤细胞的发生发展过程中起到重要作用[9-13]。鉴于PRMT5的这种重要作用,因此它被认为是肝癌的潜在治疗靶点[11-12]。已有的研究表明PRMT5在多种类型的肿瘤中高表达,包括白血病、淋巴瘤、肺癌、胃癌、结直肠癌和乳腺癌等[14-16]。但是,PRMT5在肝癌发生发展过程中的作用机制尚未完全阐明。因此,本研究探讨PRMT5在肝癌细胞中的作用机制,为肝癌寻找新的治疗靶点。
1 材料与方法
1.1 试剂及抗体
DMEM培养液RPMI 1640培养液(美国Gibco公司)、胎牛血清(美国Hyclone公司)、预染标准分子量蛋白Mark(美国Thermo scientific公司)、Western blot及IP细胞裂解液(中国Beyotime公司)、PVDF膜(美国Millipore公司)、Lipofectamine 2000试剂(美国Thermo scientific公司)、凋亡检测试剂盒(美国BD公司)、抗体β-actin、PRMT5、P-AKT、AKT均购自美国CST公司。
1.2 细胞培养
人正常肝细胞LO2,人肝癌细胞Huh7和HepG2均购自黑龙江省分子医学生物工程研究中心。细胞用含有10%胎牛血清的DMEM或RPMI 1640培养基培养,细胞培养箱条件为5%CO2,37℃的恒温培养。细胞传代用0.25%胰蛋白酶消化,每2~3天传代1次。选用对数生长期细胞进行试验。
1.3 凋亡检测
取对数生长期的肝癌细胞系Huh7、HepG2,接种于6孔板中,再置于培养箱继续培养24 h,待细胞贴壁后于Huh7、HepG2细胞系加入siRNA将PRMT5敲减,用胰蛋白酶溶液消化细胞。继续培养24 h后用PBS洗涤2次,胰酶消化,离心收集细胞。PBS缓冲液重悬后1 000 r/min离心5 min,弃上清,重复2次。弃去PBS,细胞中分别加入5 μL Annexin Ⅴ-FITC及5 μL PI,暗室室温反应15 min。用流式细胞仪检测各组细胞的凋亡情况。实验重复3次。
1.4 蛋白质印迹分析
收集对数生长期的肝癌细胞,加入混有蛋白酶抑制剂的蛋白裂解液,置于冰上操作。裂解30 min后,将裂解液转移至1.5 mL的EP管中,放入4℃ 12 000 r/min离心机中离心5 min,取上清分装于0.5 mL离心管,-20℃保存。以BCA方法检测蛋白浓度。将蛋白样品加6×上样缓冲液,水浴锅沸水煮10 min。每孔30~50 μg蛋白的上样量行聚丙烯酰胺凝胶电泳,应用恒压80 V,代溴酚蓝进入分离胶后调整电压120 V继续电泳,至溴酚蓝电泳至分离胶底部,终止电泳。以4℃,300 mA的电流进行转膜,转膜时间依据分子量而定,将蛋白质转移至PVDF膜上。用5%的BSA封闭PVDF膜1 h,TBST洗涤后,加入抗体PRMT5、P-AKT、AKT、β-actin,一抗稀释浓度1∶1 000,在4℃冰箱中孵育过夜。第二天应用TBST清洗PVDF膜3次,二抗稀释浓度1∶2 000孵育1 h,PBST洗3次后上扫描仪BIO-RAD凝胶成像系统分析仪显影检测灰度值。实验重复3次。
1.5 siRNA干扰
通用生物公司设计PRMT5 siRNA,序列为:(siRNA1:CCAGAAGAGGAGAAGGAUAtt,UAUCCUUCUCCUCUUCUGGtt;siRNA2:GGAUAAAGCUGUAUGCUGUtt,ACAGCAUACAGCUUUAUCCtt;siRNA3:CCUCCAAGCUGUACAAUGAtt,UCAUUGUACAGCUUGGAGGtt)。实验分为5组,分别为对照组、空白载体组、siRNA1、siRNA2、siRNA3。常规培养肝癌细胞,按3×105/孔的细胞量接种于6孔板中。在6孔板中加入2 mL含10%胎牛血清的培养液,当细胞长至60%~70%时,更换无双抗的Opti-MEM 1 mL,并配置转染溶液。A:10 μL PRMT5 siRNA加入到Opti-MEM 250 μL中,轻轻混匀,室温放置5 min。B:将4 μL Lipofectamine 2000脂质体加入到Opti-MEM 200 μL中,轻轻混合均匀。将上述A、B溶液混匀,在室温下静置30 min,形成siRNA-Lipofectamine复合物,将复合物逐滴加入6孔板内,6 h后更换完全培养基,然后将细胞于37℃,5% CO2的细胞孵箱中孵育48 h,收集细胞进行检测。实验重复3次。
1.6 统计学分析
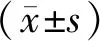
2 结果
2.1 PRMT5在肝癌细胞系中的表达
与正常肝LO2细胞系相比,PRMT5在肝癌HepG2和Huh7细胞系中高表达(图1A),量化结果显示(图1B),与正常肝LO2细胞系相比,PRMT5在肝癌细胞系HepG2和Huh7中高表达(P<0.05)。
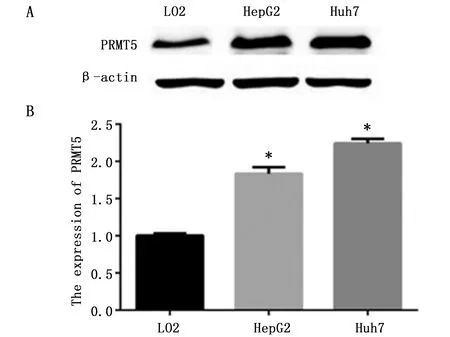
图1 PRMT5的表达水平Figure 1 The expression of PRMT5 protein in LO2,HepG2 and Huh7 cellsNote:A.The expression of PRMT5 protein in LO2,HepG2 and Huh7 cells;B.The gray histogram of PRMT5 protein band.*P<0.05,when compared with the LO2 cells.
2.2 抑制PRMT5的表达对肝癌细胞凋亡的影响
为了确定PRMT5在HCC细胞系增殖中的作用,我们使用了siRNA技术将HCC细胞系(HepG2和Huh7)中的PRMT5敲减,siRNA1(P<0.05)、siRNA2(P<0.05)、siRNA3(P<0.01)均不同程度的抑制了PRMT5的表达(图2),选择效果最佳的siRNA3进行进一步实验。应用siRNA3敲减PRMT5表达后,应用流式细胞技术检测凋亡,在两种细胞系中,沉默PRMT5的表达均会促进肝癌细胞凋亡(图3)。
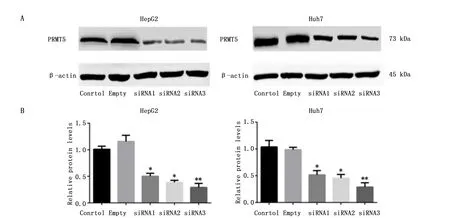
图2 敲减PRMT5后蛋白表达量Figure 2 The expression of PRMT5 protein in HepG2 and Huh7 cells after knocked down PRMT5 geneNote:A.The expression of PRMT5 protein in HepG2 and Huh7 cells after knocked down PRMT5 gene;B.The figure of quantification of protein relative expression.*P<0.05,**P<0.01,when compared with the control group.
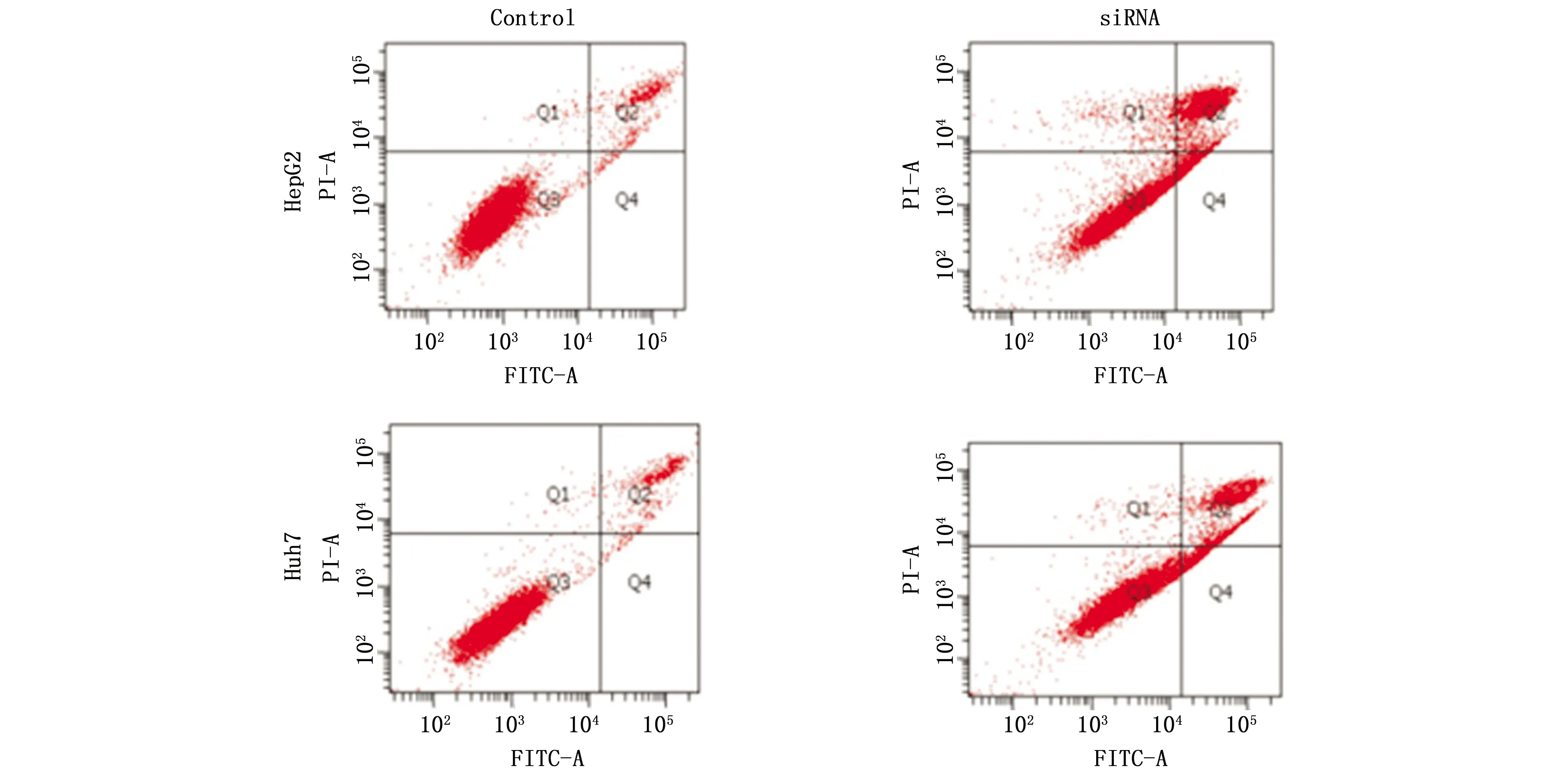
图3 敲减PRMT5后HepG2及Huh7细胞凋亡情况Figure 3 Apoptosis of HepG2 and Huh7 cells was detected after knocked down PRMT5 gene
2.3 PRMT5对AKT通路的影响
我们应用siRNA技术将HCC细胞系(HepG2和Huh7)中PRMT5基因敲减,应用Western blot检测PRMT5、P-AKT(Ser473)、AKT蛋白的表达水平。在两种细胞系当中,敲减PRMT5后可以使HepG2细胞P-AKT表达下降(P<0.01),Huh7细胞P-AKT表达也下降(P<0.05),而总AKT蛋白水平无明显变化(图4)。这些实验结果表明,PRMT5可以影响AKT通路从而影响肝癌细胞增殖能力。
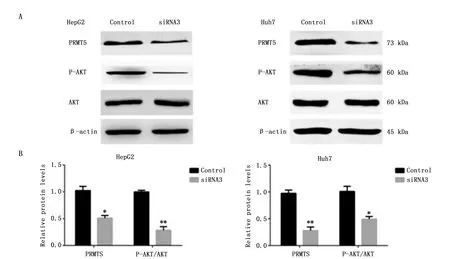
图4 敲减PRMT5基因后P-AKT变化Figure 4 The expression of P-AKT protein in HepG2 and Huh7 cells after knocked down PRMT5 geneNote:A.The expression of PRMT5,P-AKT and AKT proteins in HepG2 and Huh7 cell line after knocked down PRMT5 gene;B.The relative expression of protein bands.*P<0.05,**P<0.01 when compared with the control group.
3 讨论
研究表明抑制PRMT5的表达可以促进不同类型肿瘤细胞凋亡[17-19]。其他研究表明PRMT5在多种不同类型的癌症中异常表达,是参与多种肿瘤发生发展过程的重要基因[12,14,20-22]。然而,PRMT5在肝癌发病机制中的作用以及与肝癌临床病理因素之间的关系尚未完全阐明。PRMT5是II型精氨酸甲基转移酶,可催化精氨酸残基上蛋白质底物的对称二甲基化。近年来,越来越多的证据表明PRMT5通过不同的信号传导通路参与多种生物学过程,在染色质重建、蛋白质修饰、细胞周期进程、细胞侵袭、细胞代谢等方面起到重要作用[23]。其他研究结果表明PRMT5在肺癌、乳腺癌、淋巴瘤、前列腺癌、神经胶质瘤、胃癌中高表达[14,21,24-27]。我们的实验结果证实,PRMT5在肝癌HepG2及Huh7细胞中高表达,这与先前的结论是一致的。Kanda等[28]实验证实,敲减PRMT5能够明显降低胃癌细胞的增殖、侵袭和迁移能力。我们的实验结果证实,通过应用siRNA技术将PRMT5敲减后可以显著促进HCC细胞凋亡。这些实验结果表明PRMT5在肿瘤的增殖、凋亡过程中扮演着重要角色。
AKT是PRMT5/AKT信号通路中的关键信号分子,又称蛋白激酶B,调控细胞周期、细胞存活、细胞代谢。AKT的功能异常与癌症、II型糖尿病、心血管疾病等疾病密切相关[23]。研究表明PRMT5通过诱导上游正向调节因子磷脂酰肌醇3激酶(Phosphatidylinositol 3 kinase,PI3K)的过度磷酸化和负向调节因子PTEN的过度磷酸化来激活AKT[23]。Zhang等[23]实验检测到人类肺癌组织中PRMT5的过表达,而邻近肺组织中PRMT5的表达水平非常低。应用shRNA下调PRMT5或通过特异性抑制剂阻断PRMT5活性可显著阻止肺癌A549和H1299细胞的增殖。并且实验表明PRMT5与AKT相互作用,PRMT5调节了肺癌A549和H1299细胞中的AKT激酶活性。实验结果表明PRMT5通过与AKT相互作用调节人肺癌细胞增殖。Zhu等[29]表明PRMT5表达的增加可能会激活WNT/β-catenin信号通路从而促进肝癌转移。PRMT5和β-catenin可以竞争性结合MTDH(Metadherin)上的相同结构域。我们的实验结果证实应用siRNA技术将PRMT5敲减后可以使P-AKT表达量下降,从而激活AKT通路,活化的AKT可以通过激活该通路下游诸多靶蛋白,进而调控肿瘤的发生发展,从而影响肝癌细胞的活性。我们在后续工作中将进一步探究PRMT5在肝癌发生发展过程中的作用机制。
综上所述,PRMT5可能通过调控HCC中AKT通路从而促进肝癌细胞凋亡。因此,PRMT5可能是肝癌的潜在生物标志物和治疗靶点。
