长链非编码RNA PSMA3-AS1在人胶质瘤细胞中的表达及作用研究
2020-08-20张遥范丹
张 遥 范 丹
胶质母细胞瘤是中枢神经系统最常见、恶性程度最高的原发性肿瘤,调查发现在成人原发性脑肿瘤中约占70%,其中位生存期约9~12个月[1]。胶质瘤具有高度侵袭性,与周围脑组织无明显边界,手术无法全切,放化疗效果较差。因此,寻找胶质瘤的致病相关基因变得十分迫切[2-3]。长链非编码RNA(lncRNA)是一类长度大于200个核苷酸的非编码RNA,由于缺少开放性阅读框,无法编码蛋白质。lncRNA可以在转录后或表观遗传等多个水平发挥重要作用[4-5]。PSMA3-AS1位于14q23.1染色体上,既往研究表明食管癌中高表达PSMA3-AS1的患者预后较差,提示PSMA3-AS1可能与肿瘤的发生发展密切相关[6],但目前PSMA3-AS1在胶质瘤中的功能国内外尚无报道。本研究应用PSMA3-AS1的siRNA转染胶质瘤细胞,研究PSMA3-AS1在胶质瘤中的表达水平,进而探讨其生物学作用,为胶质瘤的发病机制及临床治疗提供理论依据。
1 材料与方法
1.1 临床资料
收集哈尔滨医科大学附属第二医院神经外科于2010年1月—2016年1月行手术切除,并经病理证实的胶质瘤母细胞瘤组织35例,同时选取相应癌旁组织35例做对照。依据PSMA3-AS1表达水平的中位数,将组织分为高表达组和低表达组。纳入标准:所有患者均为首次诊断胶质瘤;首次进行手术治疗;术前未接收放疗、化疗等其他治疗;所有入组的研究对象均签署知情同意书。所有组织标本均在离体后 30 min内放入液氮中迅速冷冻备用。
1.2 细胞及试剂
人脑星形胶质细胞系HA购自美国模式培养物集存库(American type culture collection,ATCC),人胶质瘤细胞系U251、LN229、T98和A172购自中科院上海细胞生物学研究所。链霉素、青霉素(北京Beyotime生物公司,中国);小牛血清、DMEM高糖培养基(Hyclone,美国);PSMA3-AS1的siRNA(上海吉玛公司,中国);MTT细胞增殖检测试剂盒(北京Beyotime生物公司,中国);总RNA抽提试剂盒使用(Invitrogen公司,美国);逆转录反应试剂盒、实时荧光定量PCR试剂盒(TAKARA公司,日本);Lipofectamine 2000转染试剂,引物设计(Invitrogen公司,美国);兔抗人MMP-2/9多克隆抗体,鼠抗人GAPDH单克隆抗体(武汉Protein-tech公司,中国);辣根过氧化物酶(HRP)标记的山羊抗兔/鼠二抗(北京中杉金桥公司,中国)。
1.3 TCGA数据分析
从TCGA数据库下载PSMA3-AS1表达谱数据(https://tcga-data.nci.nih.gov/)。检测PSMA3-AS1在所有lncRNA中的表达水平和生存期信息,保留Fold Change值>2且P<0.01的排名前20的相关基因进行分析,计算PSMA3-AS1的表达与MMP2/9基因间的Pearson相关性,使用GO注释分析(https://david.ncifcrf.gov/)研究PSMA3-AS1相关生物学功能。
1.4 细胞培养
胶质瘤细胞系U251、LN229、T98、A172U和星型胶质细胞使用体积分数10%胎牛血清的DMEM高糖培养基,在95%湿度、37℃、5% CO2培养箱内,培养细胞呈单层生长,实验采用对数生长期细胞。实验分为空白对照组(Negative Control,si-NC组)和敲低PSMA3-AS1组(si-PSMA3-AS1组)。
1.3 细胞转染
构建PSMA3-AS1的siRNA和Negative Control(si-NC),转染胶质瘤细胞敲低PSMA3-AS1表达。使用Lipofectamine 2000转染试剂,按照说明书进行si-PSMA3-AS1和si-NC的转染。实验分组(si-PSMA3-AS1组),Negative Control组(si-NC组)。Si-PSMA3-AS1序列F:5′-CCAGCAUCAAGAUGAUUUATT-3′;R:5′-UAAAUCAUCUUGAUGCUGGTT-3′。Si-NC序列F:5′-UUCUCCGAACGU GUCACGUTT-3′;R:5′-ACGUGACACGUUCGGAGAATT-3′。
1.4 qRT-PCR实验
收集50 mg冰冻组织及胶质瘤细胞,使用TRIzol法从组织和细胞中提取总RNA,对RNA进行纯化后,测定总RNA浓度。样品在37℃、15 min;85℃、5 s条件下反转录合成cDNA,使用SYBR Green PCR Kit(TAKARA)在ABI 7300 RT-PCR仪上进行检测。在95℃ 30 s 1个循环;95℃ 5 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 30 s的条件下,进行实时定量PCR扩增反应。使用GAPDH作为内参,结果用相对表达量表示。PSMA3-AS1 F:5′-GAACAGAAACCAGAGCCA TA-3′;R:5′-CTGTTACTAGTTTGCGGCATC-3′;GAPDH F:5′-AAGGTGAAGG TCGGAGTCAA-3′;R:5′-GGAAGATGGTGATGGGATTT-3′。使用2-△△Ct法计算相对表达量。
1.5 Western blot检测
收集转染48 h后各实验组细胞,使用BCA法测定转染的胶质瘤细胞总蛋白浓度,取上清分装至于-80℃冰箱备用;随后进行SDS-PAGE电泳分离含有目标蛋白的样品,并原位湿转至PVDF膜,BSA封闭液室温封闭1 h后,分别使用一抗(MMP-2/9,1∶500;GAPDH,1∶1 000)在4℃孵育过夜。在HRP标记的二抗(1∶1 000)中室温孵育1 h;以ECL法显影,GAPDH作为内参分析结果。
1.6 细胞增殖实验
取对数生长期的细胞分别以2×103个/孔接种于96孔板中,培养达到60%融合度时进行转染,分别于24 h、48 h、72 h进行MTT法检测,每孔培养基体积200 μL,加入20 μL(5 mg/mL)MTT溶液,继续培养4 h后,终止培养,弃掉上清液,每孔加入150 μL DMSO,水平摇床振摇10 min,使用酶标仪于490 nm波长处测定吸光光度值。
1.7 细胞侵袭实验
使用胰酶消化细胞,以无血清DMEM培养基调整细胞悬液密度为5×105个/mL,Transwell上室中加入200 μL细胞悬液,下室中加入500 μL 20%胎牛血清DMEM培养基。放入孵箱培养24 h后取出Transwell小室,使用PBS轻轻冲洗后,用棉签擦去小室上层细胞;将小室放入甲醇溶液中,室温固定20 min,结晶紫染液中5 min,蒸馏水冲洗2次。将小室放置在倒置显微镜下进行拍照及细胞计数(放大倍数,100×)。每个样本选取5个视野计数。
1.8 统计分析
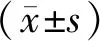
2 结果
2.1 lncRNA PSMA3-AS1在胶质瘤中表达情况
通过对TCGA数据库(n=162)进行分析,结果表明在胶质瘤组织中,PSMA3-AS1的表达较正常组织升高,且在检测到的差异表达水平排名前20位的lncRNA中评分最高,故选为候选lncRNA(图1A),高表达PSMA3-AS1的患者与胶质瘤患者较短的总体生存期有关(χ2=7.985,P=0.042)(图1B)。随后通过对35例配对胶质瘤样本进行qRT-PCR验证,发现PSMA3-AS1在胶质瘤组织中的相对表达量显著升高(t=23.30,P<0.001)(图1C)。在多个胶质瘤细胞系中,PSMA3-AS1的表达较人脑星型胶质细胞NHA明显升高,且在U251和T98G细胞系中表达最高,故选择U251和T98G细胞系进行后续实验(P<0.05)(图1D)。GO功能富集分析提示PSMA3-AS1可能与胶质瘤的侵袭能力密切相关(图1E)。实验结果提示PSMA3-AS1可能在胶质瘤的发展中扮演重要角色。
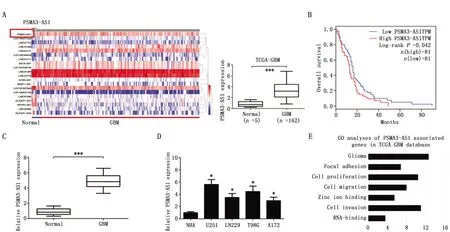
图1 lncRNA PSMA3-AS1在胶质瘤中表达情况Figure 1 Expression of PSMA3-AS1 in glioma tissues and adjacent normal tissuesNote:A.Hierarchical clustering of differentially expressed genes in glioma tissue relative to normal tissues;B.The high expression of PSMA3-AS1 was correlated with a worse overall prognosis in patients with glioma(TCGA);C.GO analysis was performed using the PSMA3-AS1 positive-associated genes in TCGA dataset;D.The expression of PSMA3-AS1 in 35 paired glioma tissues and adjacent normal tissues;E.The expression of PSMA3-AS1 in different glioma cell lines.(*P<0.05,***P<0.001,vs. Normal tissue or NHA cell)
2.2 胶质瘤中PSMA3-AS1的敲降效率
在U251、T98G细胞中转染siRNA后24 h进行qRT-PCR检测,与si-NC组相比,转染细胞中PSMA3-AS1的表达水平从48 h开始出现明显降低(P<0.05),提示转染成功(图2A)。
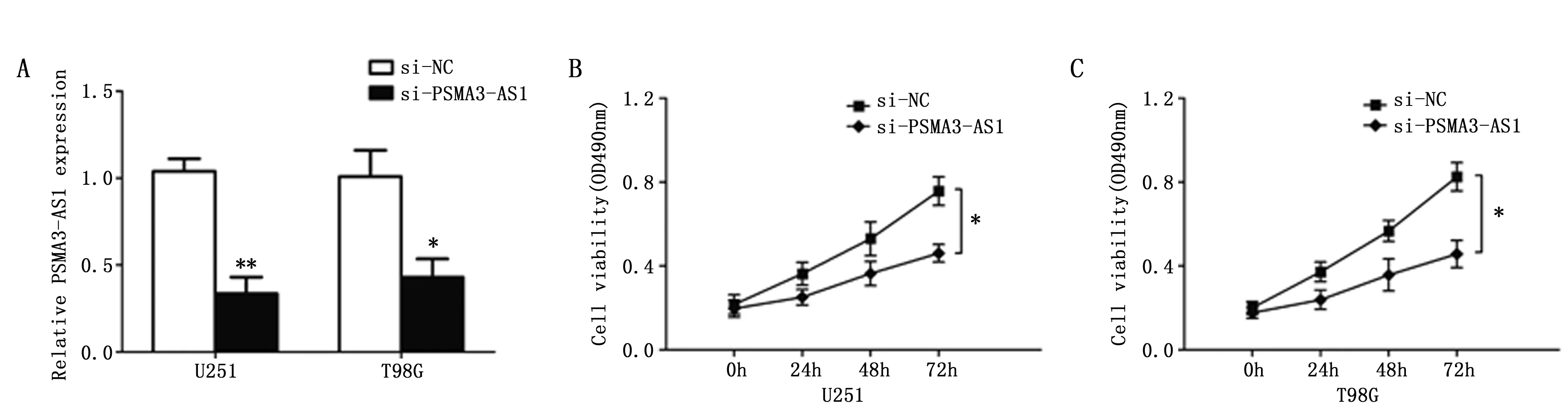
图2 PSMA3-AS1对胶质瘤细胞增殖的影响Figure 2 PSMA3-AS1 promoted cell proliferation in glioma cellsNote:A.PSMA3-AS1 expression was efficiently knocked down by siRNAs in U251 and T98G cells as detected by qRT-PCR assay;B-C.The MTT assay showed that the knockdown PSMA3-AS1 could inhibit the proliferation of glioma cells.Each assay was performed in triplicate.(*P<0.05,**P<0.01,vs. si-NC)
2.3 PSMA3-AS1的表达与临床病理特征之间的关系
通过对35例胶质瘤患者PSMA3-AS1的表达情况与临床病理特征进行分析发现,PSMA3-AS1的表达与患者的肿瘤直径(P=0.007)有关(表1)。
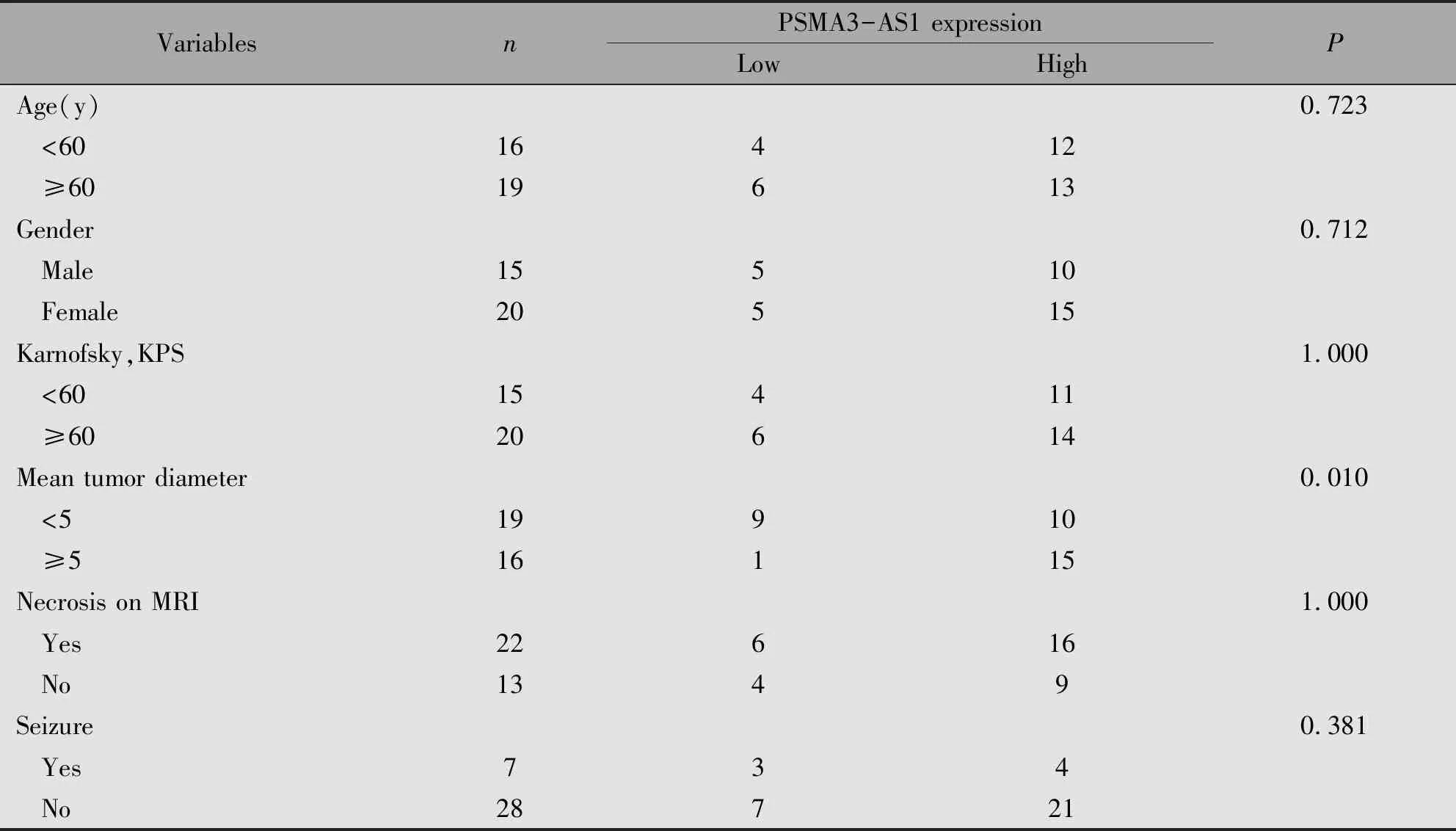
表1 胶质瘤患者组织中PSMA3-AS1与临床病理因素的关系(n=35)
2.4 PSMA3-AS1对胶质瘤细胞增殖的影响
U251和T98G细胞转染si-PSMA3-AS1和si-NC后,使用MTT实验检测细胞增殖能力。结果显示,敲低PSMA3-AS1表达后,细胞的增殖能力从48 h出现明显降低(P<0.05)(图2B,2C)。
2.5 PSMA3-AS1对胶质瘤细胞侵袭能力的影响
敲低PSMA3-AS1后,Transwell实验提示U251和T98G细胞侵袭能力较si-NC组明显降低,差异有统计学意义(P<0.01)(图3A)。通过对TCGA数据库(n=162)进行分析,结果表明,在胶质瘤组织中,PSMA3-AS1与肿瘤侵袭标志物MMP2/9呈正相关(图3B,3C)(r=0.37,P=0.00024;r=0.26,P=0.00034)。
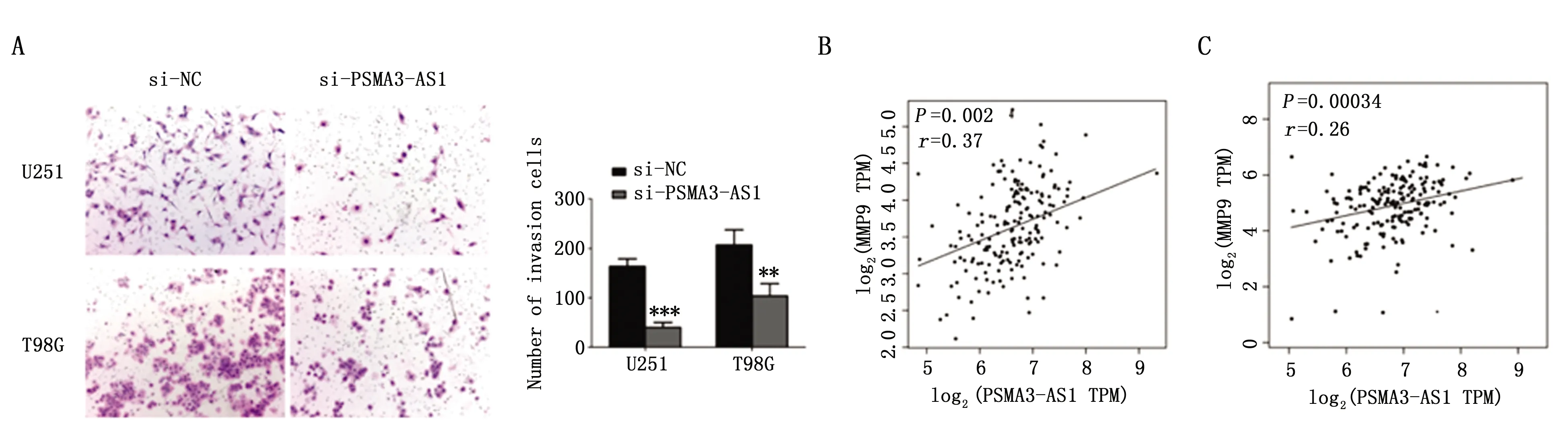
图3 PSMA3-AS1对胶质瘤细胞侵袭的影响Figure 3 PSMA3-AS1 promoted cell invasion in glioma cellsNote:A.Knockdown PSMA3-AS1 decreased the invasion ability of glioma cells;B-C.The correlation analysis was performed between PSMA3-AS1 expression with the expression of MMP2/9 in GBM samples from TCGA dataset(**P<0.01,***P<0.001,vs. si-NC).
Western blot实验显示在胶质瘤中敲低PSMA3-AS1后,MMP2和MMP9的表达水平明显降低(P<0.05),以上结果提示敲低PSMA3-AS1表达后,可以通过下调MMP2和MMP9的表达,发挥抑制胶质瘤细胞侵袭的能力(图4)。
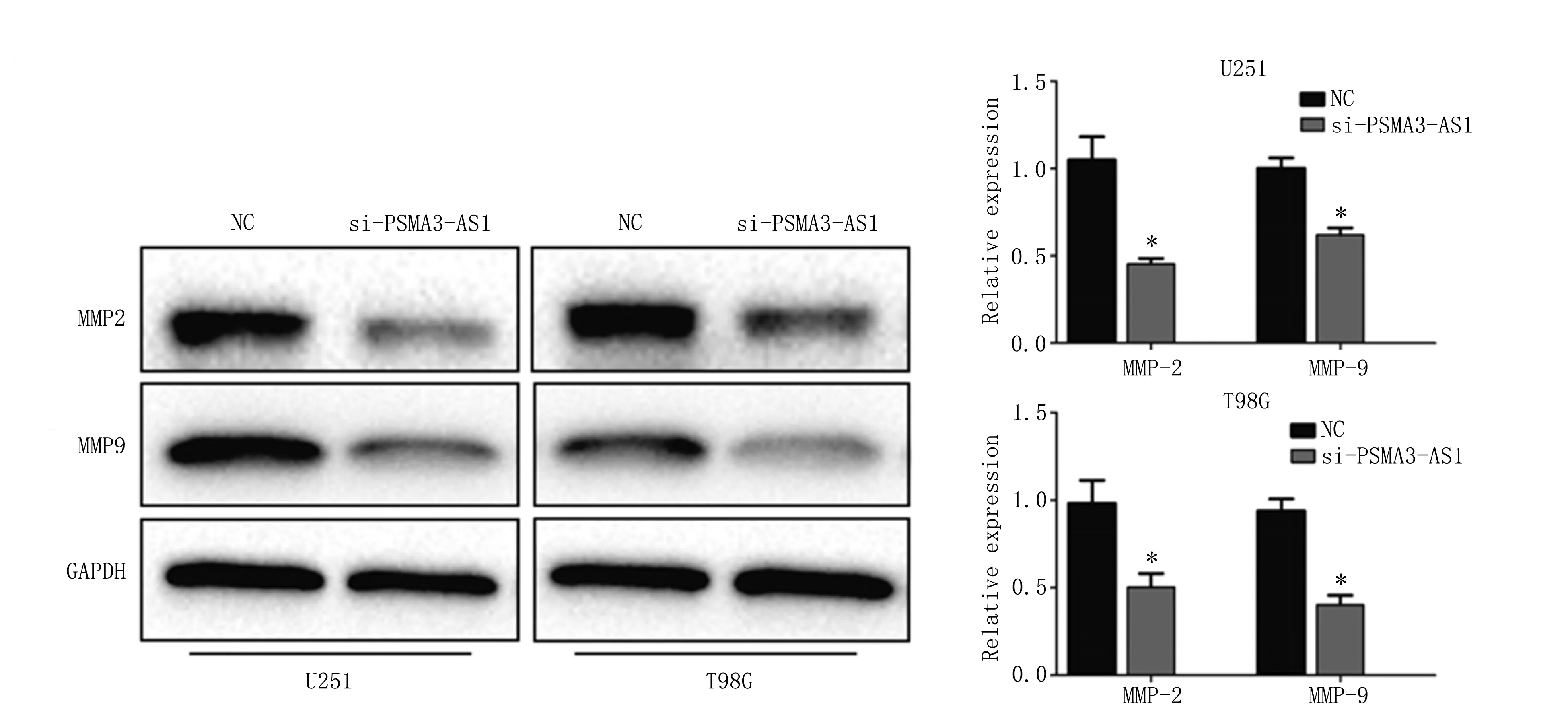
图4 PSMA3-AS1对侵袭相关蛋白的影响作用Figure 4 The effects of PSMA3-AS1 on invasion related proteins in glioma cellsNote:The expression of MMP2/MMP9 ratio was examined in U251 and T98G cells by Western blot(*P<0.05,vs. si-NC).
3 讨论
胶质瘤母细胞瘤是成人最常见、侵袭性最高的颅内恶性肿瘤,肿瘤发展迅速,具有边界不明确,预后较差等特点[7]。近年来,虽然胶质瘤的诊疗手段不断进步,但胶质瘤患者的中位生存期仍然较低。因此,研究胶质瘤形成的潜在原因和发病机制,对于发现胶质瘤靶向治疗新途径,改善临床治疗效果具有重要意义。
本研究通过TCGA数据库结合qRT-PCR实验证实胶质瘤组织和细胞系中PSMA3-AS1表达上调,推测PSMA3-AS1在胶质瘤中可以发挥促癌基因的作用。进一步通过转染siRNA,敲低PSMA3-AS1在U251和T98G细胞中的表达水平,通过细胞增殖和侵袭实验,发现敲低PSMA3-AS1表达后,胶质瘤的增殖和侵袭能力明显受到抑制。因此在胶质瘤中PSMA3-AS1的高表达可能发挥促癌作用。
既往研究证实lncRNA不仅参与转录激活、染色体沉默及周围蛋白编码基因的表达调控,还在多种疾病的发生发展中扮演了重要的角色[8-9]。胶质瘤中lncRNA TUG1呈低表达,可以通过抑制Bcl-2表达促进胶质瘤凋亡,发挥抑癌作用[10]。lncRNA UCA1通过“分子海绵”吸附作用调节miR-182表达,进而调控胶质瘤细胞的增殖和迁移能力[11]。Lu等[12]发现敲低lncRNA HULC可以通过PI3K/Akt信号通路发挥抑制白血病细胞增殖能力的作用。范宁宁等[13]发现lncRNA MEG3在胶质瘤中呈低表达,过表达MEG3可以通过抑制miR-21降低胶质瘤细胞的活力并促进其凋亡。目前PSMA3-AS1在肿瘤中的研究较少,研究显示食管癌中高表达的PSMA3-AS1可以通过miR-101/EZH2途径,调控食管癌的恶性生物学行为[6]。而外泌体中的PSMA3-AS1在多发性骨髓瘤的蛋白酶抑制剂化疗耐药过程中发挥重要作用,可以作为预测治疗反应的标志物[14]。
lncRNA的功能主要根据其在细胞内特定的分布区域,在细胞质或细胞核中通过各自的序列特殊性结合mRNA、miRNA及相关功能蛋白发挥功能,包括DNA甲基化;对mRNA稳定性的维持;通过“分子海绵”吸附miRNA;以及通过结合转录蛋白发挥转录调控的功能[15-16]。研究lncRNA具有调控多个miRNA表达的能力,而miRNA存在多个下游靶基因,说明lncRNA可能通过信号通路网络,协同促进胶质瘤细胞的侵袭迁移[17-18]。MMP2/9是肿瘤侵袭表型相关标志物,因此本文推测PSMA3-AS1可能作为ceRNA结合miRNAs,发挥调节MMP2/9表达的作用,进而调控胶质瘤的侵袭行为。
综上所述,本研究证实lncRNA PSMA3-AS1在胶质瘤中具有促癌作用,且与患者恶性预后呈正相关。进一步探讨及阐明PSMA3-AS1在胶质瘤的发生发展中的作用及相关分子机制,可以为lncRNA在胶质瘤的早期诊断和靶向治疗提供新的理论依据。
