PD-L1与MTA1在口腔鳞癌中的表达与临床意义
2020-08-20张连齐李吉辰朴松林赛音乌力吉元冬梅沈禹辰
张连齐 李吉辰 朴松林 赛音乌力吉 元冬梅 沈禹辰
口腔鳞癌(Oral squamous cell carcinoma,OSCC)约占口腔癌的90%,主要为舌鳞癌、口底鳞癌、牙龈鳞癌,发病率逐年升高,全球每年新增发病人数约20万,其中死亡高达17万例之多[1],手术治疗及放化疗效果有限,5年生存率仅在40%~50%,主要原因是癌症的转移及复发[2]。免疫治疗逐步被人们认知,在多种肿瘤的诊治中效果显著[3]。程序性死亡配体1(Programmed death-Ligand1,PD-L1)属于免疫球蛋白超家族中一员,在多种癌症如乳腺癌等中可明显的观察到PD-L1的异常表达[4-5]。PD-L1参与上皮间充质转化(Epithelial mesenchymal transformation,EMT)、肿瘤细胞在体内的侵袭、增殖及逃逸进程[6-8]。转移相关基因1(Metastasis associated gene1,MTA1)属肿瘤转移相关基因家族,可参与细胞正常的生理功能[9],也可调控卵巢癌等多种肿瘤的表达[10-11]。同时,MTA1间接调控EMT的作用与PD-L1相近[12]。本研究旨在研究口腔鳞癌中PD-L1与MTA1的表达的相互关系,并结合实验数据分析,为口腔鳞癌的基础研究及诊治开辟新途径、寻找新方向、实现新突破。
1 材料与方法
1.1 材料
本研究所应用的实验病理切片取自于哈尔滨医科大学附属第一医院病理科2009年—2019年间保存完好的45例口腔鳞癌患者手术石蜡组织标本,20例口腔正常粘膜组织取材于哈尔滨医科大学附属口腔医院口腔颌面外科一病房手术患者,所有取材患者均自愿为本次实验提供标本,取材后进行石蜡包埋已备后续应用。所有蜡块标本的具体病例资料于医院系统内保存完整并可进行查阅。患者年龄35~75岁,平均55±7.65岁,男性患者26例,女性患者19例,高中分化患者29例,中低分化患者16例,其中以舌鳞癌、牙龈鳞癌及口底鳞癌为主。根据保存的病例资料对患者的个人其他信息进行仔细查阅,样本内患者都未参与手术治疗及放化疗等相关治疗。国际抗癌联盟(UICC)2010版为本实验参考指南。
1.2 主要试剂及主要仪器
1.2.1 试剂 兔抗人PD-L1多克隆抗体、兔抗人MTA1多克隆抗体购自北京博奥森生物有限公司;SP法免疫组化试剂盒(KIT-900)及DAB底物试剂盒(DAB-0031)购自福州迈新生物技术有限公司,PBS缓冲液自制。
1.2.2 仪器 石蜡切片机(CUT 6062)购自德国SLEE公司;光学显微镜(CH20)购自日本Olympus公司;移液枪购自美国Thermo公司;医用微波炉(M3-L238E)、电烤箱(T4-L326F)及电冰箱(BCD-432WGPZ)均购自中国Midea。
1.3 HE及免疫组化实验方法
(1)将所有石蜡标本以5 μm连续切片;(2)HE染色:切片并酒精复水,蒸馏水冲洗后苏木素染色及自来水依次冲洗5 min后进行返蓝,15 min后蒸馏水冲洗后滴加伊红染液染色3 min,冲洗后镜下观察;(3)SP免疫组化:烤箱68℃烤片,脱蜡并梯度酒精水化,3%双氧水室温孵育10 min,PBS冲洗2 min,连续三次后行微波抗原修复,PBS冲洗2 min,4℃下,滴加兔抗人PD-L1一抗(1∶100)及兔抗人MTA1一抗(1∶100),孵育过夜,取出降至室温,PBS冲洗2 min,重复三次,37℃下,加入二抗IgG(1∶200)孵育30 min,PBS冲洗2 min,三次后采用DAB显色5 min,脱水、通明、封片。
1.4 免疫组化结果判定
口腔鳞癌组织中,抗原阳性表达的PD-L1细胞被染成棕黄色,主要定位于细胞的胞膜、胞质;抗原阳性表达的MTA1细胞亦被染成棕黄色,主要定位于细胞的胞核,偶有在胞浆。实施双盲法随机取5个不重叠视野于400倍镜下观察,共计200个细胞阳性细胞数。以阳性细胞率及染色强度行半定量评分,阳性细胞率以≤10%、10%~50%、50%~80%、>80%分别记为0、1、2、3分;按呈现的具体染色程度加以评分,标准如下:无染色、浅黄色、棕黄色、棕褐色分别记0、1、2、3分;结果以二者相乘之积做最终判定:<3分计为阴性(-),≥3分计为阳性(+)[13]。
1.5 统计学方法
应用SAS 9.4统计软件完成数据处理,率的比较采用卡方检验和连续性校正卡方检验,口腔鳞癌组织中PD-L1与MTA1表达的关联性分析应用卡方检验计算φ系数,P<0.05为差异具有统计学意义。
2 结果
2.1 口腔鳞癌组织中PD-L1与MTA1表达比较
口腔鳞癌组织中,阳性表达的PD-L1主要在细胞膜和细胞质,阳性表达的MTA1主要在细胞核,少量存在于细胞浆,癌细胞均被染成棕褐色。PD-L1在口腔鳞癌组织及正常口腔粘膜组织中的阳性表达率分别为75.56%和15.00%,MTA1在口腔鳞癌组织及正常口腔粘膜组织中的阳性表达率分别为66.67%和10.00%,两种蛋白在口腔鳞癌及正常口腔粘膜组织中的表达差异具有统计学意义(P<0.05)(图1)。
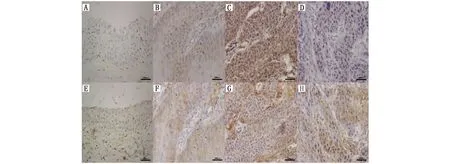
图1 PD-L1与MTA1在正常口腔粘膜组织及口腔鳞癌组织中的表达分布情况(200倍)Figure 1 The expression of PD-L1 and MTA1 in oral squamous cell carcinoma and normal oral mucosa tissues(200×)Note:A.The expression of PD-L1 in normal oral mucosa tissues;B-D.The expression of PD-L1 in well,moderate and poor differentiated oral squamous cell carcinoma tissues;E.The expression of MTA1 in normal oral mucosa tissues;F-H.The expression of MTA1 expression in well,moderate and poor differentiated oral squamous cell carcinoma tissues.The magnification is 200.
2.2 口腔鳞癌组织中PD-L1及MTA1的表达与患者临床病理特征的关系
结果显示,PD-L1与MTA1的表达与口腔鳞癌的TNM分期有关(P<0.05),而与患者的性别、年龄、吸烟史、肿瘤的体积及组织分化程度无关(P>0.05)(表1)。
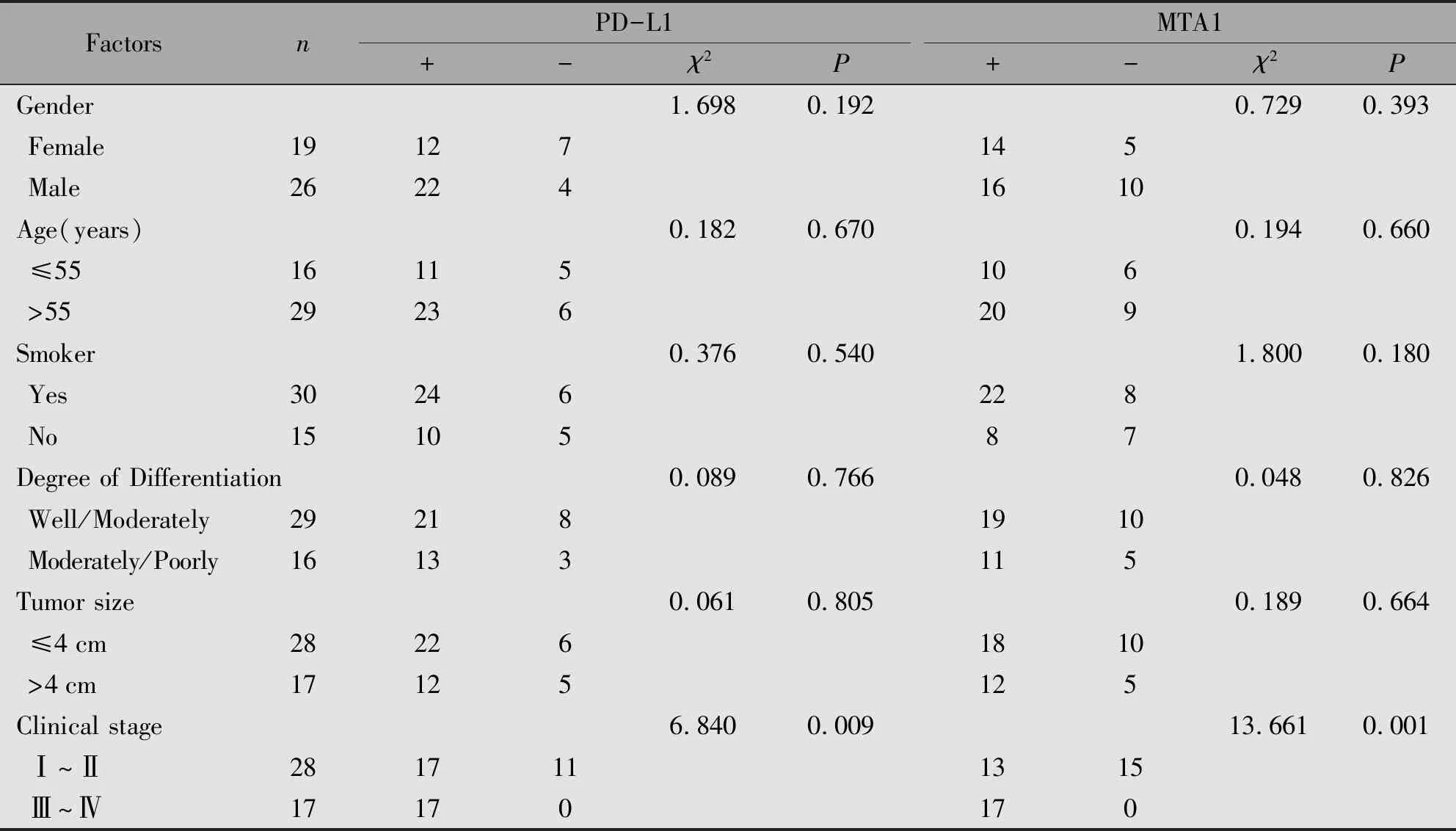
表1 PD-L1与MTA1的表达与口腔鳞癌临床病理参数的关系
2.3 PD-L1和MTA1表达的关联性分析
总样本内,有34例阳性表达的PD-L1蛋白(MTA1阳性26例,阴性8例);阴性表达的PD-L1蛋白占11例(MTA1阳性4例,阴性7例)。二者表达存在关联性(φ=0.366,P=0.037)(表2)。
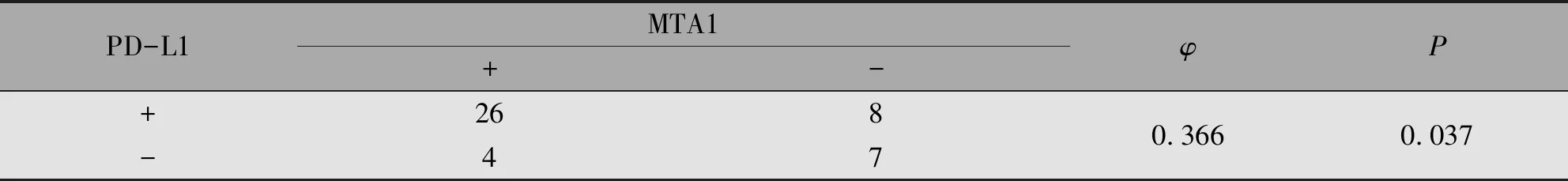
表2 口腔鳞癌组织中PD-L1和MTA1表达的关联性
3 讨论
近年来由于肿瘤细胞学和分子生物学的进展,肿瘤微环境逐渐进入人们研究的视野,在机体的免疫机制中作用突出,同时肿瘤免疫逃逸在学者中的的重要研究地位也愈发重要,免疫靶向治疗药物的作用也是有目共睹。PD-L1属一类免疫共刺激分子,主要表达于肿瘤细胞表面[14]。在PD-1/PD-L1信号通路中,T细细增殖受到抑制,从而使其不能对肿瘤细胞完成正确的识别及杀伤作用,使其严重“失能”,加剧肿瘤的侵袭转移[15]。在多种恶性肿瘤中PD-L1呈明显的高表达状态,如乳腺癌、非小细胞肺癌等[16]。PD-L1可通过PI3K/AKT通路途径促进EMT进程,EMT状态反过来可通过PI3K/AKT通路提升PD-L1蛋白的表达,双向的共促进方式增强恶性肿瘤的侵袭转移作用[17]。相对于传统的治疗方法,靶向治疗和预测性生物标记物是治疗复发或转移性疾病临床疗效的重要手段。检查点抑制剂是最有前途的治疗方法之一,通过阻断PD-1或PD-L1对肿瘤细胞产生强烈的免疫反应而对多种癌症有效[18]。然而,在实际的临床实践中,耐药性的问题逐渐显露,成为了PD-1/PD-L1抑制剂发挥疗效过程中重要的绊脚石[19]。基于目前PD-1/PD-L1抑制剂的局限性,将PD-1/PD-L1抑制剂与其他治疗方法相结合逐渐成为另一个重要的发展方向,例如结合放射疗法的抑制剂。探索新的免疫治疗策略,控制疾病的进展,从而为患者带来更可持续的生存效益。在众多可促进肿瘤细胞侵袭转移能力的角色当中,MTA1备受关注,同时与PD-L1关系密切。MTA1属于转移相关基因家族成员之一,在乳腺癌大鼠中被发现而得名。MTA1无论是作为NURD复合体的一部分,或独立地存在都可间接调控肿瘤侵袭转移过程[20],同时MTA1使细胞角蛋白纤维系统发生改变,进而使肿瘤细胞获得侵袭转移的特征[21]。MTA1在乳腺癌、胃癌、肺癌、卵巢癌、结肠癌等高表达且与患者的临床分期,远处转移及生存率低显著相关[22-24]。EMT与癌症密不可分,参与多种调控机制[25-26]。MTA1表达升高可间接促进EMT[27],同时激活PI3K/AKT信号通路也可提高MTA1蛋白水平来促进EMT及肿瘤细胞的侵袭转移过程[28]。目前MTA1相关药物暂时还未出现,但是有研究表明阻断MTA1的相关途径可以有效降低乳腺癌的发生。同时我们可以猜想MTA1相关药物与PD-1/PD-L1抑制剂联合应用的前景效果。本实验中,PD-L1与MTA1在口腔鳞癌组织中的阳性率分别为75.56%与66.67%,PD-L1与MTA1的表达与肿瘤的TNM分期有关,这使二者有望在口腔鳞癌的基础研究及早期诊治等方面发挥至关重要的作用,而二者的表达与肿瘤的分化程度无明显相关这一结论与徐凯等[29-31]研究的与肿瘤分化程度相关不一致,本实验的标本数量有限可造成该结果的产生,同时也需要进一步实验加以验证差异的结果。MTA1参与免疫调节过程,其可以诱导CD8+T细胞和CD4+T细胞分泌干扰素γ产生抑癌作用[32],然而当免疫微环境中存在干扰素γ表达上升时,肿瘤细胞则会产生所谓的抗免疫抑制作用,进而使PD-L1的表达上调[33],那么此时微环境中的干扰素γ的抑癌作用与PD-L1的促癌作用的相互关系及MTA1与PD-L1的共同表达结果有待于进一步研究。这也是本实验将二者一同在口腔鳞癌组织中检测的目的,本实验只是做出简单判断,还需要检测更多指标继续验证此次实验结果。
综上所述,高表达的PD-L1和MTA1与口腔鳞癌的TNM分期关系密切,检测口腔鳞癌中PD-L1与MTA1的表达可以预测肿瘤的恶性程度。加深对二者的研究有一定的必要性,可能对口腔鳞癌的研究产生深远的影响,同时在口腔鳞中PD-L1与MTA1的相互作用机制仍有待人们进一步深入发掘,研究前景十分广泛。
