电针对老年冠心病患者行胃癌根治术术后镇痛与应激反应的影响
2020-08-18周民涛张彩举付金厚何金乾
周民涛,张彩举,付金厚,何金乾
(南阳市第一人民医院,南阳 473010)
随着我国逐渐迈入老龄化社会,冠心病的发病也日益增多,近年来由于麻醉技术的不断进步,行非心脏手术的冠心病患者也逐年增多。冠心病患者行胃癌根治术,手术创伤应激,再加上术后疼痛剧烈,导致患者出现围术期心肌缺血的情况[1]。电针刺激穴位镇痛具有起效快、效果确切和镇痛时间长以及无药物不良反应等优点,被患者所接受[2-3]。内麻点定位在小腿内侧,内踝上7寸,胫骨的后缘0.5寸,针刺内麻点曾应用于腹部[4]手术麻醉与术后镇痛,取得了较好的临床效果[5-6]。内关穴定位在前臂的正中,腕横纹上2寸。《针灸甲乙经》:“实则心暴痛……失智,内关主之。”提示刺激内关穴对心肌缺血治疗过程中具有降低心肌损害和保护心肌的作用[7-8],因此笔者选择电针刺激内麻点和内关穴,来探讨对老年冠心病患者行胃癌根治术术后镇痛与应激因子β-EP、TNF-α和 IL-6的影响,旨在为择期行胃癌根治术的老年冠心病患者找寻适宜的麻醉方法。
1 临床资料
1.1 一般资料
选取2018年2月至2019年4月在南阳市第一人民医院择期行胃癌根治术患者80例,采用随机数字表法随机分为观察组与对照组,每组40例。
两组患者均采用全凭静脉麻醉,观察组于麻醉诱导前电针刺激内麻点与内关穴 30 min,手术结束后再次刺激30 min后拔针;对照组术后采用舒芬太尼静脉自控镇痛(PCIA)。两组患者年龄、性别、体质量、手术时间以及剔除人数比较差异无统计学意义(P>0.05)。详见表1。本研究通过南阳市第一人民医院伦理委员会批准(20180205),并与患者或委托人签署知情同意书。
1.2 纳入标准
①ASA分级Ⅱ~Ⅲ,年龄60~75岁,体质量55~75 kg;②依据世界卫生组织提供的缺血性心脏病的诊断标准;③手术时间3~4 h。
1.3 排除标准
①术前VAS评分>5分者;②6个月内有急性心肌梗死病史者;③严重慢性系统性疾病的患者;④凝血功能障碍者;⑤有慢性疼痛、吸毒史者;⑥经络部位皮肤感染者。
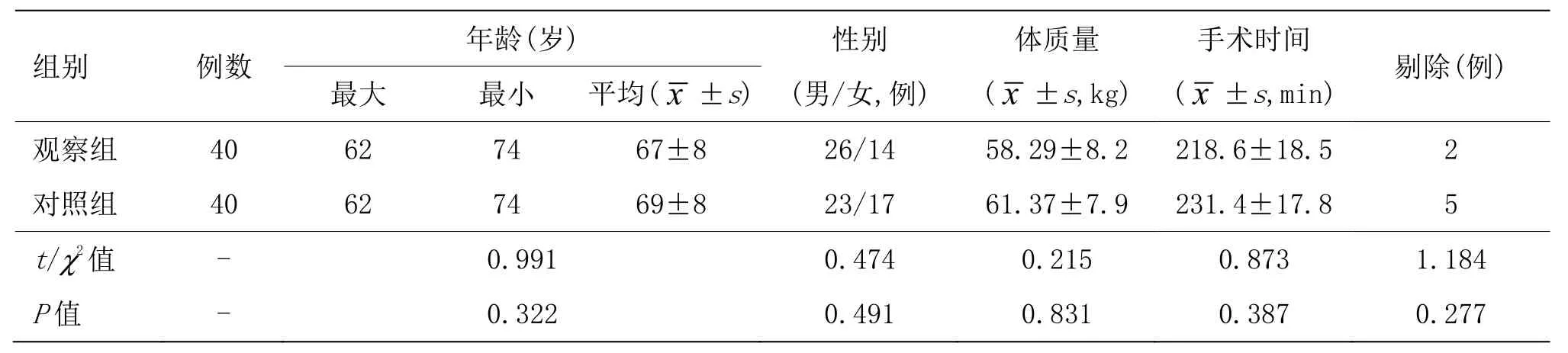
表1 两组一般资料比较
2 治疗方法
患者入手术室后,行颈内中心静脉穿刺置管并监测有创动脉压。麻醉诱导采用咪唑安定(批号 1603021)0.05 mg/kg静脉注射,瑞芬太尼(批号6160405)和丙泊酚(批号 21608081)靶控输注(target controlled infusion, TCI)(CP600TCI, Slgo 科技有限公司,中国)预期血浆浓度分别是4.5 ng/mL和2.5 μg/mL,罗库溴铵(批号160504)1 mg/kg静脉注射, TOF值降为0时,行气管插管。
术中行脑电双频谱指数(bispectral index, BIS)监测,调整丙泊酚与瑞芬太尼的 TCI血浆浓度,保持BIS值在 45~55之间;依据 TOF值静脉注射罗库溴铵20 mg。
2.1 对照组
采用药物镇痛方法,枸橼酸舒芬太尼(批号1161004)2 μg/kg加0.9%NaCl稀释至100 mL注入镇痛泵。镇痛泵参数设置为负荷剂量0.1 mL/kg,维持剂量 2 mL/h,自控剂量 0.5 mL,锁定时间 15 min。手术结束前约30 min静脉注射负荷剂量后接镇痛泵,治疗2 d。若出现严重不良反应,呼吸频率小于11次/min以及不能唤醒者停用PCIA,并将该患者排除。
2.2 观察组
电针方法,取双侧内麻点与内关穴。皮肤消毒后用一次性毫针与皮肤垂直进针,得气后(患者述有酸麻、胀困感),固定好毫针。然后接G6805IIb型电针治疗仪,选用连续波,频率由低到高逐渐调节(2~100次/min),强度以患者能耐受为宜(输出电压正脉冲>12.5 V,负脉冲>20 V,250Ω负载),刺激 30 min。
3 治疗效果
3.1 观察指标
记录两组患者术中瑞芬太尼和丙泊酚的使用量。记录两组患者针刺前(T0)、术后2 h(T1)、术后12 h(T2)、术后24 h(T3)、术后48 h(T4)5个时间点的VAS评分,采用放射免疫法测定各时间点血液标本中应激因子β-EP、TNF-α与IL-6的含量。
3.2 统计学方法
全部数据采用SPSS21.0软件包进行分析。符合正态分布的计量资料以均数±标准差表示,比较采用 t检验。计数资料比较采用卡方检验。以P<0.05为差异有统计学意义。
3.3 治疗结果
3.3.1 两组患者术中药物用量比较
观察组丙泊酚用量与对照组比较差异无统计学意义(P>0.05);观察组瑞芬太尼用量与对照组比较差异有统计学意义(P<0.05),观察组瑞芬太尼用量显著低于对照组。详见表2。
表2 两组患者术中药物用量比较 (±s,mg)
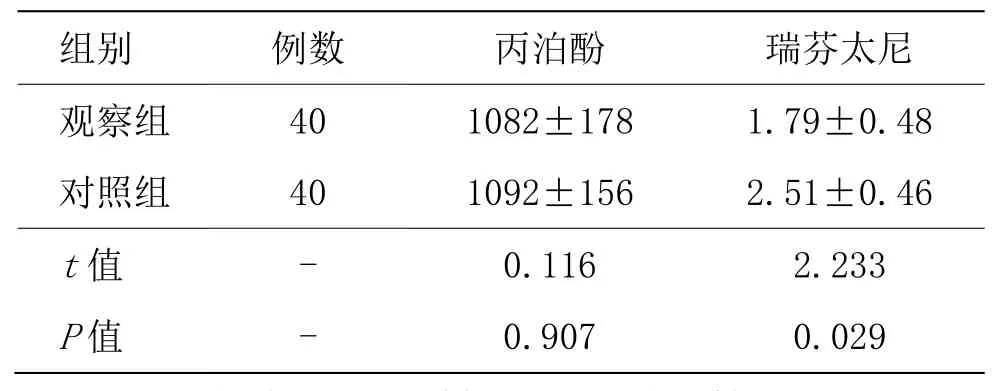
表2 两组患者术中药物用量比较 (±s,mg)
组别 例数 丙泊酚 瑞芬太尼观察组 40 1082±178 1.79±0.48对照组 40 1092±156 2.51±0.46 t值 - 0.116 2.233 P值 - 0.907 0.029
3.3.2 两组患者不同时间VAS评分比较
两组 VAS评分在 T1时间点与 T0比较,显著升高(P<0.05);对照组VAS评分在T1、T2和T3时间点与观察组比较,显著升高(P<0.05)。详见表3。
3.3.3 两组患者不良反应比较
对照组在术后2 h有12例患者出现恶心呕吐、瘙痒等不良反应,其中有5例患者较重,给予纳洛酮静脉注射,并将其排除;术后12 h有4例患者出现上述不适反应;术后24 h有2例患者出现上述不适反应。观察组电针刺激前2例出现反应,因患者过度紧张,害怕针刺主动要求停止。余时点未见上述不良反应。
表3 两组患者不同时间VAS评分比较 (±s,分)

表3 两组患者不同时间VAS评分比较 (±s,分)
注:与同组T0比较1)P<0.05
组别 例数 T0 T1 T2 T3 T4观察组 40 2.02±0.26 3.45±1.021) 2.59±0.94 2.31±0.74 1.82±0.35对照组 40 1.88±0.25 4.53±1.181) 4.20±0.881) 3.73±0.911) 2.48±0.47 t值 - 0.574 4.225 5.234 -3.859 0.835 P值 - 0.567 0.001 0.001 0.000 0.408
3.3.4 两组患者血浆应激因子水平比较
观察组β-EP在 T1、T2、T3和 T4时间点与 T0比较,显著升高(P<0.05),对照组β-EP在 T1时间点与 T0相比,明显升高(P<0.05);对照组TNF-α和IL-6在T1、T2和T3时间点与T0比较,显著升高(P<0.05)。观察组β-EP在 T2、T3时间点与对照组比较,显著升高(P<0.05);对照组 TNF-α和 IL-6 在 T1、T2和 T3时间点与观察组比较,显著升高(P<0.05)。详见表4-6。
表4 两组患者不同时间β-EP水平比较 (±s,pg/mL)
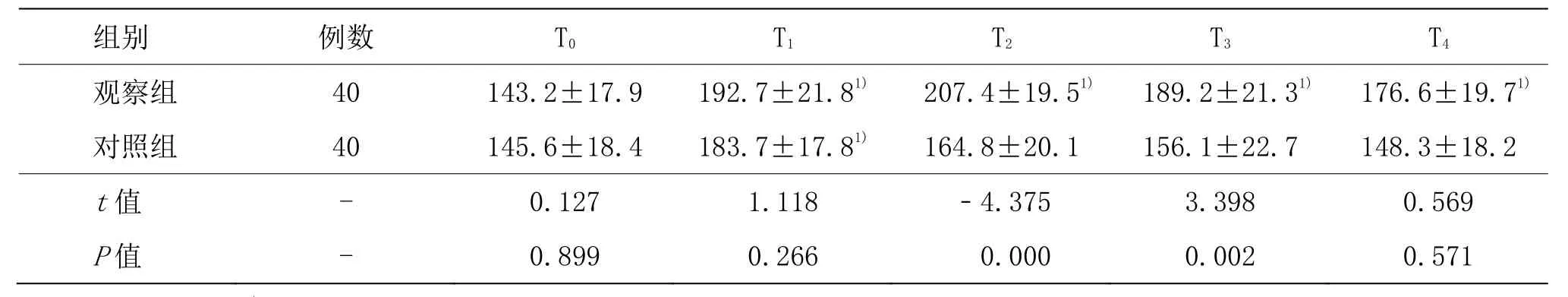
表4 两组患者不同时间β-EP水平比较 (±s,pg/mL)
注:与同组T0比较1)P<0.05
组别 例数 T0 T1 T2 T3 T4观察组 40 143.2±17.9 192.7±21.81) 207.4±19.51) 189.2±21.31) 176.6±19.71)对照组 40 145.6±18.4 183.7±17.81) 164.8±20.1 156.1±22.7 148.3±18.2 t值 - 0.127 1.118 -4.375 3.398 0.569 P值 - 0.899 0.266 0.000 0.002 0.571
表5 两组患者不同时间TNF-α水平比较 (±s,pg/mL)
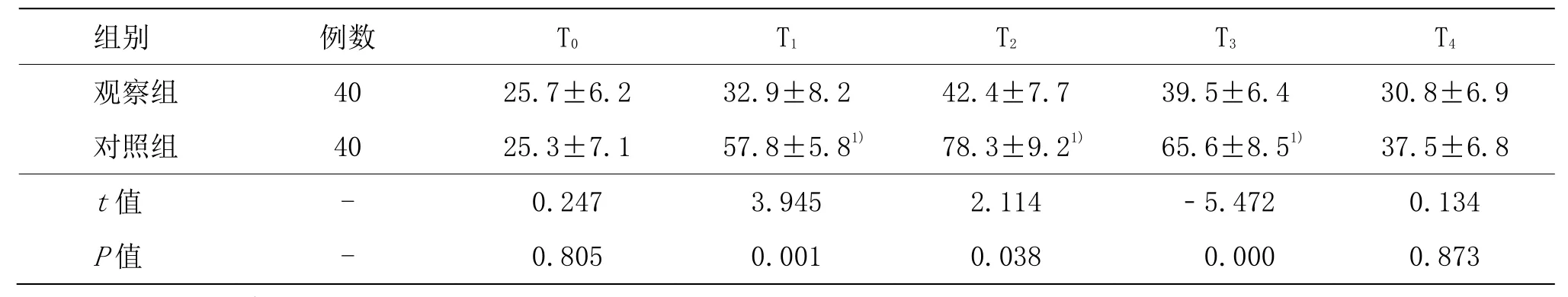
表5 两组患者不同时间TNF-α水平比较 (±s,pg/mL)
注:与同组T0比较1)P<0.05
组别 例数 T0 T1 T2 T3 T4观察组 40 25.7±6.2 32.9±8.2 42.4±7.7 39.5±6.4 30.8±6.9对照组 40 25.3±7.1 57.8±5.81) 78.3±9.21) 65.6±8.51) 37.5±6.8 t值 - 0.247 3.945 2.114 -5.472 0.134 P值 - 0.805 0.001 0.038 0.000 0.873
表6 两组患者不同时间lL-6水平比较 (±s,pg/mL)
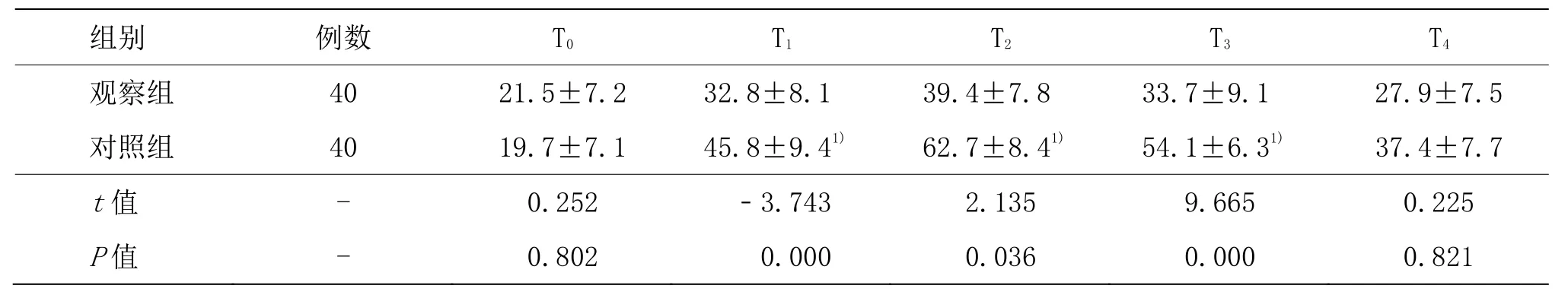
表6 两组患者不同时间lL-6水平比较 (±s,pg/mL)
注:与同组T0比较1)P<0.05
组别 例数 T0 T1 T2 T3 T4观察组 40 21.5±7.2 32.8±8.1 39.4±7.8 33.7±9.1 27.9±7.5对照组 40 19.7±7.1 45.8±9.41) 62.7±8.41) 54.1±6.31) 37.4±7.7 t值 - 0.252 -3.743 2.135 9.665 0.225 P值 - 0.802 0.000 0.036 0.000 0.821
4 讨论
4.1 舒芬太尼静脉自控镇痛
舒芬太尼是长效和强效阿片受体,具有强大的镇痛作用,起效迅速,持续时间长,对循环影响小等优点[9-11],是目前较理想的术后镇痛药物。但舒芬太尼易于引起术后恶心、呕吐,较大剂量时呼吸抑制的发生率较高[12]。术后应用舒芬太尼 PCIA,不良反应与药物的用量之间存在着量效关系,当舒芬太尼用量达到2.0 μg/kg时,发生不良反应明显增高[13]。
胃癌根治术存在创伤较大,手术后疼痛较剧烈,因此对照组术后镇痛采用舒芬太尼2.0 μg/kg最大剂量,术后各时间点 VAS评分显示,舒芬太尼术后镇痛效果患者基本满意,观察组在术后2 h有12例患者出现恶心、瘙痒、尿潴留等不良反应,其中有5例患者反应较重,给予纳洛酮静脉注射,并将其排除;术后12 h有4例患者出现上述不适反应;术后24 h有2例患者出现上述不适反应。表明舒芬太尼镇痛效果满意但存在恶心、呕吐与瘙痒等不良反应。
4.2 针刺镇痛
借助于对疼痛产生的神经生物学机制,韩济生教授通过对针刺镇痛与神经生物学变化有机联系起来,揭示了针刺通过改变神经化学物质的变化来发挥镇痛作用[14]。针刺镇痛通过激活机体脑内的内阿片系统,引起内啡肽与脑啡肽的释放,从而抑制伤害性刺激的传入[15-16];另外 5-羟色胺也是参与针刺镇痛的主要神经递质[17]。
本研究对照组术后VAS评分在T1、T2和T3时间点高于观察组,观察组仅2例患者精神过度紧张,害怕针刺主动要求停止,余时点未见上述不良反应,表明电针预处理能为患者提供较好的术后镇痛。
4.3 β-EP、TNF-α和 lL-6
20世纪70年代,β-EP被人类所发现,β-EP是一种重要的内源性镇痛系统的神经递质,主要由垂体和下丘脑内侧基底部的阿黑皮素原(proopiomelanocortin,POMC)分泌,众多研究证实[18-20],电针刺激机体能引起β-EP的合成与释放。本研究观察组β-EP在T1、T2、T3、T4时间点与 T0比较明显升高,观察组β-EP在 T2、T3时间点与对照组比较,明显升高。也证明电针刺激机体能引起β-EP的合成与释放。β-EP能激活阿片受体内阿片肽,在体内具有吗啡样活性,能阻断疼痛通路的传递[21-22]。因此,本研究观察组镇痛药物用量减少,也证明了这一点。P物质是机体内痛觉传导的主要递质,内啡肽能抑制其释放,其机制与其阳性神经元的投射相关,由弓状核发出神经纤维投射到脑干中的某些核团,这些核团与伤害性刺激的传递以及镇痛密切相关,发挥其镇痛作用[23]。有学者研究,电针刺激能促使阿片肽的释放,导致前体物质的消失,而阿片肽基因的表达的重要功能之一就是弥补这种损失,针刺长期效应的调节可能与其加速表达的参与有关[24]。王观涛等[25]研究发现,针刺通过提高 POMC基因转录的表达,补充即时消耗掉的β-EP,作用持续72 h。
TNF-α和IL-6是由巨噬细胞、单核细胞及内皮细胞合成与释放的炎性因子[26]。外科手术引起组织损伤,机体产生炎症反应引起疼痛[27]。Dinarello CA[28]的研究发现,在炎症反应早期,TNF-α与IL-6等炎性因子就有较高水平的表达,因此TNF-α与IL-6在炎症反应中起始动作用。TNF-α和IL-6能引起神经元和胶质细胞上SP和PGE2的表达水平参与外周敏化[29],但近来有研究表明炎性因子也可参与中枢敏化[30],引起痛觉。众多研究证实[31-33],电针刺激机体通过多种途径抑制TNF-α和IL-6的合成与释放,抑制机体痛敏反应。本研究对照组 TNF-α和 IL-6在 T1、T2和 T3时间点与 T0比较,显著升高,对照组 TNF-α和 IL-6在T1、T2和 T3时间点与观察组比较,显著升高。也证明电针刺激机体能抑制TNF-α和IL-6的合成与释放。
老年冠心病患者行胃癌根治术,手术创伤大,应激反应强,术后疼痛剧烈,易引起围术期心血管事件的发生。电针刺激内麻点与内关穴预处理,不仅能减少术中镇痛药物的用量,还能为患者提供良好的术后镇痛,降低应激反应。其机制可能是电针预处理能促进β-EP的释放和抑制TNF-α和IL-6的分泌有关。