正交设计优化超声辅助提取新疆和田大枣中多糖工艺
2020-08-18李亚童李欢欢海力茜陶尔大洪
陈 莉,李亚童,李欢欢,海力茜·陶尔大洪
(新疆医科大学药学院,新疆乌鲁木齐 830011)
新疆和田大枣为鼠李科(Rhamnaceae) 枣属(Zizyphusmill)植物的成熟果实枣(Zizyphus jujuba mill),经烘干、烤制或者晾、晒而成的食用或药用性产品。和田大枣的果皮呈深红色,果肉饱满有弹性[1]。藏医名著中记载道,大枣具有性温、味酸、清心热、治心病等作用[2]。
多糖是由相同的单糖组合而成,如糖原和淀粉。多糖广泛存在于植物、动物和微生物的细胞壁中[3-4]。大量的药理和临床研究表明天然多糖具有广泛的药理活性,如免疫调节、抗肿瘤、抗病毒、降血糖、调血脂、抗衰老等,又因其具有高效、安全、低副作用等特点,所以多糖成为国内外学者研究热点。近年来,多糖类化合物已在医药、食品、化妆品等领域被广泛应用[5-6]。试验采用超声提取,通过单因素试验和正交试验最后确定新疆和田大枣多糖最佳提取工艺,以期为应用于今后的试验研究提供理论参考。
1 仪器与试剂
1.1 仪器
DHG-9075A型减压真空干燥箱,上海精宏实验设备有限公司产品;DT-200型分析天平、UV-2550型紫外分光光度仪,日本岛津公司产品。
1.2 试剂
无水乙醇、正丁醇,天津市富宇精细化工有限公司提供;95%乙醇,天津市大茂化学试剂厂提供;5%葡萄糖,国药集团新疆制药有限公司提供;氯仿、浓硫酸、丙酮,均为分析纯。
2 方法与结果
2.1 多糖的测定
采用苯酚-硫酸法测定大枣多糖含量。

2.2 标准曲线的绘制
精密吸取5%葡萄糖0.2 mL置于100 mL容量瓶中,用蒸馏水定容至刻度,精密移取葡萄糖溶液0.3,0.4,0.5,0.6,0.7,0.8 mL分别置于试管中,加水至2 mL,再依次加入5%苯酚1.0 mL,浓硫酸5.0 mL,于90℃下加热15 min,冷却至室温,以2 mL蒸馏水,1.0 mL苯酚,5.0 mL浓硫酸定容至刻度的溶液做空白对照,于波长490 nm处测吸光度。以葡萄糖质量浓度C(mg/mL)为横坐标,吸光度A为纵坐标绘制标准曲线,得回归方程为Y=17.057X+0.001 4(R2=0.999 7),样品检测量为 0.015~0.040 mg/mL时与吸光度线性关系良好。
2.3 方法学考查试验
2.3.1 稳定性试验
取完全反应后的供试品2 mL,按上述方法显色后,每隔30 min测1次吸光度,连续测6次,结果RSD值为1.3%,表明该样品在1 h内稳定。
样品稳定性试验见表1。

表1 样品稳定性试验
2.3.2 重复性试验
精密量取2 mL供试液,按上述方法显色后,测其吸光度并计算RSD值为1.8%,表明样品的重复性较好。
样品重复性试验见表2。
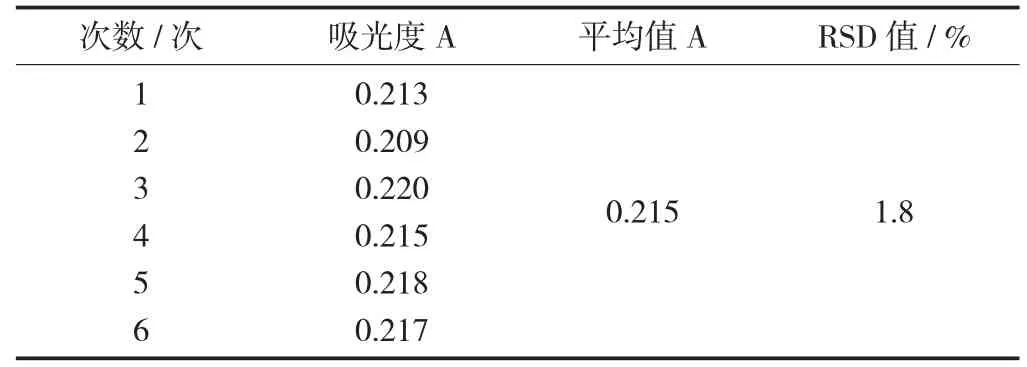
表2 样品重复性试验
2.3.3 精密度试验
精密吸取6份葡萄糖对照品溶液0.5 mL,置于试管中,按标准曲线制备重复操作,重复测定吸光度6次,结果RSD值为0.7%,表明该方法精密度良好。
精密度试验见表3。
2.3.4 加样回收率试验
为了验证试验的准确性,在样品中加入葡萄糖对照品后测定并计算其回收率。取已知质量浓度的多糖含量的供试品9份,各2.0 mL,置于100 mL容量瓶中,按低、中、高质量浓度分别加入葡萄糖对照品 0.8,0.8,0.8,1.0,1.0,1.0,1.2,1.2,1.2 mL,按上述方法显色后,用蒸馏水定容至刻度,于波长490 nm处测定吸光度,结果平均回收率98.1%,RSD值为1.3%。

表3 精密度试验
加样回收试验见表4。

表4 加样回收试验
2.4 单因素试验
2.4.1 料液比对大枣多糖提取率的影响
准确称取大枣粉末4份,每份2.00 g,分别设置料液比为1∶10,1∶15,1∶20,1∶25,在提取温度70℃,超声功率80 W的超声波清洗仪中超声处理30 min,再抽滤、除蛋白、醇沉,将沉淀溶解并稀释成样液,然后精密加入1 mL苯酚和5 mL浓硫酸,静置20 min,于波长490 nm处测定吸光度,计算提取率。
料液比对大枣多糖提取率的影响见图1。

图1 料液比对大枣多糖提取率的影响
由图1可知,随着料液比的增加,大枣多糖的提取率逐渐下降。当料液比为1∶10(g∶mL) 时,提取率最大为6.10%。因此,选择料液比为1∶10(g∶mL)时提取大枣中多糖最优。
2.4.2 超声时间对大枣多糖提取率的影响
准确称取大枣粉末4份,每份2.00 g,放入锥形瓶中,以1∶15的料液比配制溶液,分别设定超声时间为10,20,30,40 min,在提取温度70℃,超声功率80 W的超声波清洗仪中超声提取后,再抽滤、除蛋白、醇沉,将沉淀溶解并稀释成样液,然后加入精密称量的苯酚1 mL和浓硫酸5 mL,静置20 min,于波长490 nm处测定吸光度,计算提取率。
超声时间对大枣多糖提取率的影响见图2。
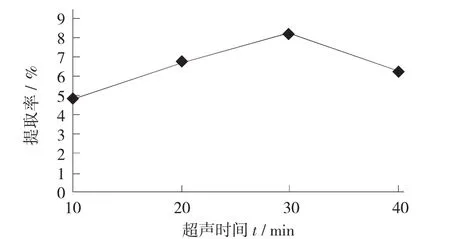
图2 超声时间对大枣多糖提取率的影响
由图2可知,随着超声时间的延长,多糖的提取率增加,但当超声时间继续增加时,多糖的提取率有所降低,可能是因为随着超声时间延长,多糖大分子被降解为小分子,小分子不易沉淀,所以使得多糖的提取率降低。因此,选择超声时间为30 min时提取大枣中多糖最优。
2.4.3 提取温度对大枣多糖提取率的影响
准确称取大枣粉末4份,每份2.00 g,放入锥形瓶中,以1∶15的料液比配制溶液,分别设定提取温度为50,60,70,80℃,在超声功率80 W的超声波清洗仪中超声30 min后,再抽滤、除蛋白、醇沉,将沉淀溶解并稀释成样液,然后加入精密称量的苯酚1 mL和浓硫酸5 mL,静置20 min,于波长490 nm处测定吸光度,计算提取率。
提取温度对大枣多糖提取率的影响见图3。

图3 提取温度对大枣多糖提取率的影响
由图3可知,随着提取温度的升高,多糖的提取率增加,这是由于升高温度使得分子间运动增加,多糖从大枣中溶出速率增加。因此,选择提取温度为70℃时提取大枣中多糖最优。
2.4.4 超声功率对大枣多糖提取率的影响
准确称取大枣粉末4份,每份2.00 g,放入锥形瓶中,以1∶15的料液比配制溶液,分别设定超声功率为70,80,90,100 W,于提取温度70℃条件下超声处理30 min后,再抽滤、除蛋白、醇沉,将沉淀溶解并稀释成样液,然后加入精密称量的苯酚1 mL和浓硫酸5 mL,静置20 min,于波长490 nm处测定吸光度,计算提取率。
超声功率对大枣多糖提取率的影响见图4。

图4 超声功率对大枣多糖提取率的影响
由图4可知,超声功率对多糖提取率影响明显,超声功率80 W时多糖提取率最高为8.07%,但随着功率的增大,多糖可能发生了降解,从而使得多糖的提取率有所降低。因此,选择超声功率为80 W提取大枣中多糖最优。
2.5 正交试验
在单因素试验基础上,以超声功率(A)、提取时间(B)、超声温度(C)、料液比(D) 为试验因素,以大枣多糖的提取率为评价指标,设计正交试验L9(34),优化最佳提取工艺条件。
正交试验因素水平见表5,正交试验结果见表6。

表5 正交试验因素水平

表6 正交试验结果
由表6可知,影响新疆和田大枣提取的影响因素的顺序为超声功率>提取温度>超声时间>料液比,超声提取大枣多糖的最佳提取条件为A1B2C2D2,即超声功率70 W,超声时间30 min,提取温度70℃,料液比1∶15。
2.6 验证试验
为了验证正交试验所得的最优提取工艺的稳定性,分别等量称取大枣粉末2.00 g共3份,根据正交设计优选的最佳大枣多糖提取工艺A1B2C2D2操作,即料液比1∶15,超声时间30 min,提取温度70℃,超声功率70 W,平行操作,进行3次重复试验。结果表明,验证试验与正交设计试验数据基本一致,充分证明了大枣多糖提取工艺的合理性和稳定性。
3 结论
以大枣多糖提取率为考查指标,采用超声辅助提取大枣多糖,通过单因素试验和正交试验,优化确定大枣多糖的最佳提取工艺参数。结果表明,以大枣多糖提取率为考查指标时,影响多糖提取率的主要因素为超声功率,对大枣多糖的提取具有显著性影响,其次是提取温度和超声时间,料液比影响最小。大枣多糖的最佳提取工艺为A1B2C2D2,即料液比1∶15,超声时间30 min,提取温度70℃,超声功率70 W。在最佳提取工艺条件下,多糖的提取率为7.40%。通过验证试验,证明了大枣多糖提取工艺的合理性和稳定性。相比传统的水浸提取法,超声提取法增大了物质分子运动的频率和速度,提高了提取率,具有提取效率高、提取时间短、节省药材等优点,所以超声提取法在中草药提取领域有着广阔的前景。
