例说电解质溶液中微粒浓度比值变化的判断方法
2020-08-17山东李文锦
◇ 山东 李文锦 刘 影
电解质溶液中微粒浓度比值变化的判断在高考中经常出现,主要考查影响电离平衡和水解平衡的因素.此类试题常在选择题中出现,填空题中偶尔也会考查.笔者结合多年的教学实践进行总结归纳.
1 利用影响电离平衡、水解平衡的因素直接判断
影响电离平衡、水解平衡的因素见表1.

表1
例1常温下,下列有关电解质溶液的说法正确的是( ).
A.向0.1mol·L-1的弱酸HA 溶液中加大量水稀释后,溶液中不变
B.向0.1 mol·L-1HF 溶液中加入少量的NaF晶体,减小
C.将CH3COONa溶液从20℃升温至30℃,溶液中减小
D.向NH4Cl溶液中加入少量等浓度的稀盐酸,则的值减小
分析本题考查的是电离平衡、水解平衡受外界条件的影响,解题时要把电离平衡或水解平衡的离子方程式写好,根据外界条件变化影响平衡移动,判断离子浓度比值变化.HA 是弱电解质,存在电离平衡:HA⇌H++A-,向0.1mol·L-1HA 溶液中加水稀释促进电离,n(H+)增大,n(HA)减小,故增大,选项A 错误;HF 溶液中存在电离平衡一定温度下,加入少量的NaF 晶体,平衡向左移动,c(H+)减小增大,选项B 错误;CH3COONa溶液中存在 水 解 平 衡:+OH-,升高温度,平衡向右移动,溶液中减小,选项C 正确;NH4Cl溶液中存在水解平衡:H+,加入少量等浓度的稀盐酸,c(H+)增大,平衡向左移动,则的值增大,选项D 错误.
2 结合弱电解质的电离常数或水解常数判断
电离常数和水解常数只受温度影响,与溶液的浓度无关,利用这一点,如果在离子浓度比值不确定时,就可以结合电离平衡或水解平衡,作适当的变化进行比较.
例2常温下,下列有关电解质溶液的说法正确的是( ).
A.0.1 mol·L-1CH3COOH 溶液中加入少量CH3COONa晶体减小
B.向氨水中加入 NH4Cl 固体,溶液中增大
C.稀醋酸中加入冰醋酸,醋酸电离平衡向右移动,电离度增大
D.常温下,向10mL0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小
分析在比较电解质溶液中微粒浓度比值变化时,常会遇到分子、分母的浓度都增大或都减小的情况,这时就要注意借助电离常数或水解常数在温度不变的情况下,它们的数值不变,再通过转化关系进行判断.向0.1mol·L-1CH3COOH 溶液中加入少量的CH3COONa晶体,c(CH3COO-)增大,醋酸的电离平衡受到抑制,溶液的酸性减弱,c(H+)减小,温度不变,电离平衡常数不变,因此增大,选项A 错误;向氨水中加入NH4Cl固体,溶液中

温度不变,平衡常数不变,选项B错误;稀醋酸中加入冰醋酸,醋酸浓度增大,醋酸电离平衡向右移动,但电离度减小,选项C错误;溶液中
3 根据电解质溶液中发生的化学反应进行判断
有的题目中涉及了化学反应,这时就要看发生了怎样的离子反应,反应物是什么,生成物是什么,再分析溶液中离子浓度比值变化.
例325℃时的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应 的 平 衡 常 数Kh=mol·L-1.若 向NaHSO3溶液中加入少量的I2,则溶液中将(填“增大”“减小”或“不变”).
分析计算电离常数一般按照电离常数表达式进行计算,因此要掌握电离常数表达式;在电解质溶液中加入试剂,应该明确发生了什么反应,导致什么结果.对于电离方程式:,电离常数
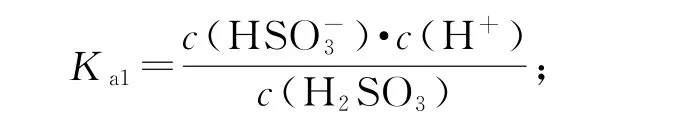

加入I2,发生反应:3H+,然后发生反应:,因此c(H2SO3)增大,c(HSO-3)减小,比值增大.
总之,判断电解质溶液中微粒浓度比值变化的情况,首先要掌握影响电离平衡和水解平衡的因素;其次根据电离平衡或水解平衡判断平衡移动的方向,有时要把浓度比值转化成物质的量的比值判断;在遇到比值变化不好判断时,注意借助电离平衡常数或水解平衡常数表达式作适当的处理;如果发生了化学反应,还要明确反应原理以及导致了什么结果.
