创设问题情境,培养学生化学学科核心素养的实践研究
———以“电解池”第一课时的教学设计为例
2020-08-17广东玉桂凤
◇ 广东 玉桂凤
随着新课改的逐渐深入,学科核心素养已成为当前教育改革关注的焦点.化学课堂是培养学生化学学科核心素养的重要基地,教师如能创设一系列高质量的问题情境,引领学生在实验探究中利用证据进行推理、分析、归纳、总结,形成相关的认知模型,实现在认知活动中培养和提升学生的化学学科核心素养,则能成为高效的课堂.那么在化学课堂中如何通过创设问题情境来培养学生化学学科核心素养,本文以“电解池”第一课时的教学设计为例进行说明.
1 教学设计
1.1 教学主题内容
本节是人教版高中化学《选修4》第四章“电化学基础”第三节的内容,是新授课.本节内容主要包括电解的定义、装置、原理、电极的判断和电极名称、电极反应、放电的顺序、电解原理的应用等.这节内容与前面所学的原电池结合起来,就构成了中学化学电化学知识,它既涉及理论知识,又与元素化合物知识密切相关.
1.2 教学现状分析
目前的教学设计基本上是先让学生直观地感受到电解现象的存在,了解电解池的基本装置,然后再进一步理解电解池的工作原理.如果再演示不同电解质溶液及不同电极对电解现象影响的实验,学生更易掌握离子放电顺序的规律;创设问题情境,更能激发学生的求知欲.
1.3 教学的思想与创新点
本节课以实验探究为中心,采用的是创设问题情境—实验探究—解决问题—再提出问题的方法展开探索的过程.充分体现了“以学生为主体,教师作为引导,以学为中心”的新课改精神,充分调动学生参与课堂的积极性、主动性.
每个环节都以创设问题情境为导向进行探索,根据本节课的教学内容和教学特点,在教学中补充了不同电解质溶液及金属作电极的学生分组探究实验,培养了学生的探索精神及主体性与合作精神.
1.4 教学目标
1)宏观角度认识电解池模型.通过观察电解实验,初步建立电解池的概念,认识到电解池是将电能转换为化学能的装置.
2)微观角度分析本质原因.从溶液中阴阳离子移动的方向、得失电子、能量变化对电解原理进行分析.
3)变化观理解电解池的原理.通过实验现象、电极的判断、氧化还原观、离子放电规律、电极反应等进一步推理、理解电解原理.
4)建立电解过程的模型认知.运用对比探究实验、分类、归纳、概括等方法收集证据,探究电解过程的规律及实质,推理与建立分析电解池的一般思路.
5)体现科学精神和社会责任感.通过对“铜钥匙”“手机充电”等问题的分析,体会化学与生活的关系,感受电解的应用价值,培养将化学成果应用于生产、生活的意识.
1.5 教学流程
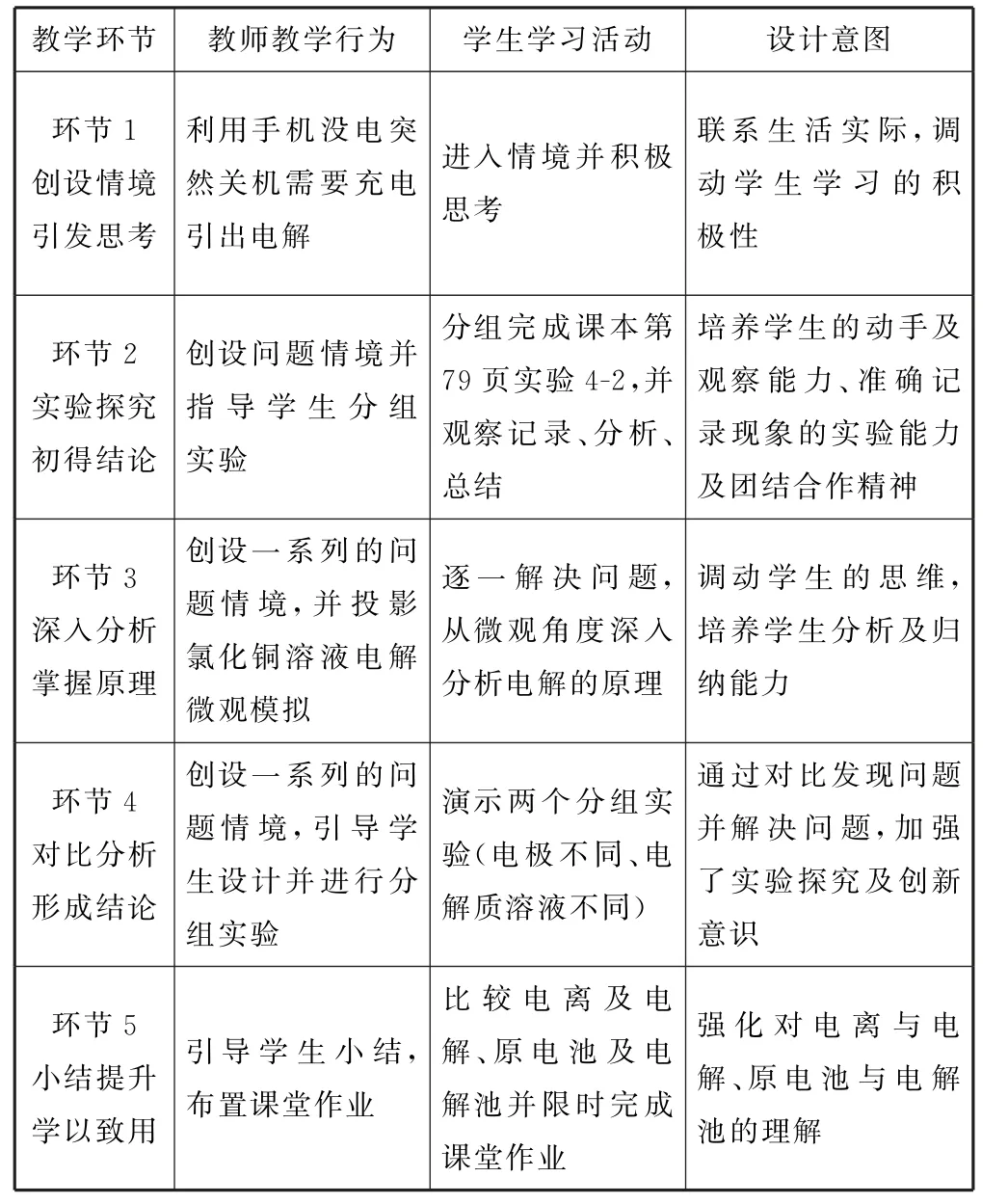
表1 教学流程
1.6 教学实录
环节1创设情境,引发思考
在科技迅速发展的今天,电脑和手机成为生活的必需品,但有时正用手机联系或处理非常紧急的事情时,手机突然没有电了,这时我们想到的是马上给手机充电.充电是电能转化为化学能的过程,那么电能如何转化为化学能就是这节课我们要研究的问题.
环节2实验探究,初得结论
【问题1】如图1所示,将两根碳棒用导线相连插入氯化铜溶液中,两个电极的表面是否有现象产生?
【问题2】图2 所示为电解氯化铜溶液的演示实验,如果将图1 装置的两根碳棒接通电源,情况又怎样呢?
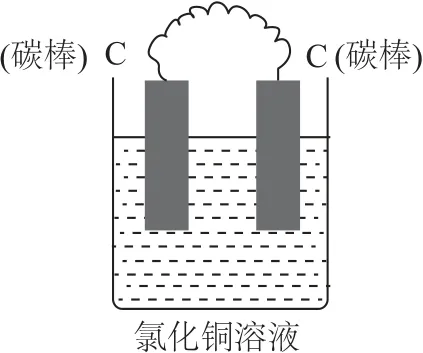
图1
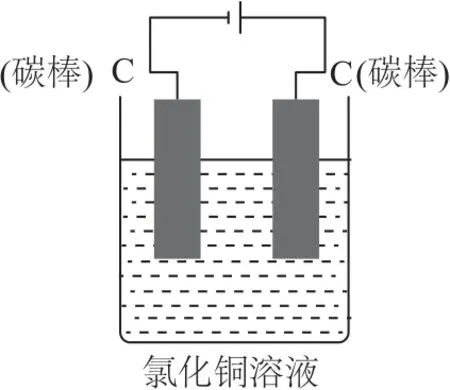
图2
【实验探究1】学生分组完成课本第79 页实验4-2.
药品和仪器:碳棒、导线、电源、氯化铜溶液、淀粉碘化钾试纸.
【学生活动】观察、记录、分析、讨论:
(1)图1中,两个电极的表面无明显现象.
(2)图2 中右边碳棒上有刺激性气味的气体产生,且能使湿润的淀粉碘化钾试纸变蓝,左边碳棒上有红色物质析出.
环节3深入分析,掌握原理
【问题3】通电前,氯化铜溶液中含有哪些微粒?通电时这些微粒怎么移动? 通电后两个电极各发生什么反应? 各属于什么反应类型? 能量如何转化?构成条件怎样?
【教师活动】投影“电解氯化铜溶液微观模拟”并指出电极名称.
【学生活动】分组讨论,书写电极方程式.
阳极:2Cl--2e-=Cl2↑(氧化反应).
阴极:Cu2++2e-=Cu(还原反应).
能量变化:电能转变为化学能.
构成条件:1)两个电极(能导电的金属或非金属);2)电解质;3)有外加直流电源,并形成闭合回路.
【问题4】在电解过程中,电子是如何形成闭合电路的?
【学生活动】看课本第80页,归纳电子流动方向:电源负极→电解池阴极→电解质溶液→电解池阳极→电源正极;离子移动方向:阳离子→阴极,阴离子→阳极.
【过渡】阴、阳离子分别在阳极、阴极上失、得电子发生氧化还原反应;我们把阴、阳离子失、得电子的过程叫放电.
环节4对比分析,形成结论
【问题5】CuCl2溶液中有自由移动的Cu2+、Cl-、H+、OH-,为什么只有Cu2+、Cl-放电,而H+、OH-却不能在两极放电呢?
【师生活动】学生相互讨论,教师引导分析.
离子得、失电子的先后顺序应是由离子的氧化性、还原性相对强弱决定的.氧化性强的离子先得电子,还原性强的电子先失电子.所以在CuCl2溶液中Cu2+和Cl-先放电.
【问题6】在电解氯化铜溶液的装置中,若把电解质溶液分别换成氯化钠溶液、硫酸铜溶液,两电极发生的反应又会是怎样的呢? 试写出电极反应方程式.
【实验探究2】探究电解质溶液不同时对电解的影响(电极都为碳棒)(分组实验).
实验器材:反应容器(U 形管)、直流电源、导线、电极(碳棒)、淀粉碘化钾试纸.
第1组:NaCl溶液;第2组:CuSO4溶液.
【学生活动】汇报实验结果并书写电极方程式.
电解氯化钠溶液:
阴极反应:2H++2e-=H2↑.
阳极反应:2Cl--2e-=Cl2↑.
电解硫酸铜溶液:
阴极反应:Cu2++2e-=Cu.
阳极反应:4OH--4e-=2H2O+O2↑.
【师生活动】离子放电的先后顺序:
阳离子放电:Ag+>Hg2+>Cu2+>H+>Fe2+;
阴离子放电:S2->I->Br->Cl->OH->含氧酸根.
【问题7】前面的学习一直在强调碳棒作电极,如果不是碳棒作电极,结果又会怎样?
【实验探究3】探究电解质溶液相同,电极对电解的影响(小组实验).
实验器材:反应容器(U 形管)、直流电源、导线、电极(碳棒、铁片)、淀粉碘化钾试纸.
【学生活动】演示对比实验(电解质溶液相同,只改变电极).
1)两个电极都换成了铁片;
2)阳极换成了铁片,阴极为碳棒;
3)阴极换成了铁片,阳极为碳棒.
【学生汇报小结】铁片作阴极时,铁片本身不反应,铁片作阳极时自身被氧化而溶解,所以书写电极反应式时要注意阳极是活性材料还是惰性材料.
环节5小结提升,学以用致
2 教学后记
本节课采用创设问题—实验探究—再创设问题—对比分析—解决问题等教学方法,充分发挥学生的主体作用,调动学生学习的积极性;通过问题驱动,逐步完成对新知识的建构,通过实验探究,加深对电解池反应原理的理解.整节课充分体现了化学学科核心素养培养要求.
