HAX-1对口腔鳞状细胞癌细胞的增殖和侵袭能力的作用
2020-08-17孙建礼朱青青刘飞赵果
孙建礼, 朱青青, 刘飞, 赵果
郑州大学第一附属医院、河南省口腔医院口腔外科(河南郑州 450000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)又称口腔鳞癌,是常见的口腔黏膜恶性肿瘤,具有局部浸润、高复发及高转移的特性,常伴有颈部的淋巴转移[1-2]。口腔鳞癌发病机制复杂,目前仍没有特定的分子靶向药物应用于临床[3]。造血基质-1相关蛋白X-1 (HS1-associated protein X-1,HAX-1)首次被发现于1997年,HAX-1 是一种抗凋亡蛋白,导致某些疾病的发生,同时其在肿瘤细胞的增殖、转移及侵袭中发挥重要作用[4-6]。报道表明, HAX-1在恶性肿瘤中呈现高表达,并促进肿瘤细胞的增殖和侵袭。如食管癌、鼻咽癌、结直肠癌、肝细胞癌等[7-9]。目前为止,还鲜见HAX-1对口腔鳞癌发生、发展作用的相关报道。本研究旨在探讨HAX-1对口腔鳞癌细胞增殖和侵袭的作用及相关机制,现报告如下。
1 资料与方法
1.1 一般资料 组织样本收集于2014年6月至2015年12月间,于郑州大学第一附属医院口腔外科完成,其中口腔鳞状细胞癌患者样10例、癌旁组织标本10例。患者术前未接受治疗。男7例,女3例,年龄50~58岁。7例有淋巴结转移,3例无淋巴结转移。每例标本于离体20 min内分别在癌灶区、癌旁3 cm处取材,取材后迅速冻于液氮中。通过Western blot检测多种兴趣蛋白(如DNA结合抑制因子4,鸟苷酸结合蛋白6及HAX-1)表达水平。
1.2 试剂或材料 TSCCA和Tca8223购自中国基础医学科学研究所;MTT购自华美生物工程有限公司;DMEM 细胞培养基、青霉素、链霉素和胎牛血清(fetal bovine serum, FBS)购自美国 Gibco 公司;HAX-1兔多抗、AKT兔多抗、AKT兔单抗(phospho S473)、c-myc兔单抗、GAPDH兔单抗和辣根过氧化物酶标记的羊抗兔二抗购自英国Abcam公司;PVDF膜购自美Millipore公司;BrdU试剂盒购自美国Sigma公司;transwell细胞侵袭试剂盒购自美国康宁公司。
1.3 实验方法
1.3.1 细胞培养 人口腔鳞状细胞癌细胞TSCCA和Tca8223在含有10% FBS、1×105U/L青霉素和 100 mg/L链霉素的DMEM细胞培养基,置于37℃, 5% CO2环境中培养。
1.3.2 Western Blot检测 收集组织(利用研钵和液氮将其粉碎)和细胞,加入细胞裂解液冰上反应20 min后收集蛋白。取上清液进行蛋白定量。取25 μg进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),利用半干法将蛋白质电转移到聚偏氟乙烯(Polyvinylidene Fluoride,PVDF)膜上,5%脱脂奶粉溶液封闭有蛋白的PVDF膜2 h后加入一抗:HAX-1兔多抗(1∶600)、AKT兔多抗(1∶700)、AKT兔单抗(1∶800,phospho S473)、c-myc兔单抗(1∶800)或GAPDH兔单抗(1∶1 000),4℃孵育过夜。辣根过氧化物酶标记的羊抗兔二抗(1∶1 000)室温孵育1.5 h,利用凝胶成像系统观察结果。GAPDH为内参对照蛋白,实验结果为重复3次的平均值。
1.3.3 重组质粒构建和细胞转染 TRizol处理细胞提取待测细胞的总RNA,以总RNA为模板反转成cDNA,PCR扩增c-Myc(GenBank accession number NM_002467)全长(包括酶切位点XhoⅠ和EcoRⅠ),扩增产物分别与质粒pcDNA.3.1同时进行EcoRⅠ和XhoⅠ双酶切后连接,转化到DH5a中扩增,筛选阳性克隆,鉴定,测序,将正确的质粒命名为pcDNA.3.1-c-myc。将HAX-1 siRNA(5′-CCA CGA TAA CTT CGG CTT T-3′,0.3 μg)、non-specific siRNA(0.3 μg)、pcDNA.3.1-c-myc(0.3 μg)和pcDNA.3.1(0.3 μg)分别与0.6 μL Turbofect混匀,而后转染进入于96孔板中培养的细胞,37℃, 5% CO2孵育, 24 h后利用Western Blot方法检测转染效率。
1.4 监测指标
1.4.1 细胞生长活力测定 将细胞接种于96孔板,细胞转染于5%CO2,37 ℃的条件下孵育24 h。向各孔分别加入20 μL的MTT(5 mg/mL),于上述培养环境下孵育 6 h。最后,每孔加入150 μL二甲基亚砜溶解蓝紫色结晶甲瓒,用酶标仪测定490 nm处吸光值。结果为3次重复试验的平均值。
1.4.2 Bromodeoxyuridine (BrdU) 检测 将细胞接种于96孔板进行,细胞转染24 h后,利用BrdU ELISA试剂盒检测细胞增殖能力,操作步骤参考说明书。首先每孔加入15 μL BrdU,5%CO2,37 ℃孵育2 h。用100 μL变性溶液换掉上清并孵育细胞10 min。按照说明书相继加入BrdU抗体、二抗和四甲基联苯胺孵育30 min。经酶标仪检测 370 nm 的吸光度以反映细胞增殖的变化。每组样品准备3个复孔, 每次实验重复3次。
1.4.3 transwell细胞侵袭实验 转染细胞的侵袭能力通过细胞侵袭试剂盒检测,操作步骤严格按照试剂盒说明进行。200倍光镜下随机选取5个视野,计算出侵袭到滤膜背面的细胞数,实验重复3次,结果取平均值。

2 结果
2.1 OSCC中HAX-1表达量升高 利用Western blot方法检测OSCC组织中HAX-1的表达量,结果显示,OSCC组织中HAX-1的蛋白表达量较癌旁组织显著升高(图1)。
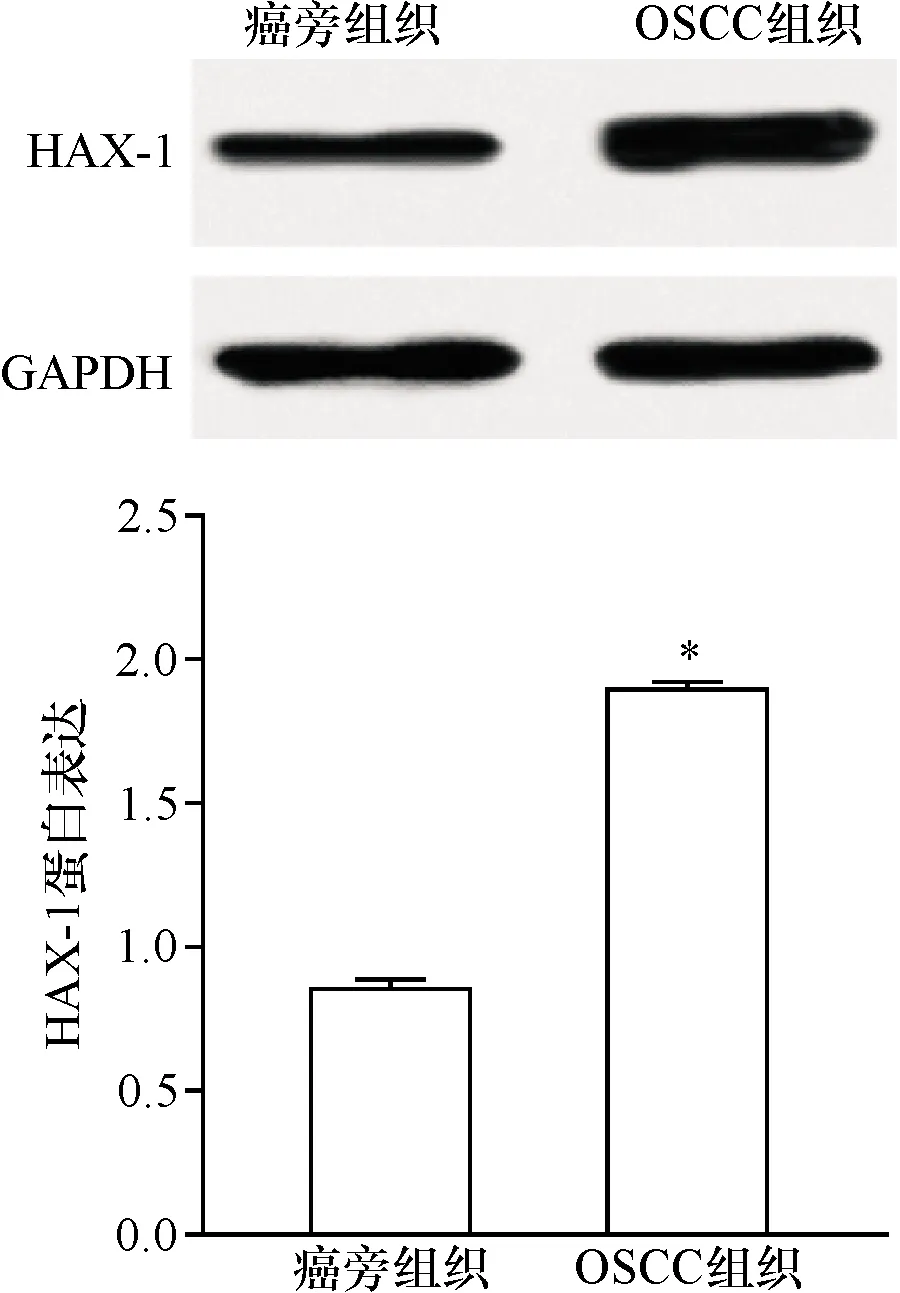
注:*与癌旁组织组比较 P<0.01
2.2 干扰HAX-1表达抑制OSCC细胞的活力和增殖能力 首先,转染HAX-1 siRNA到细胞中干扰HAX-1的表达。结果表明,HAX-1 siRNA组中HAX-1的蛋白表达量较non spe siRNA组显著降低,表明转染实验成功(图2-A)。然后,我们利用MTT和BrdU实验分别检测转染细胞的活力和增殖能力。结果显示,HAX-1 siRNA组的细胞活力(图2-B)和增殖能力(图2-C)较non spe siRNA组均明显降低。
2.3 干扰HAX-1降低OSCC细胞的侵袭能力 利用transwell实验检测干扰HAX-1对OSCC细胞侵袭能力的影响,结果表明HAX-1表达被抑制后可有效降低OSCC细胞的侵袭能力(图3)。
2.4 HAX-1可通过AKT磷酸化调节c-myc的表达 Western blot检测表明,干扰HAX-1的蛋白

注:control:正常OSCC细胞;HAX-1 siRNA: 转染HAX-1 siRNA的OSCC细胞; non spe siRNA: 转染non-specific siRNA的OSCC细胞;A: TSCCA(左)和Tca8223(右)中HAX-1蛋白质表达量;B: 细胞活力测定;C: 细胞增殖能力测定; 与non spe siRNA组比较*P<0.05,**P<0.01

注:*与non spe siRNA组比较P<0.01
表达可显著降低AKT磷酸化水平和c-myc蛋白表达量(图4-A)。为了进一步研究OSCC细胞中HAX-1对AKT活化和c-myc表达的调控,我们利用AKT激动剂SC79(0、1、1.5 和2 μg/mL)分别孵育干扰了HAX-1的OSCC细胞24 h。我们发现,SC79(1.5和2 μg/mL)显著提高了AKT的磷酸化水平(图4-B)。同时,SC79(1.5和2 μg/mL)也明显促进了c-myc的蛋白表达量(图4-B)。可见,AKT磷酸化水平的升高可阻碍HAX-1被干扰后对c-myc表达量的影响。因此,HAX-1可通过AKT磷酸化调节c-myc的表达。
2.5 HAX-1可调节c-myc的表达抑制细胞的增殖和侵袭 转染pcDNA.3.1-c-myc到干扰了HAX-1的OSCC细胞,结果显示HAX-1 si-c-myc组中c-myc的蛋白表达量较HAX-1 si-pc组增加两倍,说明过表达成功(图5-A)。另外,我们发现HAX-1 si-c-myc组细胞活力(图5-B),增殖(图5-C)和侵袭(图5-D)能力较HAX-1 si-pc组显著升高。因此c-myc过表达可有效阻碍HAX-1干扰对OSCC细胞增殖和侵袭能力的作用。

注:HAX-1 si+0、1、1.5、2 μg/mL: SC79(0、1、1.5、或2 μg/mL)孵育干扰了HAX-1的细胞。A: 干扰HAX-1后p-AKT和c-myc表达量变化;B: SC79孵育细胞后p-AKT和c-myc表达量变化;与non-spe siRNA组比较*P<0.05,**P<0.01;△与HAX-1 si+0 μg/mL组比较P<0.01
3 讨论
口腔癌是世界第6大致死性恶性肿瘤,其中约90%为OSCC,近年来OSCC发病率呈逐年升高趋势[10-11]。由于OSCC具有极易早期转移的临床特征,OSCC患者的5年生存率仍不足50%[12-13]。降低OSCC细胞的增殖迁移能力,将有助于OSCC的治疗。

注:HAX-1 si-c-myc.转染pcDNA.3.1-c-myc到干扰了HAX-1的OSCC细胞;HAX-1 si-pc: 转染pcDNA.3.1到干扰了HAX-1的OSCC细胞;A: TSCCA(左)和Tca8223(右)中c-myc蛋白质表达量;B: 细胞活力测定;C: 细胞增殖能力测定;D: 细胞侵袭能力测定; 与HAX-1 si-pc组比较*P<0.05,**P<0.01
近年来的研究发现,HAX-l存在于多种组织中,通过与多种蛋白作用参与或介导细胞骨架组件的形成,调节肿瘤细胞的增殖、黏附及转移等过程[7]。You等[14]研究发现HAX-1在鼻咽癌中过表达且具有重要的临床意义,HAX-1过表达促进鼻咽癌细胞的增殖和迁移。Wang等[15]报道表明HAX-1表达量在甲状腺癌中也升高,而干扰其表达可有效抑制甲状腺癌细胞的增殖、迁移和侵袭能力,且促进细胞凋亡。目前为止,还没有HAX-1在OSCC发展中作用的相关报道。本研究发现,HAX-1在OSCC组织中表达量显著增加,细胞转染干扰HAX-1表达后,OSCC细胞的活力、增殖和侵袭能力均显著降低,该结果与以上文献中HAX-1在鼻咽癌和甲状腺癌中的作用一致。细胞活力是活细胞的数量的反应,细胞增殖是细胞通过分裂而实现细胞自我更新和繁殖的重要生理过程,两者均可以反映细胞的增殖能力。干扰HAX-1表达后,OSCC细胞的活力和增殖能力显著降低,表明HAX-1沉默可以抑制OSCC细胞增殖能力。另一方面,干扰HAX-1表达后,OSCC细胞侵袭能力的降低表明HAX-1沉默可以抑制OSCC细胞向邻近宿主组织侵犯。上述结果表明HAX-1沉默可抑制OSCC的发生和转移。多个研究指出HAX-1过表达与癌症病理分期及预后差相关[16-17],而HAX-1是否可以作为OSCC预后的标志物有待进一步研究。
原癌基因C-myc属于myc基因家族,是具有多重功能的转录激活因子,参与肿瘤细胞增殖、侵袭和凋亡的调控[18-19]。Tsai等报道表明c-myc可通过调节长链非编码RNA H19 来调控非小细胞性肺癌细胞的增殖能力[20]。Hu等[21]发现c-myc参与Lanatoside C 调控的胃癌细胞的凋亡和增殖过程。另外,干扰c-myc可显著抑制肝癌细胞的增殖和侵袭能力[18]。有文献表明,HAX-1可在内皮祖细胞中调节AKT活性,且AKT可调节食管鳞状细胞癌中调控c-myc表达[22-23]。AKT又称为蛋白激酶B(protein kinase B,PKB),在细胞增殖和凋亡过程中具有重要角色[24]。因此,我们假设在OSCC中HAX-1可通过调控AKT磷酸化来调节c-myc表达量,进而调节OSCC细胞增殖和侵袭能力。本研究中,干扰OSCC细胞HAX-1显著降低AKT磷酸化水平和c-myc蛋白表达量。AKT激动剂SC79(1.5 和2 μg/mL)分别孵育干扰了HAX-1的OSCC细胞24 h,有效提高了AKT磷酸化水平和c-myc蛋白表达量,表明AKT的活化可阻碍OSCC细胞中HAX-1干扰对c-myc蛋白表达量的作用。揭示在OSCC细胞中HAX-1可通过AKT调控c-myc表达。另外,干扰HAX-1的同时过表达c-myc,可明显阻碍HAX-1干扰对OSCC 细胞活力、增殖和侵袭能力的影响。因此,HAX-1可通过AKT调节c-myc的表达,进而调控OSCC细胞的增殖和侵袭的能力,这可能是HAX-1沉默抑制OSCC细胞生长的机制。
本研究存在一些不足:样本量过小,结论有待继续研究,后期实验需要收集更多的样本用以验证HAX-1的表达及其与预后可能的关系。同时,后期拟通过体内动物学实验验证HAX-1在OSCC中的作用机制。综上所述,本实验发现OSCC细胞中HAX-1蛋白表达量上调,且干扰HAX-1显著降低OSCC细胞活力、增殖和侵袭能力。干扰HAX-1还可以通过调控AKT/c-myc信号通路来降低OSCC细胞增殖和侵袭能力。因此,HAX-1有可能作为治疗OSCC的靶标分子。
