乳酸链球菌素与L乳酸对嗜水气单胞菌的协同抑杀作用
2020-08-17王竞儒白东清淡清华余政豪罗云龙
王 洋,王竞儒,白东清,淡清华,于 波,余政豪,罗云龙
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300384)
食源性病原菌是危害食品安全的重要因素之一。嗜水气单胞菌(Aeromonashydrophila,A.hydrophila)是一类革兰氏阴性食源性病原微生物[1],广泛分布于各类环境,尤其是水体环境[2-3]。该菌具有耐药性[4],因形成生物被膜而难以去除[5]。嗜水气单胞菌易污染多种食物,以水产品为主,也能污染畜产品、禽肉以及果蔬[6]。嗜水气单胞菌能够引起冷血动物[7]和温血动物[8]包括人类[9]的疾病,曾引发多起食品安全事件[10-11]。因此控制食品及其原料中的嗜水气单胞菌对于保障食品安全非常必要[3,12]。
乳酸菌对各类食源性病原微生物具有较强的拮抗作用,可用于控制各类食品中的有害微生物[13-14]。乳酸菌的抑菌机理之一是分泌抗菌代谢产物,包括有机酸[15]、细菌素[16]和过氧化氢[17]等。其中L(+)-乳酸是乳酸菌代谢糖类所产生的基本代谢物,对人体无害[18],在一定浓度下对各类革兰氏阴性菌和阳性菌具有广谱抑杀作用[19]。但是革兰氏阴性病原菌,包括嗜水气单胞菌在适应了低浓度乳酸的胁迫后,可产生酸耐受性[20]。乳酸菌细菌素是部分乳酸菌产生的一类对革兰氏阳性菌有显著抑杀作用的肽类(少数乳酸菌细菌素可抑制革兰氏阴性菌)[21]。有研究发现,当细菌素与其他物质如乳酸[22]、精油[23]、EDTA[24-25]、六甲基磷酸钠(sodium hexamethaphosphate)[26]、纳米金粒子[27]、其他抗菌肽[28]共同使用时,对抗性的革兰氏阴性菌也有较好的控制作用。有学者认为低浓度乳酸可造成革兰氏阴性菌非致死伤,使其对细菌素敏感[29]。本团队在前期研究中发现产细菌素特性可提高乳酸菌对革兰氏阴性菌的抑制力[30]。然而目前尚不清楚乳酸与细菌素协同抑菌的作用及机理。
为探讨细菌素与L-乳酸对于革兰氏阴性菌是否具有协同抑制作用,本研究选用目前唯一成熟商业化且最具代表性的I类细菌素-乳酸链球菌素(Nisin)[31-32],研究其与低浓度L-乳酸对重要的革兰氏阴性水产病原菌——嗜水气单胞菌(标准菌株CICC 10500,ATCC 35654)的抑杀作用,为二者或其产生菌在食品中对抗嗜水气单胞菌的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
嗜水气单胞菌CICC 10500(ATCC49140等同菌株)、嗜水气单胞菌ATCC 35654 中科质检有限公司;L-乳酸 纯度>90%,西陇化工股份有限公司;食品级Nisin 天津艾玛斯特生物科技有限公司;尼日利亚菌素、LB培养基 北京陆桥技术股份有限公司。
4MK2全波长多功能酶标仪 美国Thermo Fisher Scientific;Bioscreen全自动生长曲线分析仪 芬兰百奥斯科林;BD Calibur流式细胞分析仪 美国Bioscience;UV-6100S分光光度计。
1.2 实验方法
1.2.1 比浊法检测抑菌活性 将活化好的嗜水气单胞菌接种于LB液体培养基,使得活菌数为1×107CFU/mL。在菌液中分别加入蒸馏水、L-乳酸或Nisin溶液,配制成对照组、3.5 mmol/L L-乳酸处理组、Nisin(0.05 g/L)处理组、3.5 mmol/L L-乳酸+nisin(0.05 g/L)处理组(复合组)。每组样品取100 μL,加入96孔板中,于30 ℃培养12 h,以酶标仪测定OD600值。
1.2.2 生长曲线法测定抑菌能力 将培养12~18 h的菌液接种于LB培养基,使得活菌数为1×107CFU/mL。在菌液中分别加入蒸馏水、L-乳酸或Nisin溶液,制成对照组、3.5 mmol/L L-乳酸处理组、Nisin(0.05 g/L)处理组、3.5 mmol/L L-乳酸+Nisin(0.01 g/L)及3.5 mmol/L L-乳酸+Nisin(0.05 g/L)处理组。每组样品取200 μL,加入生长曲线仪专用培养板中,采用全自动生长曲线分析仪,于30 ℃连续培养至48 h,期间每间隔30 min测定OD600值,绘制生长曲线,以Gomptz模型拟合,计算生长参数。
1.2.3 致死作用 分别收集两株活化好的对数期指示菌,以无菌生理盐水离心洗涤2次(2000×g,4 min,4 ℃),以生理盐水重悬,使活菌数为1×108CFU/mL,然后于30 ℃分别加入生理盐水、3.5 mmol/L L-乳酸、Nisin(0.05 g/L)、3.5 mmol/L L-乳酸+Nisin(0.05 g/L)(复合组),处理后于8 h取样,以梯度稀释平板计数法测定活菌数。
1.2.4 被膜形成情况 生物被膜爬片的制作及观察:分别收集培养至对数末期(约24 h)的两株嗜水气单胞菌,以无菌生理盐水洗3次,去除可能影响生物被膜形成的物质及信号分子。菌体以无菌LB培养基重悬,使得活菌数达到109CFU/mL。在加入预先放置无菌细胞爬片的24孔的聚苯乙稀孔板中,分别设置:对照组、3.5 mmol/L L-乳酸处理组、Nisin处理组、L-乳酸与Nisin协同处理组。30 ℃培养12 h后,参考Djordjevic等[33]方法,以结晶紫染色,以普通光学显微镜观察生物被膜结构。
1.2.5 脂多糖的释放 以嗜水气单胞菌ATCC 35654为代表,将嗜水气单胞菌菌悬液(108CFU/mL)在无菌生理盐水中以0、1、2、3、4 mmol/L L-乳酸在4 ℃处理8 h后,离心(2000×g,4 min,4 ℃)收集上清液,测定上清液在201 nm(脂多糖特征吸收峰)的吸光值,以确定脂多糖(LPS)的释放程度。
1.2.6 膜电动势的测定 使用嗜水气单胞菌CICC 10500成熟期菌体,分别以生理盐水和含3.5 mmol/L L-乳酸的生理盐水在4 ℃静置处理3 h,离心(2000×g,4 min,4 ℃)收集菌体,重悬于含10 mmol/L葡萄糖溶液的生理盐水中,加入10 μL的尼日利亚菌素在室温下放置30 min以消除菌体pH动势,随后加入荧光探针DisC3(5)(终浓度5 μmol/L)于37 ℃放置10 min待用。在96孔板预先分别加入10 μL生理盐水,以及不同浓度的Nisin溶液,加入90 μL处理好的嗜水气单胞菌,立即扫描675 nm荧光值(激发波长660 nm),每30 s扫描一次,连续扫描15 min。
1.3 数据处理
本研究所有数据均用Excel 2003、Origin 8、SPSS 13.0进行分析处理。利用Excel软件计算得出各组数据的标准偏差;利用Origin 8软件绘制散点图、柱状图及折线图;利用SPSS软件进行方差分析。每个实验重复3次,每次重复包含至少3个平行数据。
2 结果与分析
2.1 L-乳酸与Nisin对嗜水气单胞菌生长的影响
探讨乳酸与细菌素Nisin同时存在时对水产革兰氏阴性病原菌的生长影响。考察乳酸菌代谢产物L-乳酸与Nisin对指示菌的生长抑制作用,结果如图1所示。与对照组相比,单独的低浓度L-乳酸对嗜水气单胞菌CICC 10500和ATCC 35654的生长均无显著影响。与L-乳酸处理组相比,Nisin处理组、复合组OD600值均显著下降(P<0.05)。说明在低浓度L-乳酸存在时,Nisin可以显著降低指示菌的生长,L-乳酸与Nisin联合作用对两株嗜水气单胞菌的生长抑制作用最显著。
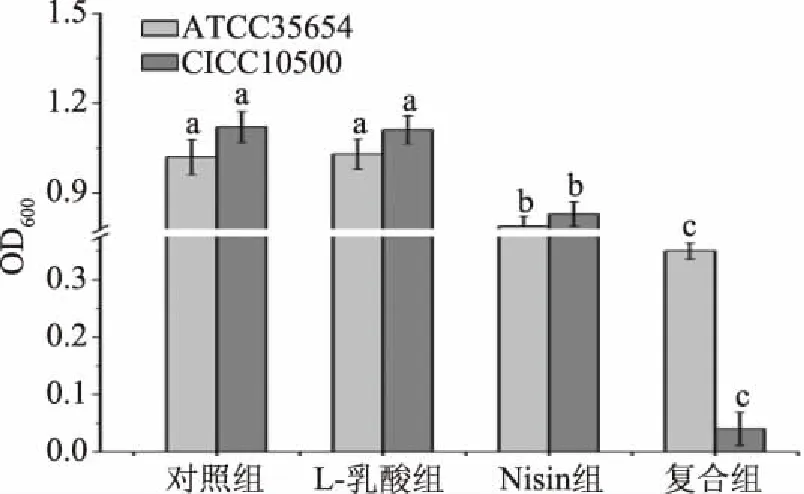
图1 Nisin与低浓度L-乳酸对嗜水气单胞菌的生长抑制作用Fig.1 Synergistic inhibition of low concentration L-lactic acid and nisin on growth of A. hydrophila注:不同小写字母代表相同菌株差异显著(P<0.05);图3、图5同。
2.2 L-乳酸与Nisin影响嗜水气单胞菌生长曲线参数
图2展示了Nisin与L-乳酸对嗜水气单胞菌生长曲线和生长参数的影响。在培养的48 h内,对照组菌体快速增长,OD值迅速增高,很快进入对数期,并在培养的12 h内进入平台期。Nisin添加组与对照组生长趋势相似,并无显著差异。低浓度L-乳酸单独存在时干扰了菌体的生长,而在L-乳酸基础上进一步添加Nisin对2株指示菌的生长均表现出显著的抑制效果,且抑制程度随Nisin浓度的增加而提高。

图2 Nisin与L-乳酸对嗜水气单胞菌生长曲线的影响Fig.2 Interference of growth curve of A. hydrophila pathogen by nisin and L-lactic acid
Nisin和L-乳酸对嗜水气单胞菌的生长参数影响见表1。在Nisin和L-乳酸协同处理下,两株指示菌的生长延滞期、μmax值(最大比生长速率)以及OD600 max值(最大吸光值)均有所下降,且随Nisin浓度越高,各项指标下降趋势越明显。另外,菌株CICC 10500和ATCC35654对Nisin的敏感性不同:在3.5 mmol/L L-乳酸存在时,0.05 g/L nisin使菌株ATCC 35654的延滞期从12.70 h提高至30.40 h,OD600 max值由1.60降低至1.30;而菌株CICC 10500的延滞期从1.73h提高至13.64 h,OD600 max值由14.93降低至0.08。

表1 Nisin在3.5 mmol/L乳酸存在时对嗜水气单胞菌生长曲线主要参数的影响Table 1 Interference of nisin with the combination of 3.5 mmol/L L-lactic acid on the growth parameters of A. hydrophila
2.3 L-乳酸与Nisin对嗜水气单胞菌的协同抑杀作用
采用活菌计数法分析Nisin与L-乳酸协同对嗜水气单胞菌ATCC 35654和CICC 10500的抑杀作用。结果如图3所示,Nisin单独处理对菌体活菌数(7.2×109、7.1×109CFU/mL)较对照组(6.8×109、6.4×109CFU/mL)没有显著影响,3.5 mmol/L L-乳酸处理后活菌数(5.9×109,5.4×109CFU/mL)显著低于对照组(P<0.05),但降低幅度不大。而对于复合组嗜水气单胞菌而言,其活菌数(1.7×109,2.6×109CFU/mL)大幅下降且极显著低于L-乳酸单独处理组(P<0.01)。这表明Nisin与L-乳酸协同处理可引起嗜水气单胞菌菌体细胞死亡,且具有显著的杀伤效果。

图3 Nisin和L-乳酸对嗜水气单胞菌的协同抑杀作用Fig.3 Synergistic lethal effects of nisin and L-lactic acid on A. hydrophila
2.4 L-乳酸与Nisin抑制生物被膜的形成
图4展示了乳酸和Nisin处理对嗜水气单胞菌生物被膜形成的影响,对照组(图4(1A)、图4(2A))嗜水气单胞菌的菌体大量成片聚集在爬片上,菌体密集,取出爬片时肉眼即可观察到菌致密地粘附在玻片上。0.05 g/L Nisin处理组(图4(1B)、图4(2B))生物被膜的形成效果与对照组相似,有较多的菌体平铺在爬片上。3.5 mmol/L L-乳酸处理后(图4(1C)、图4(2C)),菌体并没有铺满整个视野,且在爬片表面形成一些空洞区域且结构较为松散。而乳酸和Nisin协同处理组(图4(1D)、图4(2D))的生物被膜,结构松散,不密集,也未观察到较大的团块状结构。表明乳酸和Nisin协同处理对两株嗜水气单胞菌生物被膜的形成有抑制作用。

图4 L-乳酸与Nisin对嗜水气单胞菌生物被膜形成的影响(1000×)Fig.4 Effect of L-lactic acid and nisin on the biofilm formation of A. hydrophila(1000×)注:A:对照组;B:乳酸组;C:Nisin组;D:协同组。
2.5 L-乳酸处理对嗜水气单胞菌外膜LPS释放的影响
如图5所示,经L-乳酸处理8 h后,上清液中LPS特征吸收峰201 nm的吸光值与对照组(L-乳酸浓度为0 mmol)相比增加;且4 mmol/L L-乳酸处理组峰值最高,显著高于其余处理组(P<0.05)。表明L-乳酸处理可能破坏了菌体外膜(细胞壁),使LPS释放到上清液中。
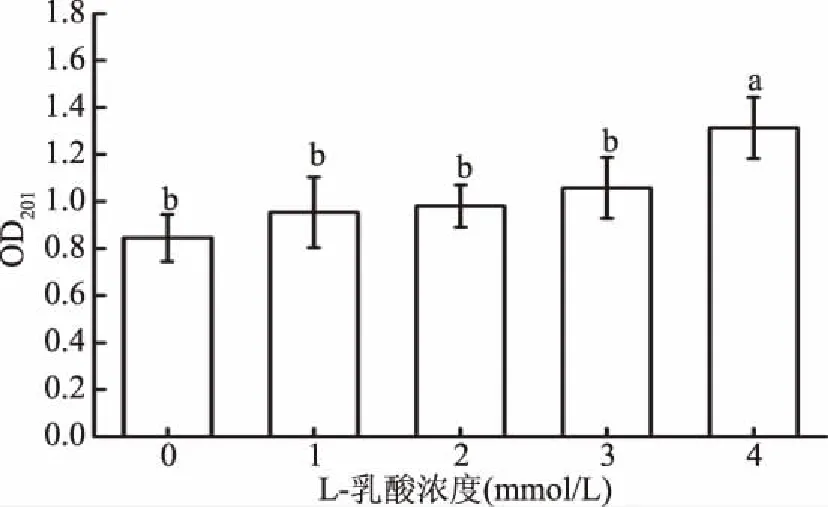
图5 不同浓度L-乳酸处理嗜水气单胞菌后LPS释放效果Fig.5 LPS released effect after the treatment of A. hydrophila with different concentrations of L-lactic acid
2.6 Nisin对L-乳酸处理后嗜水气单胞菌细胞膜电动势的影响
以嗜水气单胞菌CICC 10500为代表检测其经过3.5 mmol/L L-乳酸处理后的膜电动势变化(图6)。在15 min的测定时间内,对照组菌液荧光强度逐渐下降,10 min时趋于平缓。Nisin处理荧光值一开始与对照组一致呈下降趋势,但在6 min后逐渐升高。荧光探针DiSC3(5)富集在极化的细胞膜周围,当插入细胞膜后荧光淬灭。如果荧光值增加,表明细胞膜电动势消散。如图6所示,Nisin使经过L-乳酸处理的嗜水气单胞菌菌体膜电动势消散。这与Nisin作用于革兰氏阳性敏感菌的机理类似。
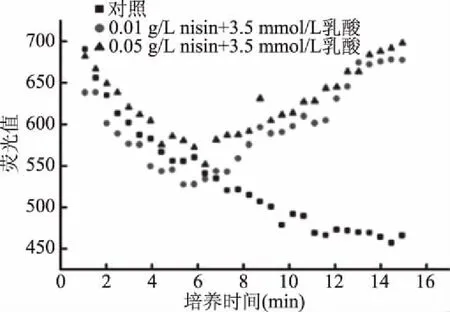
图6 乳酸与Nisin对菌体膜电动势的影响Fig.6 The effects of lactic acid and nisin on electromotive force of bacterial membrane
3 讨论
3.1 Nisin与L-乳酸对嗜水气单胞菌有生长抑杀作用
本研究发现Nisin单独处理对两株嗜水气单胞菌均无生长抑制或者致死作用,这与大部分报道类似,即Nisin对革兰氏阴性菌的作用有限[34]。试验显示低浓度细菌素Nisin对嗜水气单胞菌有小幅度的生长促进作用。目前尚未研究其机理,也没有找到相关研究文献。推测该类肽可能作为菌体生长的营养物质,或者作为信号物质影响菌体代谢,从而促进菌体生长。
单独低浓度L-乳酸处理对两株嗜水气单胞菌具有一定的生长抑制作用。L-乳酸为弱酸,可以完整分子形式进入细胞,然后解离为质子,给细胞带来毒性,并导致生长抑制和死亡[35],当以Nisin与L-乳酸协同处理嗜水气单胞菌时,菌体的生长进一步受到抑制,致死率显著升高(P<0.05),且抑制强度或者致死力随着Nisin浓度的增加而提高。这种抑制率或致死率的浓度依赖性与Nisin对敏感阳性菌的作用相似[36]。通过Gomptz模型拟合生长曲线,发现Nisin和L-乳酸协同处理显著延长了嗜水气单胞菌的生长延滞期,降低了菌群的最大比生长速率和平台期的最高活菌浓度。这一结果提示,当Nisin和低浓度L-乳酸共同存在时,可以有效延缓和限制嗜水气单胞菌群体的增殖。关于L-乳酸与Nisin对革兰氏阴性菌的协同抑制作用的报道很少。Nykänen等[22]研究发现含有Nisin的发酵物与乳酸对革兰氏阴性菌—荧光假单胞菌及铜绿假单胞菌有协同抑制作用。此外,Nisin与有机酸对革兰氏阳性菌,如单核增生李斯特菌[37]、无害李斯特氏菌[38]也有协同抑制作用。探讨多种细菌素与乳酸对各类革兰氏阴性病原菌的抑制作用,将有助于进一步了解细菌素和乳酸的协同抑菌能力。
3.2 Nisin与L-乳酸降低嗜水气单胞菌的毒性
嗜水气单胞菌易形成生物被膜,生物被膜对消毒剂[39]、抗生素[40]以及不良环境有较强的抵抗力,这一特征使其容易在食品加工器具表面附着,造成持续性的危害[36]。本文证明Nisin和L-乳酸可协同降低嗜水气单胞菌形成的生物被膜量。本文用于研究被膜形成的初始菌密度较高(达到了在LB培养基中的成熟期最高值),可以排除Nisin和L-乳酸对菌体生长抑制而产生的对生物被膜形成的影响。推测二者协同干扰了菌体代谢,影响被膜形成过程中必须的信号物质,或者导致部分菌体死亡,使其无法参与生物被膜的形成。从抑制被膜形成的角度而言,Nisin和L-乳酸共同存在时更有利于降低嗜水气单胞菌的毒性。
3.3 Nisin与L-乳酸协同抑制嗜水气单胞菌的机理
细菌素的抑菌机制大致分为三类:抑制细胞壁的合成[41]、作用于细胞质膜[42]、影响细胞基因表达和蛋白质合成[33]。本研究所选用的Nisin可作用于革兰氏阳性菌的细胞壁磷脂II,干扰细胞壁的合成[43],或作用于细胞质膜形成孔洞,破坏细胞膜电位[44-45],导致细胞生长抑制或者死亡。嗜水气单胞菌的细胞壁(外膜)没有Nisin的作用位点,因此Nisin最有可能作用于细胞质膜发挥作用。然而革兰氏阴性菌细胞壁(外膜)有LPS保护,因此细菌素无法靠近细胞质膜。通过低浓度L-乳酸处理,发现嗜水气单胞菌的外膜LPS释放到上清液中。进一步用Nisin处理后,观察到Nisin可以使经过L-乳酸处理后的菌体膜电动势消散。表明Nisin与L-乳酸协同抑制嗜水气单胞菌的机理可能是:L-乳酸破坏嗜水气单胞菌的细胞壁(外膜),使得Nisin能够接触到细胞质膜,进而发挥抑菌作用。另一方面,Nisin对细胞膜的破坏作用,可能进一步增强了L-乳酸进入菌体发挥作用。因为许多学者曾报道过Nisin通过提高膜的通透性而增强了一些细菌素如LysH5[46],抗生素对病原菌的抑制[47-48]。此外,有学者认为氢键在Nisin的抑菌作用中发挥了重要作用[49]。Adhikari等[50]利用够可以产生氢键的有机酸与Nisin共同制备复合物,发现该复合物对敏感菌的抑制能力增强,但他们并未探讨复合物对革兰氏阴性菌的抑制作用。进一步分析Nisin与L-乳酸在溶液中是否发生相互影响,Nisin作用过程中在菌体上的定位,是否有锚定分子,Nisin作用后胞内L-乳酸含量等,将有助于深入揭示Nisin与乳酸协同抑菌的机理。
4 结论
Nisin与低浓度L-乳酸可以协同抑制嗜水气单胞菌生长,使菌体死亡,干扰生物被膜的形成,降低菌体毒力。协同作用机理可能是:L-乳酸破坏嗜水气单胞菌的细胞壁(外膜),使Nisin能够接触到细胞质膜,进而发挥抑菌作用。进一步分析各类细菌素与L-乳酸对革兰氏阴性病原微生物的抑制作用及机理,对被膜态革兰氏阴性菌的控制作用,将进一步拓展细菌素和L-乳酸在食品生产、加工及保鲜中的应用范围,为新型细菌素的设计或已知细菌素的新应用提供新思路。
