递推式ARTPUV复合诱变筛选高产β葡萄糖苷酶菌株
2020-08-17夏俊芳王小灵古丽娜孜韩贵林
夏俊芳,王小灵,古丽娜孜,韩贵林,武 运
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
β-葡萄糖苷酶(EC 3.2.1.21)是从糖苷前体释放单萜物质的关键酶[1],能够水解葡萄汁糖苷结合态香气前体,释放挥发性糖苷配基,形成浓郁丰富的葡萄酒风味。葡萄酒中的糖苷酶可来源于葡萄果实、酵母菌(酿酒酵母和非酿酒酵母)、乳酸菌及商品化外源性酶制剂[2],早在1989年Laffort等[3]研究发现酵母菌株可以通过水解共轭芳香前体来改善和增强葡萄酒的香气,但从自然环境分离得到的野生型菌株的产β-葡萄糖苷酶能力有限,已有学者利用紫外诱变、硫酸二乙基酯、亚硝基胍、紫外-亚硝基胍-Co60复合诱变、紫外-甲基磺酸乙酯复合诱变等物理、化学方法筛选得到产β-葡萄糖苷酶的菌株。张莉等[4]通过紫外诱变得到产β-葡萄糖苷酶稳定的突变菌株UV-45,酶活达到75.34 U/mL,较出发菌株提高41.64%;王婧等[5]通过硫酸二乙酯(DES)诱变得到产β-葡萄糖苷酶稳定的突变菌株UV-E-16,酶活达到74.26 U/mL;刘文龙等[6]通过亚硝基胍诱变获得产β-葡萄糖苷酶的突变株AN-17,酶活达到291 U/mL;陈军杰等[7]通过紫外-亚硝基胍-Co60复合诱变获得产β-葡萄糖苷酶的突变菌株N-9,酶活力稳定在8.5 U/mL左右,是原出发菌株的2.1倍;郑贤金等[8]通过紫外—甲基磺酸乙酯复合诱变获得产β-葡萄糖苷酶突变菌株TZ-03,酶活达到10.53 IU/mL,是原出发菌株的 1.52倍。但这些常规物理、化学诱变法对操作员的健康和突变效率都存在一定程度上的风险[9]。
近年来,一种新型诱变育种方法——常压室温等离子体诱变(ARTP)因其突变速度快、突变体多样性强、操作简单安全等特点引起了人们的广泛关注[10],与其它诱变方法相比,ARTP处理对活细胞的DNA损伤更明显,突变率更高[11]。ARTP采用99.999%的高纯氦气(He)为出发气体在高频电场中产生富含活性的高能粒子,高能粒子作用于整个微生物细胞改变了细胞壁和细胞膜的结构及通透性并造成细胞损伤,生物细胞被迫开启SOS修复机制,引起基因突变使微生物基因序列及其代谢网络发生显著变化,最终获得大量稳定的突变菌株,ARTP能有效地引起DNA的多样性损伤,增加诱变突变率且不产生有毒有害物质[12],它已成功地用于细菌[13-14]、酵母菌[5,15]、霉菌[16-17]、食用菌[18-19]等生物育种以提高生物量和代谢产物。仅进行一轮ARTP诱变,不可能获得理想的突变体,为了获得预期的目标,可采用递推式ARTP方法以获得更多的突变体,Jiang等[20]采用8轮递推式ARTP诱变提高茂原链霉菌产转谷氨酰胺酶能力;也可采用ARTP与其它诱变方法联合来提高整体诱变效率,如联合采用硫酸二乙酯[21]、亚硝基胍[22]、紫外辐射[23]来提高诱变效率。
本研究对前期赤霞珠(Cabernetsauvignon)自然发酵过程中的两株野生酿酒酵母G13、G21菌株采用递推式ARTP-UV复合诱变,以β-葡萄糖苷酶活力为主要筛选指标,旨在获得高产β-葡萄糖苷酶的酵母菌株并为其后续在葡萄酒酿造及提升葡萄酒香气中的应用奠定基础。
1 材料与方法
1.1 材料与仪器
出发菌株:产β-葡萄糖苷酶优良酵母G13酿酒酵母(Saccharomycescerevisiae)、G21酿酒酵母(Saccharomycescerevisiae) 新疆农业大学食品科学与药学学院微生物实验室;商业酵母D254 烟台帝伯仕自酿机有限公司;YPD固体培养基:葡萄糖20 g/L、酵母膏10 g/L、蛋白胨20 g/L、2%琼脂;YPD液体培养基:葡萄糖20 g/L、酵母膏10 g/L、蛋白胨20 g/L 均为北京奥博星责任有限公司;以上培养基均以121 ℃灭菌15 min后备用;初筛培养基:葡萄糖20 g/L、酵母膏10 g/L、蛋白胨20 g/L、2%琼脂,灭菌后温度降至60 ℃加入1 g/L p-NPG;p-NPG(pH5.0的柠檬酸-磷酸盐缓冲液配制) 美国Sigma 公司;对硝基苯酚 上海阿拉丁生化科技股份有限公司。
FE20 PLUS pH计 上海梅特勒托利多仪器有限公司;DJ100-3型电子分析天平 上海恒平科学仪器有限公司;DY04-13-44-00压力蒸汽灭菌器 上海东亚压力容器制造有限公司;722可见分光光度计 上海欣茂仪器有限公司;THZ-98AB恒温培养振荡箱 上海一恒科学仪器有限公司;HSY2-SP电热恒温水浴锅 北京市永光明医疗仪器厂;HR40-IIAI生物安全柜 青岛海尔特种电器有限公司;ARTP诱变育种仪 无锡源清天木生物科技有限公司。
1.2 实验方法
1.2.1 孢子悬液的制备 将保藏的G13、G21菌株接种到斜面中,28 ℃培养48 h,然后将斜面上的菌种接种到100 mL YPD液体培养基中,在28 ℃,200 r/min恒温振荡箱中培养18 h,经稀释倒平板计数,G13菌悬液浓度为3.5×108CFU/mL,G21菌悬液浓度为1.08×108CFU/mL。
1.2.2 生长曲线绘制 将108CFU/mL的G13、G21菌株以5%接种量分别接种到灭菌的含100 mL YPD液体培养基的三角瓶中,于28 ℃,200 r/min摇瓶培养4、8、12、16、20、24、28、32、36、40、44、48、52、56、60 h后分别在OD600下测吸光值(未接菌的发酵液体培养基作为空白对照),以培养时间为横坐标,OD值为纵坐标,绘制菌株生长曲线图。
1.2.3 ARTP诱变 按照ARTP生物诱变仪的操作流程,以高纯氦气为工作气体,无菌条件吸取10 μL 1.2.1制备的孢子悬液均匀涂布于载片表面,功率为120 W,等离子体的温度为30 ℃,气流量为10 SLM,工作距离为2 mm。处理时间分别为30、60、90、120、150、180 s,涂布于YPD平板,28 ℃避光培养48 h,计算不同处理时间的致死率,公式如下:
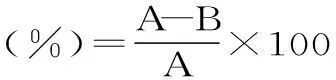
其中:菌液处理时间0为对照组,稀释涂布菌落计数为A,菌液处理一定时间为实验组,稀释涂布菌落计数为B。
测定突变株酶活,以相对于出发菌株酶活增长20%为正突变,每个处理挑取200株以上突变株测定酶活,以减少酶活测定误差带来的正突变率计算误差,计算诱变正突变率,公式如下:

其中:实验组菌株产酶活高于出发菌株20%的突变株计数为C。
通过致死率和正突变率来确定G13、G21菌株ARTP诱变最佳处理时间。
1.2.4 紫外诱变(UV) 取1.2.1制备的孢子悬液5 mL于无菌平皿中,紫外(功率15 W,灯距30 cm),照射30、60、90、120、150、180 s。将诱变处理后的孢子悬液适当稀释涂布于YPD平板,28 ℃避光培养48 h,根据1.2.3计算致死率和正突变率,通过致死率和正突变率来确定G13、G21菌株UV诱变最佳处理时间。
1.2.5 ARTP诱变菌株的筛选 G13菌株经ARTP120 s诱变后,G21菌株经ARTP 90 s诱变后,在平皿上各挑取15个菌落直径比较大的单菌落,依次编号(如GD13-13表示ARTP诱变120 s的第13号菌株),进行摇瓶发酵,测β-葡萄糖苷酶酶活。
1.2.6 递推式连续ARTP诱变 选育连续3轮ARTP诱变,选择β-葡萄糖苷酶产量最高的突变菌株,作为下一轮ARTP诱变的起始菌株。
1.2.7 递推式ARTP-UV复合诱变 以1.2.6每轮ARTP诱变的最高酶活的突变菌株,作为下一轮UV诱变的起始菌株,进行2轮UV诱变。
1.2.8 产β-葡萄糖苷酶菌株筛选 将诱变后长出的菌落,选择较大、圆满、香味浓郁的菌落划线接种在初筛平板上,28 ℃培养48 h,根据黄色光圈选取单个菌落接种于YPD液体培养基,进行摇瓶发酵,发酵条件为28 ℃、200 r/min,培养48 h后测定酶活,选出高产β-葡萄糖苷酶活菌株。
1.2.9β-葡萄糖苷酶活性的测定 参照侯晓瑞等[24]的方法,对硝基苯酚标准曲线回归方程为:Y=20.607X+0.0119,决定系数R2=0.9996,吸光度与对硝基苯酚含量成线性关系。吸取0.1 mL粗酶液与0.2 mL 35 mmol/L p-NPG(即以pH=5.0的柠檬酸-磷酸盐缓冲液配制而成)混匀,50 ℃保温10 min,加入2 mL 1 mol/L Na2CO3溶液终止反应并显色,于400 nm下测定吸光值。以加热灭活的酶液同样处理做空白对照并测定吸光值。
酶活力计算公式如下:
式中:U为酶活力单位,U/mL;C为对硝基苯酚(p-NPG)的浓度,μmol/L;V为反应体系的体积,mL;N为原酶液稀释倍数;t为反应时间,min;0.1为所取上清液或细胞液的体积。
酶活力定义:酶活力单位(U)定义为在pH5.0,50 ℃反应条件下,1 min水解1 nmol p-NPG所需要的酶量。
1.2.10 传代稳定性试验 将酶活力高的突变菌株在YPD液体培养基中连续5代培养,培养条件为28 ℃,200 r/min恒温振荡箱中培养48 h,按照1.2.9对产β-葡萄糖苷酶活性测定,检测突变菌株的遗传稳定性。
1.3 数据处理
所有数据均为3次平行实验的平均值,数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序,差异显著性(P<0.05)分析使用 Tukey HSD程序,采用Excel 2016整理实验数据,作图。
2 结果与分析
2.1 G13、G21生长曲线绘制
菌株G13、G21生长曲线如图1所示,接种4 h内菌体浓度没有变化,是菌株延滞期;4 h 后G13、G21进入对数生长期,当适应环境后4~24 h菌株进入生长对数期;28 h后,菌体分解代谢与合成代谢的速度基本一致,菌体进入稳定期。由于对数生长期的细胞为生理活性旺盛,突变率高,重现性好,菌体活力旺盛,故后续试验选择培养18 h的菌体进行诱变处理。

图1 菌株G13、G21的生长曲线Fig.1 Growth curve of G13 and G21
2.2 ARTP诱变时间优化
如图2所示,随着处理时间的增加,菌体的致死率逐渐增大,菌株G13处理120 s时,G13致死率为92.70%,正突变率达到最大为19%;菌株G21处理90 s时,G21致死率为92.29%,正突变率达到最大为20%;处理150 s时,G13、G21致死率分别达到97.65%、97.20%;处理180 s时,ARTP的致死率分别为98.50%、99.00%,表明ARTP的诱变作用非常剧烈。李小坤等[25]利用常压室温等离子体诱变技术选育高核酸酿酒酵母及其特性时,分析致死率90%~95%时突变效应最强,本试验结合正突变率,G13菌株ARTP诱变最佳处理为120 s,G21菌株ARTP诱变最佳处理为90 s。
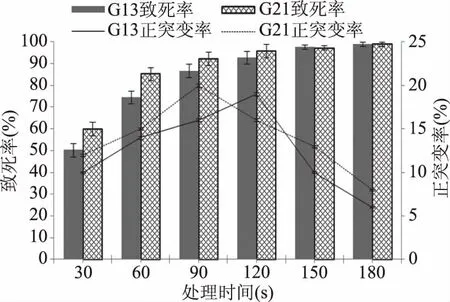
图2 ARTP诱变时间对G13、G21菌株致死率、正突变率的影响Fig.2 Influence of ARTP radiation timeon mortality and mutation rate on G13 and G21
2.3 UV诱变时间优化
由图3可知,随着紫外处理时间的增加,菌体的致死率逐渐升高,紫外诱变照射时间不短于10~20 s,不长于10~20 min,菌株G13、G21处理时间90 s时,G13致死率约为91.5%,正突变率达到最大为17%,G21致死率约为90.2%,正突变率达到最大为19%。致死率90%~95%时突变效应最强,结合正突变率,G13、G21菌株UV诱变最佳处理时间均为90 s。

图3 紫外诱变时间对G13、G21菌株致死率、正突变率的影响Fig.3 Influence of UV radiation timeon mortality and mutation rate on G13 and G21
2.4 ARTP诱变菌株的确定
表1列举了β-葡萄糖苷酶活性较高的部分代表菌株,经过ARTP诱变所得菌株最高酶活为GD13-09和GD21-12,酶活分别达到156.95、132.72 U/mL是出发菌株G13、G21菌株酶活的3.0和2.7倍,表明通过ARTP诱变获得的菌株酶活能力明显高于出发菌株G13、G21。
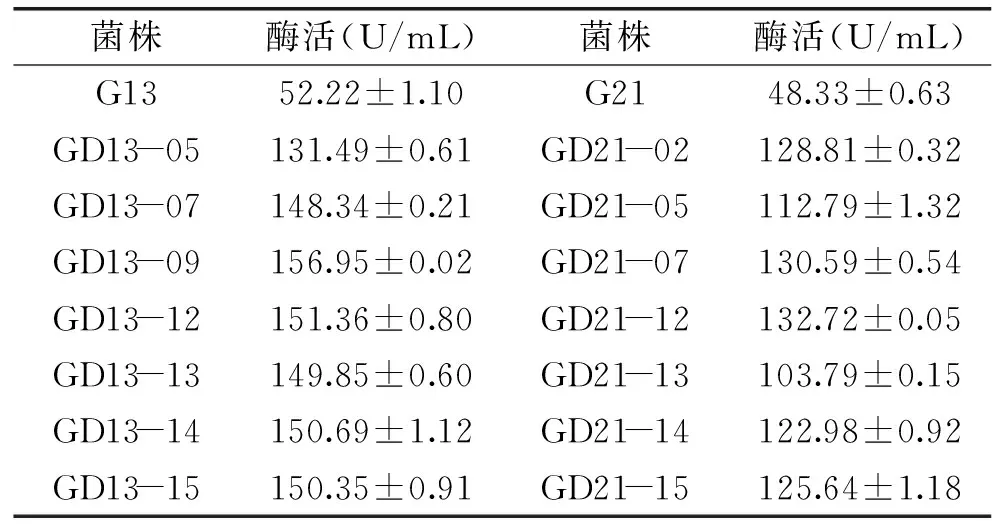
表1 ARTP诱变菌株的初筛结果(部分代表菌株)Table 1 Preliminary screening results ofARTP mutant strains(Partial representative strains)
2.5 ARTP传代稳定性试验结果
GD13-09和GD21-12两菌株在ARTP传代中酶活的稳定性结果见表2,同菌株不同传代次数产酶活力比较,GD13-09和GD21-12菌株前两代菌株产酶活力稳定性差异不显著(P>0.05),传至第三代菌株产酶能力降低,酶活稳定性差异显著(P<0.05),表明ARTP传代稳定性不稳定,故后续实验开展递推式复合诱变。

表2 ARTP传代稳定性(酶活,U/mL)Table 2 Stability test of ARTP consecutive generation of two mutant strains(enzyme activity,U/mL)
2.6 递推式连续ARTP诱变
每轮进入摇瓶复筛的突变株发酵的酶活统计分别如图4~图6所示。图中,最左侧的菌株为该轮筛选的出发菌株,即上一轮筛选得到的产β-葡萄糖苷酶酶活最高的菌株。
图4,第一轮ARTP诱变,G13D1-Dea组的酶活最高,达到了156.95 U/mL;G21D1-Dba组的酶活最高,达到了132.72 U/mL,故选择G13D1-Dea和G21D1-Dba这两组菌中的高产菌株作为第二轮ARTP诱变的出发菌株。
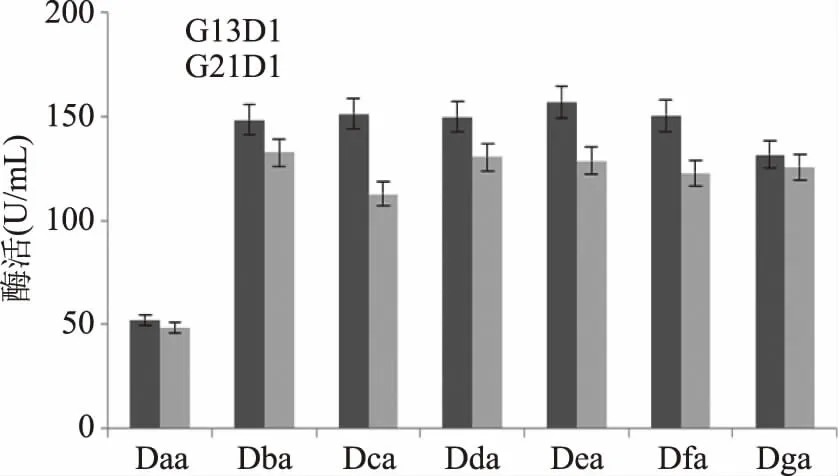
图4 第一轮ARTP诱变筛选菌株发酵酶活统计Fig.4 Statistic results of screeningin ARTP fermentation for the first round
图5,第二轮ARTP诱变,G13D2-Dka组的酶活最高,达到了187.86 U/mL;G21D2-Dma组的酶活最高,达到了175.24 U/mL,故选择G13D2-Dka和G21D2-Dma这两组菌的高产菌株作为第三轮ARTP诱变的出发菌株。

图5 第二轮ARTP诱变筛选菌株发酵酶活统计Fig.5 Statistic results of screening inARTP fermentation for the second round
图6,第三轮ARTP诱变,第二轮的起始酶活组G13D3-Dva、G21D3-Dva酶活最高,排除出发菌株酶活,第三轮诱变的最高酶活组是G13D3-Dbb酶活为178.32 U/mL,G21D3-Dwa组酶活为160.62 U/mL。相比前两轮诱变,第三轮菌株酶活降低,表明连续三轮ARTP诱变突变库菌株生长变慢,不利于进一步诱变筛选进行,因此结合传统的紫外诱变方法进行复合处理。

图6 第三轮ARTP诱变筛选菌株发酵酶活统计Fig.6 Statistic results of screening inARTP fermentation for the third round
2.7 递推式ARTP-UV复合诱变
第一轮G13菌株ARTP-UV复合诱变的结果如图7、图8所示,分别选择ARTP三轮的高产酶活菌株进行UV诱变90 s,图7表明,G13复合诱变的高酶活组是Dbb,平均酶活达到了191.52 U/mL;图8表明,G21复合诱变的高酶活组是Dma,平均酶活达到了176.15 U/mL。

图7 第一轮G13-ARTP-UV诱变筛选菌株发酵酶活统计Fig.7 Statistic results of G13 screening inARTP-UV fermentation for the first round注:Dea组:G13第一轮ARTP最高酶活菌株组,Dka组:G13第二轮ARTP最高酶活菌株组,Dbb组:G13第三轮ARTP最高酶活菌株组,每组选取4株产酶菌株,图中不同底纹代表不同菌株;图9同。

图8 第一轮G21-ARTP-UV诱变筛选菌株发酵酶活统计Fig.8 Statistic results of G21screening inARTP-UV fermentation for the second round注:Dba组:G21第一轮ARTP最高酶活菌株组,Dma组:G21第二轮ARTP最高酶活菌株组;Dwa组:G21第三轮ARTP最高酶活菌株组,每组选取4株产酶菌株,图中不同底纹代表不同菌株;图10同。
第二轮ARTP-UV复合诱变的结果如图9、图10所示,第一轮ARTP-UV复合诱变的三组高产酶活组菌株再进行UV诱变90 s,由图9可知,G13复合诱变的高酶活组是Dea组,平均酶活达到了231.53 U/mL;由图10可知,G21复合诱变的高酶活组是Dma组,平均酶活达到了177.81 U/mL。对诱变酶活统计,G13、G21最高酶活诱变方式是一轮ARTP诱变两轮UV诱变,经过递推式复合诱变,极大地提高了菌株的产酶能力。

表3 ARTP-UV传代稳定性试验(酶活,U/mL)Table 3 Stability test of ARTP-UV consecutive generation of two mutant strains(cnzyme activity,U/mL)
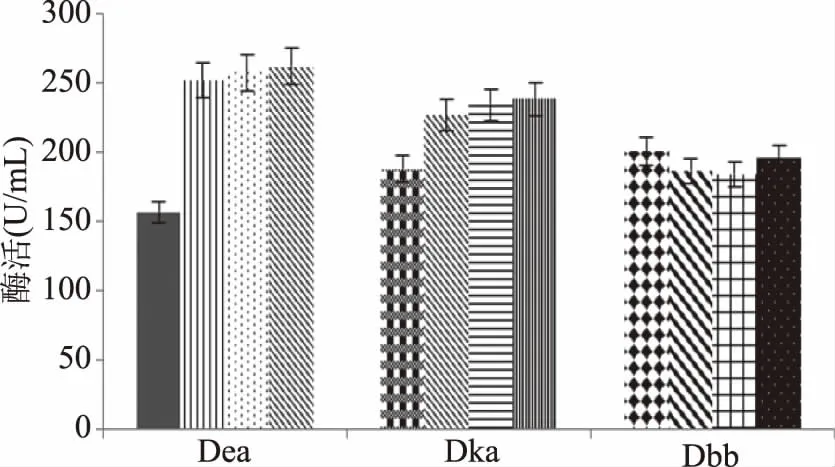
图9 第二轮G13-ARTP-UV诱变筛选菌株发酵酶活统计Fig.9 Statistic results of G13 screening inARTP-UV fermentation for the first round

图10 第二轮G21-ARTP-UV诱变筛选菌株发酵酶活统计Fig.10 Statistic results of G21 screening inARTP-UV fermentation for the second round
2.8 递推式复合(ARTP-UV)传代稳定性分析
由表3,经过5轮传代ARTP-UV复合诱变筛选的菌株酶活遗传稳定性差异不显著(P>0.05),平均酶活分别是出发菌株G13(52.22 U/mL)、G21(48.33 U/mL)的4.61倍和3.59倍。采用递推式ARTP-UV复合诱变技术作为新型的诱变方法,对产β-葡萄糖苷酶菌株的诱变选育而言,具有良好的突变效果。
3 结论与讨论
ARTP诱变技术是一种新型诱变育种技术,具有快速、有效、安全、操作简便、环境友好、对操作者安全无辐射、正突变率高等优点,已被广泛用于微生物育种。ARTP可在常压室温下均匀产生各种活性粒子,这些活性粒子可以穿透细胞壁和细胞膜,破坏DNA分子,引起突变,从而改变目标微生物的代谢网络,获得大容量突变库[18]。与常规化学诱变相比,ARTP有很强的基因损伤能力,Zhang等[26]以沙门氏菌NM2009为模型菌株,通过ARTP、UV、和化学诱变处理对DNA损伤进行定量评价和比较,发现ARTP对单个活细胞的DNA损伤更大,由于DNA损伤是生物突变的根源[27],因此,ARTP确实能够作为微生物诱变的有效手段,并在生物诱变育种方面具有广阔的应用前景。
诱变的方式包括单一诱变剂连续诱变或多种诱变剂交替以及连续诱变,Zou等[11]采用两轮ARTP诱变紫色白僵菌得到AR01菌株产CoQ10产量比原菌株高25.5%,Luo等[28]采用30轮ARTP诱变得到30000突变体,在500 mL摇瓶和3 L发酵罐中,筛选出H6突变体产丙酮酸产量较原始菌株分别高出32.2%和35.4%。也有很多研究采用多种复合诱变的方法以提高菌株产相应代谢产物含量能力,Li等[21]采用ARTP结合硫酸二乙酯选育出高产花生四烯酸的突变菌株D20,其活力较原始菌株提高了40.61%;Feng等[17]联合采用微波诱变、紫外线诱变、热氯化锂、ARTP 联合诱变米曲霉KA-11得到高产曲酸的AR-47突变菌株,曲酸含量为96.5 g/L。刘文龙等[29]将ARTP与紫外线复合诱变选育高产酸性蛋白酶黑霉菌株SA-08,其活力较出发菌株提高83.71%;任林英等[30]采用紫外与ARTP复合诱变技术对子囊霉素产生菌吸水链霉菌进行诱变处理,其产子囊霉素能力较出发菌株提高4倍以上,发酵单位达568.0 μg/mL;高芳霞等[31]采用ARTP与紫外诱变技术对达托霉素产生菌玫瑰孢链霉菌进行复合诱变获得一株达托霉素产量达到3.9 g/L的突变株Q12-63#,发酵单位较出发菌株提高了37%。Ottenheim C 等[32]也提出由于缺乏比较研究,不能简单得出结论:递推式ARTP诱变或者ARTP与传统诱变方法组合优于单一的ARTP诱变。
本研究将ARTP与UV结合,采用递推式连续诱变筛选出具有高产β-葡萄糖苷酶的突变株Dea-G13D1Z2和Dma-G21D1Z2,突变菌株在液体发酵培养基中于28 ℃,200 r/min摇床发酵48 h,经过5轮传代,遗传稳定性能良好,产β-葡萄糖苷酶平均活性分别为240.93和173.38 U/mL,为出发菌株G13、G21的4.61倍和3.59倍,此酶活力也普遍高于已经报道的酿酒酵母产β-葡萄糖苷酶菌株的酶活[4-5],后续实验需进一步优化发酵工艺条件,以最大限度地发挥菌株的优良性能,提高产量。
