乌龙茶加工过程中α法呢烯的形成关键调控基因的筛选与表达分析
2020-08-17,,,,*
,,,,*
(1.福建农林大学园艺学院/茶学福建省高校重点实验室,福建福州 350002;2.福建农林大学园艺植物生物工程研究所,福建福州 350002)
α-法呢烯(C15H24)是最简单的非环状倍半萜类次生代谢物质[1](图1)。作为植物中具挥发性的花果香成分[2],在诱导昆虫产卵[3]、植物防御[4]、生长调控[5]等方面具有重要作用。α-法呢烯合成酶(AFS)属于2-甲基-D-赤藻糖醇-4-磷酸途径(MEP途径)和甲羟戊酸途径(MVA途径)的下游限速酶[6],直接参与了α-法呢烯的后期合成。现代科学对于α-法呢烯的研究与应用已经深入食品工业、医疗工业等领域[7]。
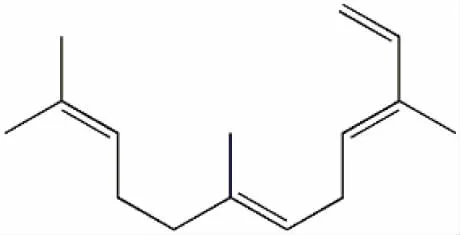
图1 α-法呢烯化学结构式Fig.1 Chemical structure of α-farnesene
茶树鲜叶经萎凋、做青、杀青等加工工艺,促使香气物质前体发生一系列水解和转化[8],从而形成了乌龙茶天然花果香的品质特点。α-法呢烯是乌龙茶成茶重要赋香物质之一,在乌龙茶中呈花果香[9]。与果树[10-11]、烟草[12]等植物中α-法呢烯代谢不同,茶树叶片在遭受胁迫时会释放α-法呢烯作为响应。Wang等[13]研究发现,虫咬等生物胁迫促使茶树释放茉莉酸,诱导CsAFS基因上调表达,促使α-法呢烯的合成释放;同时,α-法呢烯可充当信号因子传递给其它未受生物胁迫的茶树,有助于研究茶树抵抗环境胁迫及茶树植物应激激素的释放。在茶叶采摘离体后,茶叶加工过程中所施加的外源胁迫因子,如失水可明显改变做青叶的香气组成模式,α-法呢烯等物质含量逐渐增多[14];机械力反复作用下的摇青叶形成丰富的香气物质,有助于形成乌龙茶的花果香[15-16];光照[17-18]、温度[19-20]激活了叶片中的MEP和MVA途径。香气是乌龙茶品质的核心因素之一[21]。前人的研究中,多是研究乌龙茶的香气组成及比较不同品种乌龙茶的赋香物质,如黄福平等[22]认为与肉桂茶品质密切相关的特征性香气组分主要有橙花叔醇、己酸己烯酯、α-法呢烯、芳樟醇等;陈荣冰等[23]对比黄旦与瑞香的香气差异,认为两种乌龙茶各自的品种香主要是因为橙花叔醇、香叶醇、α-法呢烯等物质的含量存在差异。亦有研究比较不同工艺处理下的同一品种乌龙茶的香气组分,如陈林等[24]通过调控铁观音制作工艺,调控乌龙茶做青与烘干工序,做成不同风味的铁观音,利用铁观音新茶与陈茶香气组成的化学模式的差异,提出橙花叔醇、α-法呢烯、吲哚等物质可以作为区分铁观音新茶和陈茶的主要特征香气成分。然而,结合茶树次生代谢途径,就某单一的特征香气形成和变化的研究,却不多见。
萜类化合物是植物的次生代谢物[25],伴随着茶树生长与茶叶采摘加工过程中的生物胁迫诱导子和非生物诱导子会影响次生代谢物的产生[26]。陈寿松等[27]认为,乌龙茶中的倍半萜类,如橙花叔醇、α-法呢烯呈现宜人的花果香,其香味阈值对乌龙茶的风味形成贡献很大。本研究以乌龙茶鲜叶、萎凋叶、做青过程叶为研究试材,通过检测样品中α-法呢烯的相对含量,计算基于转录组数据筛选出α-法呢烯合成酶关键基因并验证其相对表达水平,分析研究乌龙茶加工过程中α-法呢烯合成的分子机制,以期为今后研究乌龙茶花果香的形成提供参考和借鉴。
1 材料与方法
1.1 材料与仪器
黄旦品种春季1芽3叶 无病虫害,采摘于福建农林大学茶学教学科研实践基地茶树资源圃;RNAprep Pure多糖多酚植物总RNA提取试剂盒 天根生化科技(北京)有限公司;PremeScriPtTMRT reagent Kit with gDNA Eraser、SYBR® Premix Ex TaqTM大连宝生物工程有限公司。
6CYQT-60型摇青机、LGJ-25C 型真空冷冻干燥机 北京四环生物制药有限公司;7890B气相色谱/质谱联用仪 美国安捷伦公司;MPS 多功能自动进样系统 德国格斯特尔公司;Pegasus HT 飞行时间质谱 美国力可公司;Allegra 64R台式高速冷冻离心机 美国贝克曼库尔特公司;K5500 超微量分光光度计 北京凯奥公司;LightCycler 480实时荧光定量聚合酶链式反应仪 美国罗氏公司;萃取针PDMS/DVB9(23 Ga,Plain,65 μm) 美国Supelco公司。
1.2 实验方法
1.2.1 实验处理及分组 样品于2018年10月1日下午3~5时采集,采摘标准为一芽三叶,要求老嫩程度均一且无病虫害的黄旦鲜叶(F),鲜叶采摘后进行30 min萎凋,获得萎凋叶(SW)。萎凋后的做青加工先后有三次,摇青机速度控制在25 r/min,摇青时间控制在5 min,每次摇青后进行60 min的晾青。分别在三次摇青阶段结束后采集500 g样品,标注为T1、T2、T3,作为实验组(EG)。在采集实验组样品的同时,分别取同一时间段的未经做青工序的萎凋叶样品各500 g,标注为CK1、CK2、CK3,作为对照组。以上每个取样设3个重复。所有样品用锡箔纸包好后,快速放入液氮后取出,于-70 ℃冷藏。
1.2.2 香气检测 称取2.0 g茶叶粉末于20 mL顶空瓶,盖好后利用顶空固相微萃取法(HS-SPME)提取挥发性物质,并用气相色谱-飞行时间串联质谱(GC-TOF-MS)进行检测。SPME:萃取针PDMS/DVB9设定孵育温度为80 ℃,孵育时间为31 min,萃取时间为60 min,解析时间为3.5 min。色谱条件:色谱柱Rxi®-5silMS(30 m×0.25 mm×0.25 μm)。进样口温度控制在250 ℃,传输线温度设定为275 ℃,以氦气为载气,设置氦气流速为1 mL/min;程序升温过程为50 ℃保持5 min,以3 ℃/min的速率升至210 ℃并保持3 min,此后再以15 ℃/min的速率升至230 ℃;不分流进样品。质谱条件:溶剂延迟时间设定为300 s,扫描范围控制在30~500 amu,采集速率为10 Spec/s;检测器电压为1530 V,EI电离能量为70 eV,离子源温度为250 ℃。
测得挥发性代谢产物数据由仪器自带软件进行分析处理,与美国国家标准技术局化学(The National Institute of Standards and Technology,NIST)数据库标准质谱进行比较,查对有关质谱资料,对基峰、质核比和相对峰度等方面进行分析,结合保留时间和质谱分别对各峰加以确认,从中鉴定出了α-法呢烯组分,将峰面积>1%的色谱峰作为有效观测值,以峰面积归一化法确定α-法呢烯组分在各样品中的百分含量[28-30]。

表1 qRT-PCR特异性引物Table 1 The specific primers for qRT-PCR
1.2.3 茶树全基因组的来源 基于茶树全基因组数据库Tea Plant Information Archive(TPIA,http://tpia. teaplant.org/),在KEGG代谢通路中的倍半萜及三萜生物合成(#00909)中获得11条α-法呢烯合成相关基因(图2)。
图2 KEGG代谢通路中编码α-法呢烯合成酶基因家族成员Fig.2 KEGG pathway of CsAFS gene family members
1.2.4 系统发育进化树构建 对筛选获得的CsAFS基因家族成员的核酸序列在Genbank数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行对比,获得其他植物物种的同源序列,使用Mega7.0以邻接法构建的系统发育树另存为NWK文档,利用iTOL网站(http://itol.embl.de/)对系统发育树进行可视化处理。
1.2.5 总RNA的提取与cDNA的合成 参照RNAprep Pure Plant Kit说明以离心柱法抽提1.2.1中鲜叶、萎凋叶及实验组、对照组的茶树叶片加工过程中的总RNA,利用超微量核酸分析仪检测其浓度和纯度,1.2%琼脂糖凝胶电泳检测其完整性。采用PrimeScriptTMRT Reagent Kit逆转录合成cDNA,将获得的cDNA文库置于-20 ℃条件下贮藏备用。
1.2.6 qRT-PCR检测 采用SYBR@Premix Ex TaqTM试剂盒对黄旦叶片的CsAFS7基因表达情况进行检测。利用DNAman设计目的基因的特异性引物如表1所示。以CsGADPH为内参基因。反应体系20.0 μL:SYBR Green Master Mix 10.0 μL,正、反向引物各0.8 μL,灭菌水7.4 μL,cDNA模板1.0 μL。扩增程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s进行40个循环。采用2-ΔΔCt分别计算出相关基因的相对表达量[31]。
1.3 数据处理
采用Graphpad Prism 6.0 和 SPSS 20对试验数据进行分析及制图,分别利用ANOVA并图基(Tukey)法和独立样本t检验衡量实验组与对照组中α-法呢烯含量及CsAFS相关基因表达水平的组内差异和组间差异的显著性;利用皮尔逊相关系数评估α-法呢烯含量CsAFS基因的表达水平的相关性。
2 结果与分析
2.1 乌龙茶加工过程α-法呢烯的鉴定及其动态变化规律
通过顶空固相微萃取法(HS-SPME)结合气相色谱-飞行时间串联质谱(GC-TOF-MS)技术,进行乌龙茶香气检测,各样品的总离子流图如图3所示。基于NIST数据谱库鉴定出α-法呢烯组分的离子峰(R.T.=2157.7),如图4所示,结果发现,从鲜叶(F)到第三次摇青叶(T3)α-法呢烯的组分相对含量整体呈现上升趋势,在T3时含量达到最高值0.9485%。在实验组中,由于摇青工艺的开始,T1中所测得的α-法呢烯的组分相对含量为0.2465%,低于SW所测得的α-法呢烯的组分相对含量0.3916%,这表明摇青机械力的介入降低了样品茶叶的α-法呢烯的含量。但是随着加工工艺的推进,摇青所带来的机械胁迫可以提高茶叶中的α-法呢烯的含量。对比实验组中三次摇青之间的α-法呢烯的组分相对含量,可得三个数值之间存在明显差异,T1所测得的数值约为T2所测得的数值的40%,T2所测得的数值约为T3所测得数据的70%。对照组的α-法呢烯的组分相对含量呈现先下降后上升的趋势,伴随着茶叶自身水分的逸失,α-法呢烯的组分相对含量在CK3处达到摊晾过程中的最高值,数值为0.4273%。实验组和对照组对比中,T1和CK1存在差异,T2和CK2、T3和CK3组间存在极显著差异(P<0.01)。这说明,随着茶鲜叶的失水及机械胁迫的累加,茶叶中α-法呢烯的含量逐渐增加,成为影响乌龙茶成茶香气的重要成分。

图3 乌龙茶加工过程样的总离子流色谱图Fig.3 Total ion flow chromatogram of oolong tea processing samples注:箭头表示基于NIST数据谱库鉴定出的α-法呢烯的离子峰。

图4 乌龙茶加工过程中α-法呢烯组分相对含量的动态变化Fig.4 Dynamic change of α-Farnesene contentin different oolong tea manufacturing process注:F表示鲜叶;SW表示萎凋叶;T1表示第一次摇青叶;T2表示第二次摇青叶;T3表示代表第三次摇青叶。
图柱上不同小写字母表示不同时间点的表达量存在显著差异(P<0.05),大写字母表示不同时间点的表达量存在极显著差异(P<0.01),*表示实验组和对照组间独立样本t检验存在显著性差异(P<0.05),**表示实验组和对照组间独立样本t检验存在极显著性差异(P<0.01);图7同。
2.2 基于转录组数据的α-法呢烯合成酶基因的筛选
本课题组先前完成了乌龙茶初制过程中关键节点(鲜叶、萎凋叶、做青叶、对照摊放叶)的转录组测序,通过本地Blast后,将1.2.3中检索获得的α-法呢烯合成基因得到逐一比对,结果如表2所示,基于Blast得分和E值,将CL11384.Contig7_All作为候选CsAFS基因。
将候选的CL11384.Contig7_All与1.2.3中的11条α-法呢烯合成相关基因比对后,发现TEA033306.1、TEA009170.1、TEA026271.1与CL11384.Contig7_All具有高度的同源性。通过TPIA网站查询并对比的这三条α-法呢烯合成酶相关基因在不同山茶属植物中的表达水平,结果如图5所示,TEA026271.1基因仅在茶中表达水平较高(0.23),在列举的其余同属植物中普遍表达水平偏低,甚至不表达;TEA009170.1基因在茶(原变种)中表达水平最高(1.6),在龙井43中表达水平次之(1),在茶中则无明显表达水平;TEA033306.1整体表达水平较其它两个基因的表达水平高,在茶(原变种)中表达水平最高(2.75),在茶、龙井43中表达水平较高,分别为1、2。通过对比这三个基因在山茶属植物中的基因表达水平,可以得出在进化和演变的过程中,具有较高相关基因表达水平的茶(原变种)、茶被筛选出来,通过加工带来的外源胁迫促使叶片中相关基因表达,从而累积形成茶叶的赋香物质。
通过Me_V软件做图后对比筛选出的5个转录本的FPKM值热图,结果如表3所示。仅考虑表达值(FPKM)大于10 的转录本[32],可知CL11384.Contig7_All表达值在摇青叶(T3)及其对照叶(CK3)分别为40.29和11.41,Unigene14516_All的表达值在T3中为12.74,而其余三个转录本(Unigene14691_All、Unigene32162_All、CL4238.Contig1_All)在各处理中FPKM均小于10,故舍弃。尽管差异性分析表明CL11384.Contig7_All和Unigene14516_All的T3和CK3的FPKM均存在极显著差异(P<0.01),但通过对比二者T3和CK3的倍数差异(Fold_Change,FC)后发现,CL11384.Contig7_All的FC(T3_vs_CK3)为3.53,而Unigene14516_All的FC(T3_vs_CK3)仅为1.40。因此将CL11384.Contig7_All作为候选基因进行后续研究。

表2 基于茶树基因组数据库的转录组中α-法呢烯合成酶基因的本地BlastTable 2 Local blast of CsAFS7 gene based on tea tree genemo database

表3 基于转录组数据的α-法呢烯合成酶基因在加工过程中的表达值(FPKM)Table 3 Expression value(FPKM)of CsAFS gene during manufacturing process of oolong tea based on transcriptome data

图5 α-法呢烯合成酶基因的在不同山茶属植物中的表达水平Fig.5 CsAFS gene expression levelin various Camellia species
利用MegaV_7.0结合在线工具iTOL(http://itol.embl.de/upload.cgi)构建转录组中筛选获得的CL11384.Contig7_All核酸序列的系统发育进化树如图6所示。结果表明,该基因的转录本与茶树α-法呢烯合成酶基因(CsAFS)高度相似(Q_Cover=100%,E_value=0,Per. Ident=99.94%),与两个茶树萜烯类合成酶基因(CsTPS6、CsTPS9)存在较高的同源性。除茶树中的法呢烯合成酶基因外,还对比获得了一条欧洲栓皮栎的(E,E)-AFS基因,但与转录本CL11384.Contig7_All的相似度较低。通过系统发育进化树,进一步确定了转录组中筛选获得的CL11384.Contig7_All来自于茶树中的α-法呢烯合成酶基因的转录,因此将CL11384.Contig7_All命名为CsAFS7。

图6 基于CL11384.Contig7_All核酸序列同源性构建的系统发育进化树Fig.6 Phylogenetic tree based on nucleic sequences homology of CL11384.Contig7_All
2.3 乌龙茶加工过程中CsAFS基因的表达水平和验证
AFS基因的表达对α-法呢烯合成与代谢有关键作用[33]。因此,结合转录组数据,根据qRT-PCR结果中CsAFS7基因的表达量水平衡量茶叶在加工过程中的α-法呢烯含量水平,结果如图7所示,随着乌龙茶加工的进展,CsAFS7基因的表达水平呈现逐渐上升的趋势,在鲜叶阶段CsAFS7的表达水平最低,在第三次摇青叶处测得最高值(46.649)。

图7 乌龙茶加工过程中相关CsAFS7基因的相对表达水平Fig.7 CsAFS7 gene relative expression levelduring oolong tea manufacturing process
实验组中,T1处的CsAFS7表达水平约为T2处的26%,T2处的CsAFS7基因表达水平约为T3处的48%。对照组中,CsAFS7基因的表达水平呈现先升后降的趋势,在CK2处表达水平最高(14.003),在CK3时CsAFS7基因的表达水平明显下降至最低值(0.766)。说明了茶叶在摊晾过程中受到的非生物胁迫对CsAFS7的表达水平有一定影响,但随着自身水分的逸失,CsAFS7基因的表达水平逐渐降至最低。
实验组与对照组的对比中,T3与CK3的组间基因表达水平存在极显著差异(P<0.01)。说明了乌龙茶加工过程中,CsAFS7在外来机械力的作用下有较高的表达模式,且随着机械胁迫作用的累加逐渐升高。
2.4 乌龙茶加工过程中α-法呢烯含量与CsAFS基因相对表达水平的相关性分析
利用皮尔逊(Pearson)相关系数评估茶树CsAFS7基因的表达水平与α-法呢烯含量的相关性,结果如表4所示。实验组中CsAFS7基因的表达水平与α-法呢烯含量存在极显著正相关(r=0.951,P<0.01)。对照组中,CsAFS7基因的表达水平与α-法呢烯含量不存在显著差异(r=-0.192)。由此推测,外源机械力的施加促使相关CsAFS基因的表达水平上调,进而提高α-法呢烯的含量。

表4 乌龙茶加工过程中α-法呢烯丰度与CsAFS7基因相对表达水平的相关性分析Table 4 Correlation coefficient between α-farnesenecontent and relative expression level of CsAFS7 gene
3 讨论与结论
3.1 茶树AFS关键基因在茶组植物中的特异表达
通过与其他茶组植物比较,α-法呢烯合成酶关键基因的表达水平在茶(原变种)、龙井43中普遍高于其他茶组植物。尽管“茶”中α-法呢烯合成关键基因TEA026271.1、TEA009170.1的表达量高于其他茶组近源植物,但是却均低于“茶(原变种)”和“龙井43”。“茶(原变种)”的产生是人类将大叶茶向小叶茶、从乔木向灌木成功驯化的标志[34-36],而龙井43则是中国农业科学院茶叶研究所在龙井群体种中选育出的国家优良茶树品种[37]。这或许可以解释,带有香气的“茶”得到了人类的关注,在人类驯化和人工选育“茶”的过程中,香气又是一个十分重要导向。同时,茶叶的采后处理促进了香气的进一步释放。Hu等[38]基于转录组测序和代谢组数据,发现乌龙茶在做青过程中MEP和MVA途径上结构基本呈现上调表达的模式,这为包括α-法呢烯在内的VOCs的形成及释放研究奠定了基础。Jin等[39]基于转录组数据和代谢组测序数据,建立起一个茶树萜烯类代谢基因网,发现一个与法呢烯形成有显著正相关的萜烯类合成酶基因——TPS2,该基因与CsAFS基因具有较高的同源性,可以诱导α-法呢烯、β-法呢烯、β-罗勒烯的形成。本研究筛选获得的CsAFS基因表达水平能促进摇青工艺的推进,该基因对α-法呢烯的诱导作用,有助于把握不同加工阶段乌龙茶风味品质的形成。
3.2 乌龙茶加工过程中α-法呢烯的形成和关键基因的表达
α-法呢烯是乌龙茶中关键的赋香物质[40-41]。基于不同的加工工艺,茶叶被划分为六大类,其中乌龙茶加工工艺最为繁杂[42],基于乌龙茶加工过程中关键节点样品转录组测序,筛选获得了转录本CL11384.Contig7_All,通过本地Blast后发现该转录组与TEA033306.1、TEA026271.1以及TEA009170.1具有较高的同源性,qRT-PCR的验证后发现在做青叶中CL11384.Contig7_All的表达水平要明显高于其他处理叶,并且与做青过程中α-法呢烯的累积存在极显著的正相关,相关系数为0.951(P<0.01),该结果进一步说明了做青是乌龙茶天然馥郁花果香品质形成的核心工艺。乌龙茶做青过程中,萎凋适度的鲜叶在反复的摇青和摊放过程中,叶片加速失水并产生局部损伤,包括α-法呢烯在内的萜类[43]、脂肪族类[44-45]、苯丙烷及苯环类等[46]带有芳香气味的物质逐步形成并释放。与等时间未摇青的对照组(CK)相比,第三次摇青叶(T3)的α-法呢烯含量极显著高于对照组(P<0.01),这说明摇青机械力在做青中后期的介入,CL11384.Contig7_All表达水平开始显著上调,α-法呢烯开始大量累积并释放,因此这个阶段可能是乌龙茶天然花果香品质形成的关键时期。而有趣的是,T1中的α-法呢烯含量显著低于CK1中的α-法呢烯含量(P<0.05)。这可能是在做青伊始阶段,摇青机械力初次介入,与失水共同形成做青过程中的双重胁迫效益[47],尽管关键基因CL11384.Contig7_All的转录已经完成,但生理层次上,相关酶力及α-法呢烯的含量尚未同步,这与Zhou等[48]研究中同样指出了外源机械力的介入,初始LOX-HPL途径上ADH酶活力及基因表达水平均呈现先下降而后升高的趋势。Qian等[49]则阐释了葡萄采后的过程中分子层次和生理层次的反应差异,认为生理层次的反应要普遍滞后于分子层次。与本研究不同,佛手品种在付制乌龙茶过程中,α-法呢烯不论是释放量还是叶片中的残余量均呈现先升后降的趋势,而绿茶品种“浙农319”则呈现不断上升积累的趋势[50],这种差异可能是乌龙茶品种和采后处理的差异导致。
