肉苁蓉总多酚纯化工艺及其抗运动性疲劳作用研究
2020-08-17
(江苏警官学院,江苏南京 210031)
肉苁蓉为列当科植物肉苁蓉的干燥带鳞叶肉质茎,长期服用具有“补精益血”之功效,被卫计委认定为药食同源品种[1-2]。由于该植物含有多糖、多酚、生物碱、维生素及多种矿物质等营养成分,因而近年在药品和食品领域应用较多。王丽卫等[3]研究发现肉苁蓉可明显改善胃肠道的消化功能;Yang等[4]另发现其可加强骨矿物质密度;而王小新、陈志豪等曾分别对肉苁蓉的抗疲劳作用进行探讨,但没有研究具体活性成分的作用[5-6]。多酚化合物通常具有抗氧化、增强机体免疫及抗衰老等生理活性[7-8],而对肉苁蓉多酚提取物的纯化工艺优化和抗运动性疲劳作用的研究却鲜有报道。因此,本研究利用大孔树脂具有选择性高、干扰因素少、可重复循环利用的特点[9-11],在提取肉苁蓉多酚物质的工艺基础上,探讨大孔树脂对其纯化的最佳工艺条件,并通过相关动物实验观察其体内抗运动性疲劳的作用效果,为肉苁蓉资源的后续开发和利用提供参考。
1 材料与方法
1.1 材料与仪器
试验动物 健康雄性小鼠 50只(动物许可证号:SYXK(苏)2019-0030),体质量10~18 g,由江苏省实验动物中心提供,生长环境温度20~25 ℃,相对湿度50%~70%;肉苁蓉 安徽亳州药材市场,经鉴定为列当科肉苁蓉属植物肉苁蓉;没食子酸标准品 Sigma公司;Folin-酚试剂、无水乙醇、碳酸钠 均为分析纯国药集团化学试剂有限公司;乳酸(BLA)、乳酸脱氢酶(LDH)、肌糖原(MG)和肝糖原(HG)检测试剂盒 南京建成生物工程研究所;试验用水 为去离子水。
WK-40型药材粉碎机 青州迈德森制药机械厂;UV759S型紫外-可见分光光度计 上海精密科学仪器有限公司;FA1004B型电子天平 上海越平科学仪器有限公司;NKA-2、HPD 100、HPD 300大孔树脂 北京英莱克科技发展有限公司;AB-8、HPD 400树脂 合肥四峰生物科技有限公司;Lab-1A-50E型冷冻干燥机 北京博医康实验仪器有限公司;SHZ-82型水浴恒温振荡器 常州国旺仪器有限公司;小鼠恒温游泳池 上海艾研生物科技有限公司。
1.2 实验方法
1.2.1 多酚提取物制备 将干燥后的肉苁蓉完全粉碎后,过80目筛,准确称取20 g,加入400 mL,70%乙醇溶液,在60 ℃温度下回流提取30 min后过滤,提取两次,合并滤液减压回收乙醇后,冷冻干燥备用[12]。
1.2.2 树脂型号选择
1.2.2.1 树脂预处理 将大孔树脂浸泡于90%乙醇中24 h,充分溶胀后湿法装柱,后用90%乙醇反复冲洗,直至流出液与水混合(V液∶V水=1∶5)无白色浑浊出现,再用水洗至无乙醇气味,加入3% 盐酸浸泡3 h,用水洗至中性;再用3%氢氧化钠溶液浸泡3 h,用水洗至中性,备用[13]。
1.2.2.2 静态吸附与洗脱 准确称取5.0 g六种不同极性的大孔树脂(NKA-2、HPD 100、AB-8、HPD 300、HPD 400)置于锥形瓶内,分别加入6 mg/mL 100 mL提取液后,置于恒温振荡器内,静态吸附24 h后过滤。通过下式测得不同类型大孔树脂的静态饱和吸附量与吸附率。
式(1)
式(2)
式中:m0为提取液中多酚质量,mg;me为饱和吸附后滤液中多酚质量,mg;m为干燥的大孔树脂质量,g;Γe为饱和吸附量,mg/g;Qe为饱和吸附率,%。
利用乙醇作洗脱剂,将饱和吸附后的树脂置于锥形瓶内,加入60%乙醇100 mL后,置于恒温振荡器中,静态洗脱24 h,过滤,测定滤液中多酚的浓度,通过下式测得不同类型树脂的洗脱率与回收率。
式(3)
式(4)
式中:m0为提取液中多酚质量,mg;me为饱和吸附后滤液中多酚质量,mg;md为洗脱液中多酚质量,mg;Dd为洗脱率,%;R为回收率,%。
1.2.3 吸附等温线 准确配制100 mL浓度为1、2、3、4、5、6、7 mg/mL的肉苁蓉提取物溶液加入至装有5.0 g树脂的锥形瓶后,分别置于25、35、45℃恒温摇床中,振荡吸附24 h,测得滤液总多酚浓度,计算吸附量,绘制吸附等温线,同时利用Langmuir、Freundlich吸附模型,绘制相应等温吸附方程[14]。
式(5)
式(6)
式中:Γm为多酚饱和吸附量,mg/g;Kb为Langmuir方程常数;Γe为多酚吸附量,mg/g;Ce为滤液多酚浓度,mg/mL;Kf为Freundlich方程常数。
1.2.4 吸附动力学曲线 准确称取大孔树脂5.0 g置于锥形瓶内,加入100 mL质量浓度为5 mg/mL的多酚提取液,于25 ℃振荡吸附,分别于0.5、1.0、2.0、3.0、5.0、7.0、10.0、12.0、16.0、20.0、24.0 h取样,测定总多酚浓度,以吸附量(Γt)为纵坐标,时间(t)为横坐标,绘制静态吸附动力学曲线,分析树脂对肉苁蓉多酚的吸附动力学行为[15]。
In(Γe-Γt)=InΓe+K1t
式(7)
式(8)
Γt=K3t1/2+C
式(9)
式中:K1为准一级速率常数,min-1;K2为准二级速率常数,mL·mg-1·min-1;K3为颗粒内扩散速率常数,mg·min-0.5·min-1。
1.2.5 大孔树脂动态吸附
1.2.5.1 上样液浓度影响 分别准确量取等体积的多酚提取液2、4、6、8、10 mg/mL,控制流速2 mL/min,上样至预处理后的树脂内(树脂质量:5.0 g;径高比:1∶12),收集柱后流出液,测得不同流出液中多酚浓度,计算各自吸附率。
1.2.5.2 吸附流速影响 准确量取等体积5份1.2.5.1确定的最佳浓度多酚提取液,分别控制流速1、2、3、4、5 mL/min,上样至预处理后的树脂内(树脂质量:5.0 g;径高比:1∶12),收集柱后流出液,测得不同流出液中多酚浓度,计算各自吸附率。
1.2.5.3 树脂吸附泄露曲线 准确量取1.2.5.1确定的最佳浓度多酚提取液,以1.2.5.2实验中确定的最佳流速上样至预处理后的树脂内(树脂质量:5.0 g;径高比:1∶12),收集柱后流出液,每管体积5 mL,直至到达饱和吸附,测得各自吸附率,绘制树脂吸附泄露曲线并确定最佳上样液体积。
1.2.6 大孔树脂动态洗脱
1.2.6.1 乙醇浓度影响 以乙醇溶液作洗脱剂,分别选择体积分数40%、50%、60%、70%、80%的乙醇溶液,控制1 mL/min洗脱流速,对1.2.5.3饱和吸附后的树脂进行洗脱,直至洗脱完全,收集洗脱液,测定多酚浓度,计算各自洗脱率。
1.2.6.2 洗脱流速影响 配制5份1.2.6.1试验中确定的最佳浓度乙醇溶液,分别控制流速0.5、1、2、3、4 mL/min,对1.2.5.3饱和吸附后的树脂进行洗脱,直至洗脱完全,收集洗脱液,测定多酚浓度,计算各自洗脱率。
1.2.6.3 树脂洗脱曲线 精密量取1.2.6.1实验中确定的最佳浓度乙醇溶液,以1.2.6.2实验中确定的最佳流速对1.2.5.3饱和吸附后的树脂进行洗脱,直至洗脱完全,收集洗脱液,每管体积5 mL,测量每管总多酚浓度,绘制树脂洗脱曲线。
1.2.7 定量分析
1.2.7.1 标准曲线绘制 按照文献所述方法,准确称取没食子酸标准品20 mg溶于水中,另加入Folin-酚试剂和质量分数为20%的NaCO3溶液,配制成质量浓度为0.1~0.8 mg/L的标准溶液,并于760 nm处测定吸光度[12],以浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到标准曲线方程y=1.472x-0.0527(r=0.9961)。
1.2.7.2 多酚浓度测定 照上述步骤配制样品溶液后,于760 nm波长处,测定吸光度后,根据方程计算样品中多酚浓度,另作空白试验,平行测定三次,按照下式计算样品中多酚的纯度。
式(10)
式中m0为样品质量,mg;C为产物的多酚浓度,mg/mL;V为样品体积,mL;D为稀释倍数。
1.3 体内抗疲劳研究
1.3.1 模型建立 将50只健康雄性小鼠,随机分为五组,每组10只,空白对照组采用生理盐水灌胃,其它各组则按照小鼠体重灌药,其中阳性对照组采用0.1 mg/g西洋参灌胃,低、中、高剂量组则依次灌胃0.05、0.10、0.20 mg/g多酚纯化物,每天灌胃1次,连续灌胃30 d。每组小鼠灌胃1 h后于恒温游泳池内开展游泳训练,5 d为一训练周期,共训练4周[16]。
1.3.2 动物游泳运动 模型建立后,于鼠尾负重自身5%的重物,进行力竭性游泳运动,记录小鼠自入水开始游泳至沉没超过10 s的时间,即为游泳力竭时间[17]。
1.3.3 体内生化指标测定 小鼠游泳运动进行10 min后,取出擦净,摘取眼球,抽血离心,同时分取肝与肌肉组织,采用相关试剂盒分别测得各组动物血清中乳酸、肝糖原、肌糖原含量和乳酸脱氢酶的活力[18]。
1.4 数据处理
实验结果均采用均数±标准差表示,采用SPSS 18.0方差分析,检验水准α=0.05,当P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与讨论
2.1 树脂型号确定
表1为不同型号大孔树脂对提取物中多酚的静态吸附与洗脱性能比较,从表1中可知,不同树脂的吸附能力不同,其中HPD-400大孔树脂对肉苁蓉多酚的吸附率最高,达到88.0%,其次为NKA-2,吸附率为77.0%,而采用60%乙醇静态洗脱时,HPD-400大孔树脂的洗脱率最大,达到91.2%,表明HPD-400大孔树脂对肉苁蓉多酚的吸附与解吸性能较好,这可能源于同其它四类树脂相较,HPD-400树脂极性适中,与多酚的相互作用较好,因此确定HPD-400大孔树脂作为该纯化研究的吸附树脂。
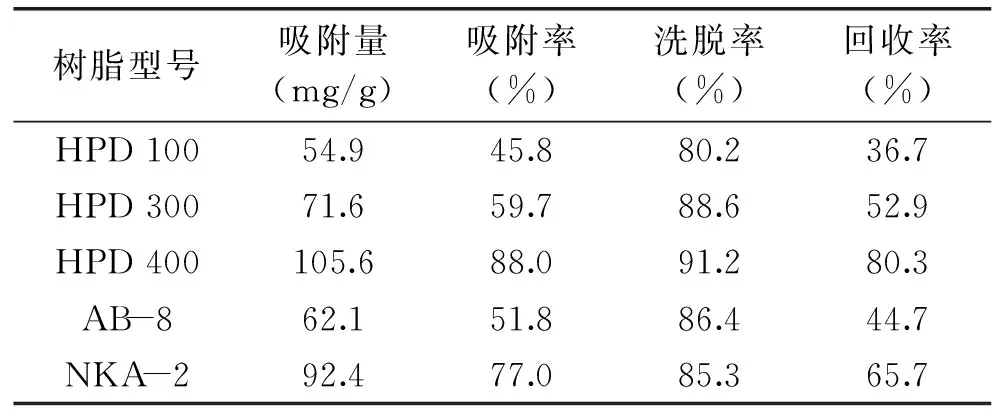
表1 不同树脂的静态吸附与洗脱性能比较Table 1 Compare with static adsorptionand desorption performance of different resins
2.2 树脂吸附等温线
HPD-400大孔树脂对肉苁蓉多酚的吸附等温线,如图1所示,不同温度下,随着上样液多酚浓度的增大,树脂吸附量不断增加,分别对不同温度的吸附曲线进行拟合,结果见表2所示。从表2可知,不同温度下HPD-400大孔树脂对肉苁蓉多酚的等温吸附过程与Langmuir吸附等温模型相近,方程相关系数r均大于0.99,同时随着温度升高,吸附量逐渐减少,表明该吸附过程为放热过程。

图1 不同温度的吸附等温曲线Fig.1 The adsorption curve in different temperatures
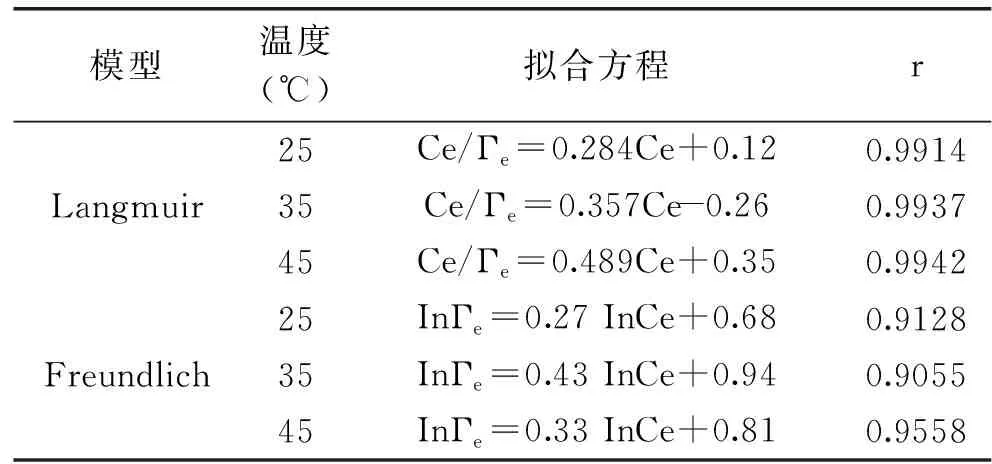
表2 不同温度的吸附等温线拟合方程Table 2 Fitting equations of adsorptionisotherms in different temperatures
2.3 树脂吸附动力学曲线
HPD-400大孔树脂对肉苁蓉多酚的吸附动力学曲线,如图2所示。在0~2 h时,树脂对多酚的吸附量较大,逐渐缓慢至12 h后达到平衡,表明HPD-400大孔树脂对肉苁蓉多酚的吸附较快。利用相关动力学方程模型对上述吸附过程进行拟合,见表3所示,该吸附过程与准二级动力学过程更为接近,同时从Kannan拟合方程结果可知,该吸附过程分为三个阶段,在0~4 h为薄膜扩散过程,在4~12 h为粒内扩散过程,Γt对t1/2均具有良好的线性关系,12 h后树脂对多酚的吸附与脱附达到平衡。
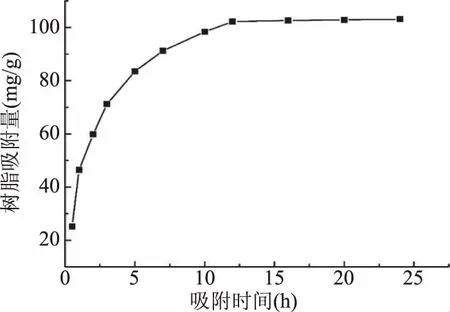
图2 吸附动力学曲线Fig.2 The curve of adsorption dynamics

表3 吸附动力学拟合方程Table 3 The fitting equations of adsorption dynamics
2.4 动态吸附条件选择
2.4.1 上样液浓度选择 若上样液多酚浓度过高,树脂易过早饱和,造成树脂吸附率下降,而上样液多酚浓度过低,则影响实验效率。不同上样液浓度对吸附率的影响,见图3所示,当多酚浓度为2~6 mg/mL时,随着上样液多酚浓度的增大,HPD-400大孔树脂对多酚的吸附率处于较高水平,而多酚浓度大于6 mg/mL时,吸附率开始逐渐下降,这归因于样品溶液中部分多酚的泄露,因此确定上样液最佳多酚浓度为6 mg/mL。

图3 上样液浓度对吸附率的影响Fig.3 The effect of loading solutionconcentration on adsorption rate
2.4.2 吸附流速选择 在动态吸附时,上样流速过快,多酚与树脂接触不充分,可能造成过早泄漏,但流速过慢,又导致纯化耗时过长,且对后续树脂再生产生不良影响。不同上样流速对吸附率的影响,见图4所示,当上样流速在1~2 mL/min时,HPD-400大孔树脂对多酚的吸附率无明显影响,而随着流速增大,吸附率呈下降趋势,因此选择2 mL/min作为最佳上样流速。
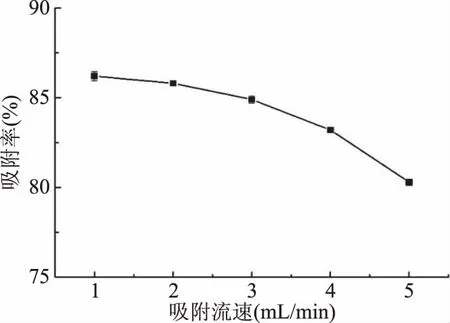
图4 吸附流速对吸附率的影响Fig.4 The effect of adsorption flow rate on adsorption rate
2.4.3 动态吸附泄漏曲线 当流出液的多酚浓度为上样液浓度的10%,称为树脂吸附泄漏点,达到上样液浓度的100%时称为树脂饱和吸附点[19]。肉苁蓉多酚在上样过程时不断被树脂吸附与脱附,当吸附速率等于脱附速率时,出现泄漏现象,见图5所示,当上样液体积约为60 mL时,流出液中总多酚浓度急剧上升,且超出上样液浓度10%,达到泄漏点,上样液体积约为140 mL时,达到饱和吸附点,因此确定HPD-400大孔树脂纯化肉苁蓉多酚化合物的最大上样体积为60 mL。
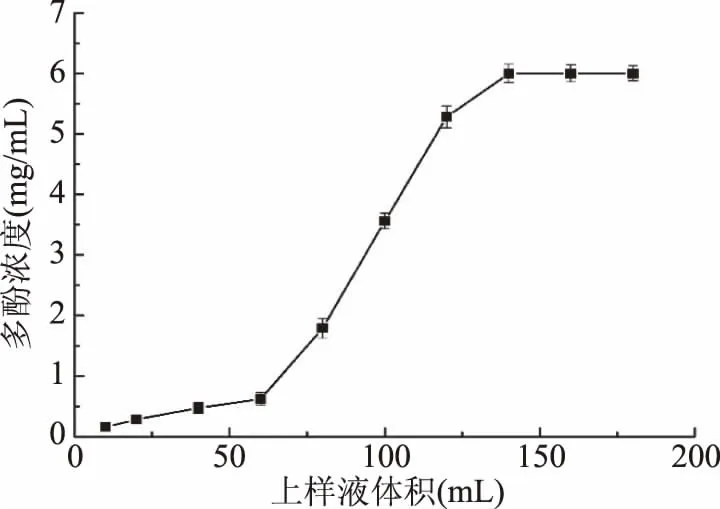
图5 大孔树脂动态吸附泄露曲线Fig.5 Dynamic adsorption leakagecurve of macroporous resin
2.5 洗脱条件选择
2.5.1 乙醇浓度选择 不同浓度的乙醇溶液对肉苁蓉多酚的洗脱效果,见图6所示。随着洗脱液浓度增大,洗脱率逐渐增大,至60%开始下降。这可能因为低浓度乙醇破坏多酚与树脂形成的氢键能力较弱,而过高浓度乙醇的极性与多酚化合物相差较大,不利于洗脱,因此确定采用60%乙醇溶液作为最佳洗脱液浓度。

图6 洗脱液浓度对洗脱率的影响Fig.6 The effect of eluent concentration on desorption rate
2.5.2 洗脱流速选择 不同洗脱流速对肉苁蓉多酚的洗脱率影响,见图7所示,随着洗脱流速增大,洗脱率逐渐下降,这归因于流速较快时,洗脱液不能充分接触树脂,但流速过低,又会延长洗脱过程,因此综合考虑确定1 mL/min作为最佳洗脱流速。
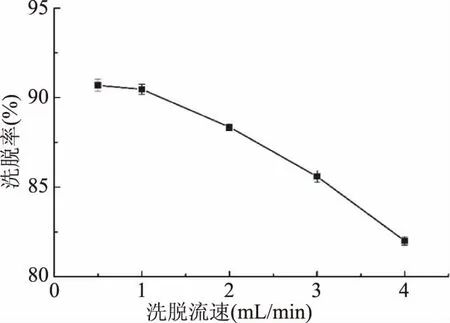
图7 洗脱流速对洗脱率的影响Fig.7 The effect of eluent flow rate on desorption rate
2.5.3 动态洗脱曲线 不同洗脱液用量对肉苁蓉多酚的洗脱效果影响,见图8所示。从图8可知,当洗脱液体积为20 mL时,即有多酚类化合物被洗脱流出,当用量为80 mL,洗脱液中多酚含量达到最大,随后洗脱液体积继续增大,但多酚含量不断下降。当用量约为180 mL时,多酚类化合物基本被完全洗脱,所得洗脱曲线单一、对称、尖锐且无明显拖尾,因此确定最佳浓度的洗脱液的用量为180 mL。
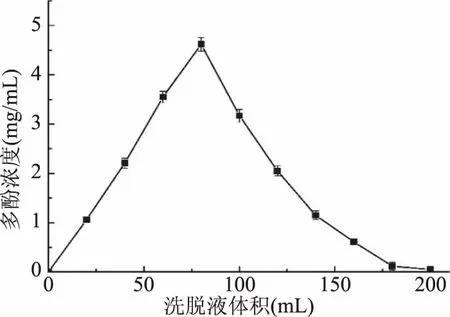
图8 动态洗脱曲线Fig.8 The dynamic elution curve
2.6 验证实验
采取上述最佳纯化工艺,对肉苁蓉提取物中多酚类化合物,即配制体积为60 mL,多酚浓度为6 mg/mL上样液,以2 mL/min流速,上样至HPD-400大孔树脂饱和吸附后,采用体积为180 mL,60%乙醇溶液,以1 mL/min流速洗脱,测得吸附率与洗脱率分别为86.72%和90.11%,产物的总多酚纯度由纯化前(20.12%±1.26%)提高至纯化后(42.63%±1.69%),约为纯化前2.12倍,而前人采用大孔树脂纯化苹果多酚含量由35%增高至84%,为纯化前2.4倍[20];黑果腺肋花楸多酚提取物经纯化后含量为纯化前5.5倍[21],表明该工艺分离效果较好,适于肉苁蓉多酚化合物的纯化。
2.7 抗疲劳作用研究
2.7.1 游泳力竭时间比较 负重游泳时间的长短直接反映运动过程的抗疲劳程度,不同剂量纯化产物对小鼠的负重游泳时间影响[22],见表4所示。从表4可知,与空白对照组相较,阳性对照、低、中、高剂量组小鼠的负重游泳时间均有所延长,其中低剂量组与其差异具有显著性(P<0.05),而阳性对照、中、高剂量组小鼠与其差异则极为显著(P<0.01),表明肉苁蓉多酚纯化产物有助于增强小鼠的运动耐力。
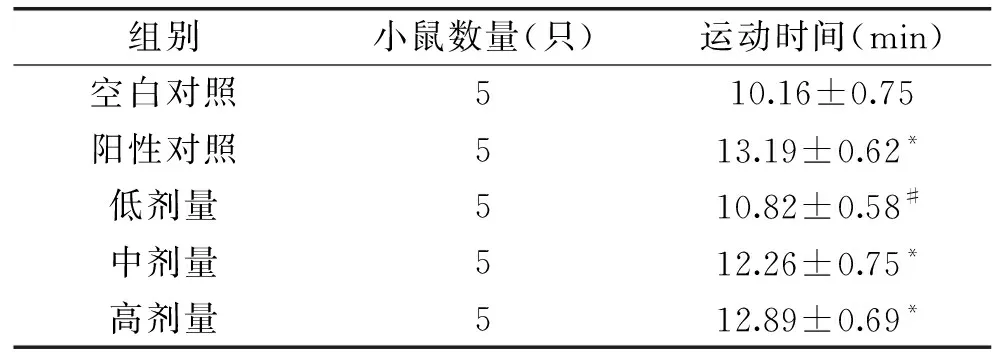
表4 肉苁蓉多酚对运动时间的影响Table 4 The effect of polyphenols ofCistanche on movement time
2.7.2 体内生化指标影响 身体运动后乳酸的浓度水平与疲劳程度呈正相关,机体高强度运动后会造成体内部分细胞缺氧,致使血糖发生糖酵解生成乳酸,蓄积在骨骼肌等组织中,而乳酸脱氢酶可迅速催化乳酸脱氢形成丙酮酸,有利于排泄出体外[23]。不同剂量纯化产物对运动后小鼠的体内乳酸生化指标影响,见表5所示。各剂量组小鼠体内的血乳酸含量和乳酸脱氢酶酶活力与空白对照组相较,差异均极为显著(P<0.01),表明肉苁蓉多酚可明显提高体内乳酸脱氢酶活力,并有利于抑制体内乳酸生成。
肝糖原与肌糖原则是机体的重要储能物质,当机体开始运动时,肌糖原逐渐消耗至殆尽,随后利用肝糖原以维持体内运动时血糖水平[24]。表5为不同组别小鼠的肝糖原与肌糖原含量,与空白对照组相比,低剂量组的两种糖原含量均较高,具有显著性差异(P<0.05),而阳性对照、中、高剂量组体内的两种糖原含量均明显更高,具有极显著性差异(P<0.01),表明肉苁蓉多酚纯化产物有助于增加体内肝糖原与肌糖原储备。

表5 肉苁蓉多酚对体内生化指标的影响Table 5 The effect of polyphenols of Cistanche on biochemical indexs in vivo
3 结论
采用HPD-400大孔树脂分离纯化肉苁蓉提取物中多酚类化合物,该吸附过程符合准二级动力学方程,等温吸附线与Langmuir模型较好拟合,且多酚吸附量伴随温度升高而减少。通过动态吸附与洗脱试验,优选得到最佳纯化工艺条件:配制体积为60 mL,多酚浓度为6 mg/mL上样液,以2 mL/min流速,上样至HPD-400大孔树脂饱和吸附后,采用体积为180 mL,60%乙醇溶液,以1 mL/min流速洗脱,树脂对多酚类化合物的吸附率和解吸率分别达到86.72%和90.11%。产物中总多酚含量由纯化前20.12%提高至纯化后42.63%,约为纯化前2.12倍。该工艺操作简便、纯化效率较高,低、中、高剂量产物均可明显增强机体运动耐力,提高体内乳酸脱氢酶活力,抑制乳酸生成水平,并可增加肝糖原与肌糖原的储备,从而具有较好的抗运动性疲劳作用。
