天浆壳生物碱的提取分离纯化及对舌癌Tca8113细胞的增殖抑制作用
2020-08-17,*
,*
(1.锦州医科大学药学院,辽宁锦州 121000;2.锦州医科大学附属第一医院,辽宁锦州 121000)
天浆壳是植物萝藦的果壳。萝藦Metaplexisjaponica(Thunb.)Makino为萝藦属萝藦科多年生草质缠绕藤本植物,广泛分布于中国、日本、韩国及俄罗斯。《毛诗草木鸟兽虫鱼疏》中记载古人在食用萝藦过程中发现了萝藦的滋补保健作用。王怀隐《太平圣惠方》中记载萝藦粥,空腹食之具有补肾益精的作用[1-2]。其果壳在中药中被称作“天浆壳”,具有补虚助阳,治疗咳嗽痰多、肺风痰喘[3-5]等功效。
目前对天浆壳成分的研究主要在多糖、蛋白和多酚方面[6-8]。生物碱因具有抗炎、抗菌、抗肿瘤等显著的生物活性成为近年来的研究热点[9-11]。胡鹏等[12]通过对萝藦化学成分的研究,确定萝藦中含有生物碱,孔越等[13]从萝藦种子中提取出生物碱,但未见有对萝藦果壳中生物碱进行提取和研究的报道。
国内外普遍采用超声波辅助醇类溶剂提取法[14]、色谱法[15-16]对生物碱进行提取和分离纯化。硅胶柱色谱其性能稳定,操作简单,适用范围广,既可分离极性生物碱,也可分离非极性生物碱[17]。因此本文采用甲醇作为提取剂[18],超声波辅助提取,硅胶柱色谱法分离纯化天浆壳中的生物碱,并探讨其对人舌鳞状细胞癌Tca8113细胞的增殖抑制作用。为天浆壳在食品、药品方面的开发和进一步的临床研究提供理论依据。
1 材料与方法
1.1 材料与仪器
天浆壳 采至辽宁省锦州市周边地区,经辽宁省锦州市药品检验所翟铁红主任药师鉴定为天浆壳;舌癌Tca8113口腔鳞状癌细胞株 中科院细胞库;甲醇、二氯甲烷、盐酸 分析纯,天津永晟精细化工有限公司;氢氧化钠 分析纯,天津市永大化学试剂有限公司;柱层析硅胶100~200目,200~300目 青岛海洋化工分厂;TCL预制板F254 烟台江友硅胶开发有限公司;DMEM培养基、胰酶、PBS、胎牛血清 美国Gibco公司;Hoechst 33342染色液 上海Beyotime公司;Tris 韩国Biosharp公司。
DRX-400 MHz型核磁共振仪 瑞士Bruker公司;P-1020 旋光仪 日本Jasco公司;恒温水浴锅 上海腾方公司;DFY-800C型粉碎机 大德药机公司;旋转蒸发仪 上海广英公司;UP3200HE数控超声波清洗器 南京垒君达超声电子设备有限公司;SW-CJ-1E洁净工作台 上海博迅实业有限公司;LDZM立式压力蒸汽灭菌器 上海申安医疗器械厂;二氧化碳培养箱 Thermo-Fisher公司;XD-101型倒置显微镜 日本电子公司;激光共聚焦显微镜 日本奥林巴斯公司。
1.2 实验方法
1.2.1 生物碱的提取 参考Chen[19]的方法,稍作修改。天浆壳用粉碎机粉碎,过40目筛,称取2.0 kg天浆壳粉末,88%甲醇浸泡,超声波功率100 W辅助30 min浸提3次。合并三次浸提液过滤并减压浓缩。用体积分数为1%的稀盐酸调浓缩液pH至1,过滤,滤液用饱和NaOH调pH至10,二氯甲烷多次萃取至水层与碘化铋钾反应成阴性后合并萃取液,减压浓缩得天浆壳总生物碱。
1.2.2 生物碱的分离纯化 天浆壳总生物碱经硅胶柱(200~300目)柱层析[20],以(二氯甲烷∶乙酸乙酯=10∶1)体系洗脱,得到A部分,以(二氯甲烷∶乙酸乙酯=4∶1)体系洗脱,得到B部分,以(二氯甲烷∶甲醇=20∶1)体系洗脱得到C部分。A部分经柱层析(二氯甲烷∶甲醇=15∶1)再经过(二氯甲烷∶乙酸乙酯=3∶1)纯化得到生物碱1;B部分经柱层析(石油醚∶乙酸乙酯=4∶3)体系纯化得到生物碱2;C部分经柱层析二氯甲烷:甲醇系统梯度洗脱(甲醇0%→30%)纯化得到生物碱3。
1.2.3 生物碱的结构鉴定 色谱甲醇溶解配制浓度为5 mg/mL生物碱1~3溶液,250 ℃,电子轰击电离源EI,辅助气(N2)流量10.0 L/min,喷雾器压力344.8 kPa,质谱仪检测生物碱分子质量。
色谱甲醇溶解配制浓度为0.15 g/100 mL生物碱1~3溶液,20 ℃,波长为钠光D线(589 nm),旋光仪检测生物碱比旋光度。
色谱氘代氯仿溶解配制浓度为5 mg/mL生物碱1~3溶液,25 ℃,400 MHz,1H NMR位移值以氘代溶剂中残存的CHCl3(δ7.26)为内标,12C NMR位移值以CHCl3(δ77.0)为内标,谱宽20.55 ppm,延迟时间20 s,采样时间3.98 s,核磁共振仪检测生物碱核磁共振谱。
1.2.4 舌癌Tca8113细胞的复苏 从液氮罐中取冻存的舌癌Tca8113细胞,于37 ℃水浴中快速摇晃解冻,吸取细胞液,置于培养皿中,加入5 mL DMEM完全培养基,轻摇匀使其铺在培养皿中,在5% CO237 ℃培养箱中培养。
1.2.5 舌癌Tca8113细胞的传代 培养基中细胞生长覆盖率至80%~90%时,用移液枪移去培养基中旧培养液,用PBS洗涤3遍,加1 mL胰蛋白酶消化液,显微镜下观察细胞开始变圆时,加入完全培养液终止消化。用移液枪轻轻吹打贴壁细胞,移入离心管中离心(1200 r/min,3 min)后弃去上清液,加入2 mL DMEM完全培养基重悬细胞,每个培养皿中加1 mL细胞悬液和5 mL完全培养基在培养箱中培养。
1.2.6 细胞的计数 按照上述传代方法制成细胞悬液,取10 μL注入到盖玻片与计数板的连接处,显微镜下观察并用细胞计数板计数,公式:
细胞密度(个/mL)=(四大格细胞数之和/4)×104
1.2.7 不同浓度生物碱溶液的配制 将3种生物碱用不含血清的DMEM培养液溶解,通过0.22 μm微孔滤膜进行过滤,配制成浓度为(0、10、50、100、150、200 μmol/L)的生物碱溶液[21]。
1.2.8 生物碱对舌癌Tca8113细胞的生长抑制作用 MTT法测定不同浓度生物碱对舌癌Tca8113细胞活力的影响,取对数生长期的细胞制成细胞悬液。将细胞以5×104个/mL的密度接种到96孔板中,在5% CO237 ℃培养箱中培养24 h后,分别用不同浓度(0、10、50、100、150、200 μmol/L)的生物碱1、2、3处理Tca8113细胞。在5% CO237 ℃培养箱中继续培养48 h后,每孔加入20 μL MTT(0.5 mg/mL)再继续培养4 h,弃去上清液,每孔加入150 μL DMSO,振荡1 min,酶标仪在570 nm处测量吸光度值[22]。阴性对照每孔加入等体积的DMEM完全培养液。空白组用来调零,只加培养液不加细胞。
细胞生长抑制率(%)=(阴性对照组OD值-试验组OD值)/阴性对照组OD值×100
1.2.9 Hoechst 33342细胞染色试验 为了分析生物碱处理后的舌癌Tca8113细胞形态变化,将细胞以5×104个/mL的密度接种到24孔板中,用不同浓度的生物碱(0、100、150、200 μmol/L)处理24 h。用PBS将细胞洗涤2遍,每次3 min,吸尽液体,0.5 mL Carnoy固定液固定10 min。加入0.5 mL Hoechst 33342染色液,染色5 min。PBS洗涤2遍后用抗淬灭封片液封片,荧光显微镜下观察细胞形态[23]。
1.3 数据处理
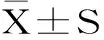
2 结果与分析
2.1 化合物的结构解析
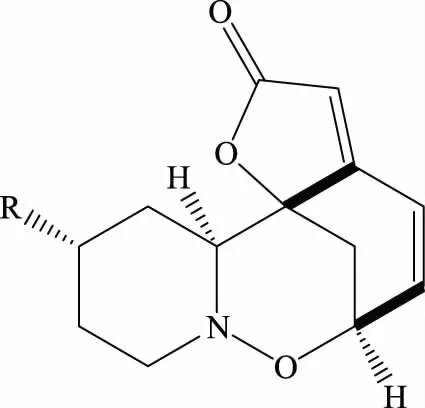
图1 生物碱1的结构Fig.1 Structure of alkaloid 1注:R=OMe。
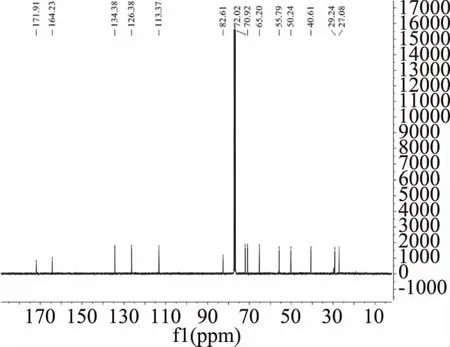
图3 生物碱1的13C NMR谱图Fig.3 The 13C NMR of alkaloid 1
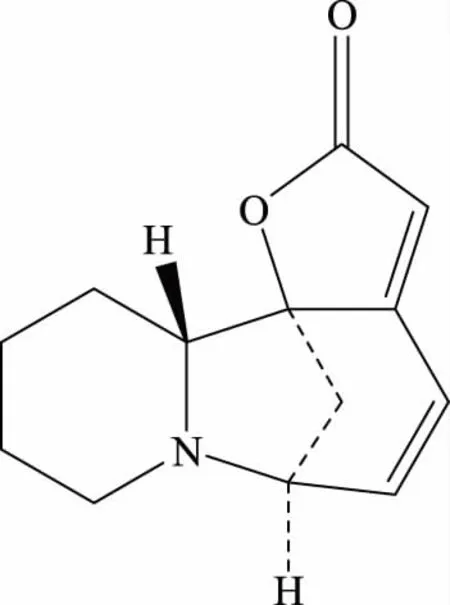
图4 生物碱2的结构Fig.4 Structure of alkaloid 2
图5 生物碱2的1H NMR谱图Fig.5 1H NMR spectra of alkaloid 2
图6 生物碱2的13C NMR谱图Fig.6 The 13C NMR of alkaloid 2
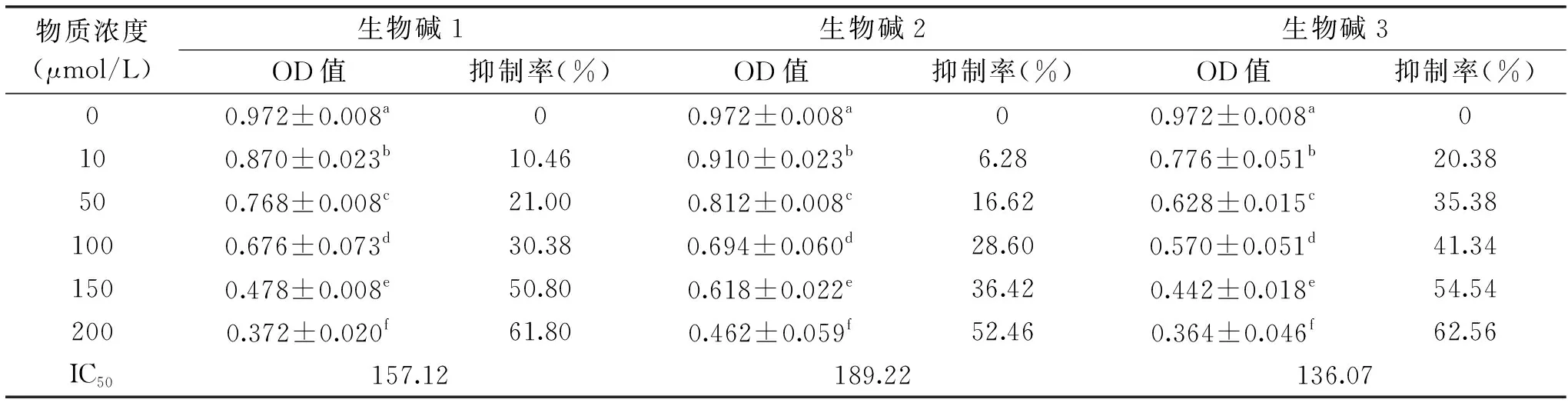
表1 三种生物碱对舌癌Tca8113细胞的抑制率Table 1 Inhibition rate of alkaloids of Tca8113 cells
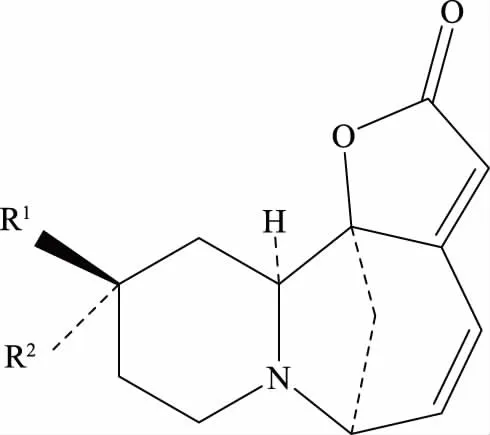
图7 生物碱3的结构Fig.7 Structure of alkaloid 3注:R1=H,R2=OMe。
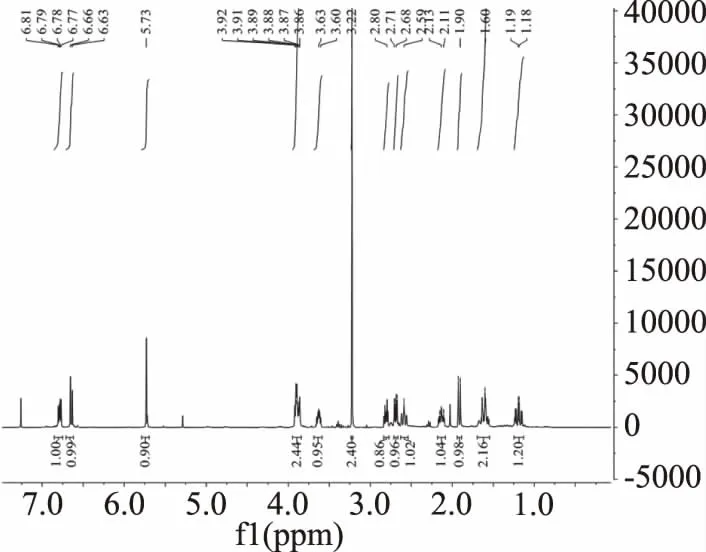
图8 生物碱3的1H NMR谱图Fig.8 1H NMR spectra of alkaloid 3
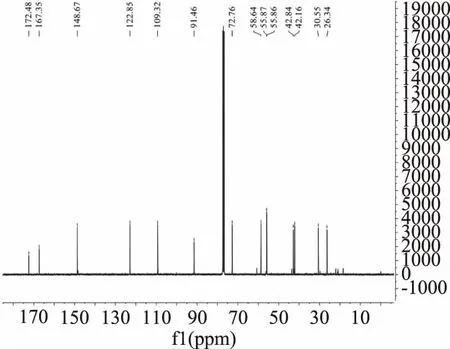
图9 生物碱3的13C NMR谱图Fig.9 The 13C NMR of alkaloid 3
2.2 天浆壳生物碱对细胞生长的抑制作用结果
为了评定生物碱1、2、3对舌癌Tca8113细胞的生长抑制作用。本试验选择MTT初筛法考察它们对细胞的作用。试验结果由表1所示,经天浆壳生物碱处理后的舌癌Tca8113细胞增殖被抑制,不同浓度生物碱处理后的舌癌细胞OD值较对照组比较为极显著(P<0.01),抑制率随着3种生物碱浓度的增加而增加。三种生物碱对舌癌Tca8113细胞的半数抑制率(IC50)分别为157.12、189.22、136.07 μmol/L。
2.3 Hoechst 33342细胞染色试验结果
Hoechst 33342是一种蓝色荧光染料,能少许进入正常细胞膜,使其染上低蓝色,而凋亡细胞的膜通透性增强,因而荧光强度比正常细胞要高。为了进一步鉴定天浆壳生物碱对Tca8113细胞的生长抑制作用是否与诱导凋亡有关。对不同浓度的三种生物碱处理后的舌癌Tca8113细胞染色并通过荧光显微镜观察细胞核的形态变化,结果如图10~图12所示(附图均放大200倍)。正常未给药组细胞内荧光较弱,细胞核形态正常。经不同浓度生物碱1、2、3处理24 h后的部分细胞内荧光变强,形态及细胞核都发生了不同程度的改变,细胞变扁圆,染色质皱缩,细胞核成“新月”状或碎裂成小圆等特点,且随着生物碱浓度的增加变化更加明显,说明其抑制作用具有浓度依赖性。

图10 不同浓度的生物碱1对舌癌Tca8113细胞形态的影响Fig.10 Effect of different concentrations ofalkaloids 1 on the morphology of Tca8113 cells
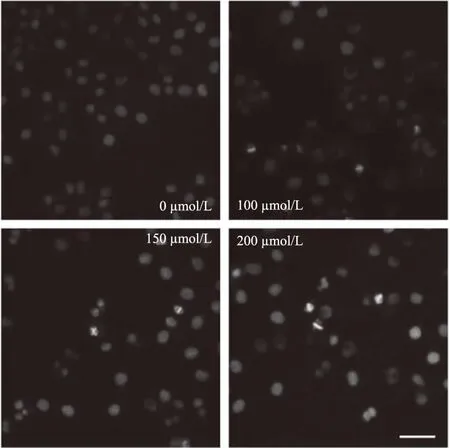
图11 不同浓度的生物碱2对舌癌Tca8113细胞形态的影响Fig.11 Effect of different concentrations ofalkaloids 2 on the morphology of Tca8113 cells
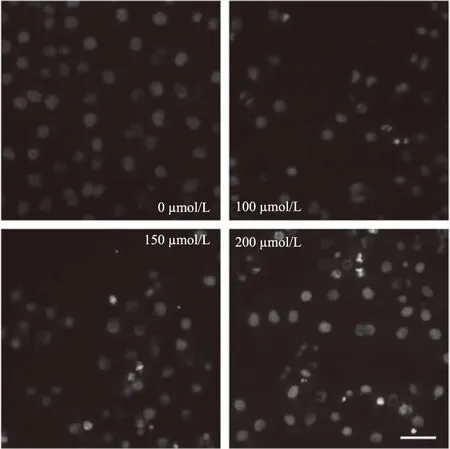
图12 不同浓度的生物碱3对舌癌Tca8113细胞形态的影响Fig.12 Effect of different concentrations ofalkaloids 3 on the morphology of Tca8113 cells
3 结论
本试验采用甲醇提取超声辅助提取法从天浆中提取天浆壳总生物碱并通过硅胶柱色谱法反复分离得到三种生物碱secu’amamine D、securinine、securitinine。MTT细胞活力检测法观察不同浓度的三种生物碱对Tca8113细胞的增殖抑制作用,结果显示,三种生物碱均对舌癌Tca8113细胞的增殖有明显的抑制作用,且呈浓度依赖性,IC50分别是157.12、189.22、136.07 μmol/L。采用Hoechst 33342染色液检测三种生物碱处理后的舌癌Tca8113细胞的凋亡情况,结果发现,给药组细胞发生凋亡,细胞变扁圆,染色质皱缩,细胞核成“新月”状或碎裂成小圆等特点,且这种凋亡形态呈浓度依赖性,改变随生物碱浓度的增加而明显,但具体促使细胞凋亡的机制仍需进一步研究。
