继发性B细胞型非霍奇金淋巴瘤患者的临床特征分析
2020-08-17苗昭艺姜亚楠王金焕吕扬扬邢东慧徐鸿翟翊辛赵智刚
苗昭艺,姜亚楠,王金焕,吕扬扬,邢东慧,徐鸿,翟翊辛,赵智刚△
多原发性恶性肿瘤(MPMTs)是指同一个体同时或异时出现2 种或2 种以上不同组织学特征的恶性肿瘤,同时排除转移或复发的可能[1]。根据MPMTs中第一原发肿瘤至第二原发肿瘤的诊断时间(TF2T),分为同时性MPMTs 以及异时性MPMTs。大多数研究者认为TF2T 在6 个月内者为同时性MPMTs;TF2T 超过 6 个月者为异时性 MPMTs[2]。伴随MPMTs 形式发生的非霍奇金淋巴瘤(NHL)也越来越多见[3-5]。部分接受放射治疗的非血液系统恶性肿瘤患者,继发包括NHL 等在内的第二恶性肿瘤[6]。同时,原发性NHL 的放化疗也与第二肿瘤的发生有一定相关性[7]。目前关于继发性非霍奇淋巴瘤(sNHL)的病例总结仍然较少。为促进临床医师对该病的认识及治疗,本研究总结了本院sNHL患者的临床表现、治疗方法及随访结果,现报告如下。
1 对象与方法
1.1 研究对象 回顾性分析2007 年1 月—2018 年5 月本院收治的2 853例sNHL患者的临床特征,其中47例(1.65%)表现为第二恶性肿瘤的临床特征,包括3 例T 细胞型sNHL,44例B细胞型sNHL。纳入标准:(1)第一原发恶性肿瘤为非血液系统恶性肿瘤。(2)第二原发恶性肿瘤经病理组织学检查确诊为NHL。(3)TF2T≥6 个月[2]。排除标准:(1)有转移瘤及有相互转化可能的患者。(2)罹患2种以上恶性肿瘤的患者。(3)临床基本资料不全以及失访的患者。本文以44例B细胞型sNHL为研究对象。
1.2 治疗方法 44 例中29 例(65.9%)为弥漫大B 细胞淋巴瘤(DLBCL),4例(9.1%)为滤泡淋巴瘤(FL),3例(6.8%)为套细胞淋巴瘤(MCL),8例(18.2%)为边缘区淋巴瘤(MZL)。对于29例DLBCL,其中22例可以明确细胞起源,分为生发中心型(GCB,n=7)和非生发中心型(non-GCB,n=15)。44例中第一原发恶性肿瘤治疗情况:29例为手术切除治疗,10例为手术联合化疗,2例为手术联合放疗,3例接受手术联合化疗及放疗。继发肿瘤的治疗情况:34例患者接受化疗,5例患者接受化疗+手术切除,4 例患者因结外病变或巨大包块接受放疗,1例结外边缘区B细胞淋巴瘤,黏膜相关淋巴组织型淋巴瘤(胃型)患者仅接受抗幽门螺杆菌治疗。中位化疗时间为6(2,8)个月。一线化疗方案为CHOP 方案(第1 天:环磷酰胺50 mg/m2,多柔比星 50 mg/m2,长春地辛 1.4 mg/m2;第 1~5天:醋酸泼尼松片100 mg),醋酸泼尼松片为口服,余为静脉滴注。复发难治患者为GDP 方案(第1、8 天:静脉滴注吉西他滨1 000 mg/m2;第1~4天:口服地塞米松40 mg/m2;第1~5天:静脉滴注顺铂75 mg/m2)或ICE 方案(第1~4 天:异环磷酰胺1 g/m2,卡铂25 mg/m2,依托泊苷60 mg/m2),均为静脉滴注。CD20+的DLBCL 或CD20+Ⅲ~Ⅳ期FL 患者在化疗前1 d静脉滴注利妥昔单抗(375 mg/m2)。根据利妥昔单抗的应用原则,将患者分为利妥昔单抗组(+R组,22例)与未利用利妥昔单抗组(-R组,22例)。
1.3 疗效评价 根据患者的临床表现、实验室以及影像学(CT、PET/CT)检查,参照卢加诺[8]疗效评价标准,将疗效分为完全缓解(CR)、部分缓解(PR)、疾病进展(PD),有效缓解(RR)=CR+PR。
1.4 随访 随访时间指从确诊第一原发肿瘤到死亡或随访截止的时间。总生存期(OS)定义为从第二恶性肿瘤的诊断时间开始至由任何原因引起患者死亡或截止随访日期(2018年5月31日)。无病生存期(DFS)是指第二恶性肿瘤的诊断时间至疾病复发时间或(因任何原因)死亡。
1.5 统计学方法 采用SPSS 22.0统计分析软件完成。计量资料以M(P25,P75)表示,单因素分析的组间数据比较采用Mann-WhitneyU检验。计数资料以例(%)表示,采用χ2检验。采用Kaplan-Meier 法绘制生存曲线,Log-rank 检验分析不同单因素与OS的关系,多因素生存分析采用Cox回归模型完成。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 44 例中最常见的第一原发恶性肿瘤为乳腺癌(10 例),最常见的sNHL 病理类型为DLBCL(29 例),见表1。淋巴瘤诊断时的中位年龄为 61.5(54.5,70.5)岁。男 20 例,女 24 例。61.4%(27/44)患者分期为Ⅲ/Ⅳ期。65.9%(29/44)的患者第一原发肿瘤诊断年龄<60 岁,59.1%(26/44)的患者sNHL诊断年龄≥60岁。sNHL的中位发生时间为63.4(25.2,146.9)个月。14例患者TF2T≥10年,其中7例继发于乳腺癌。
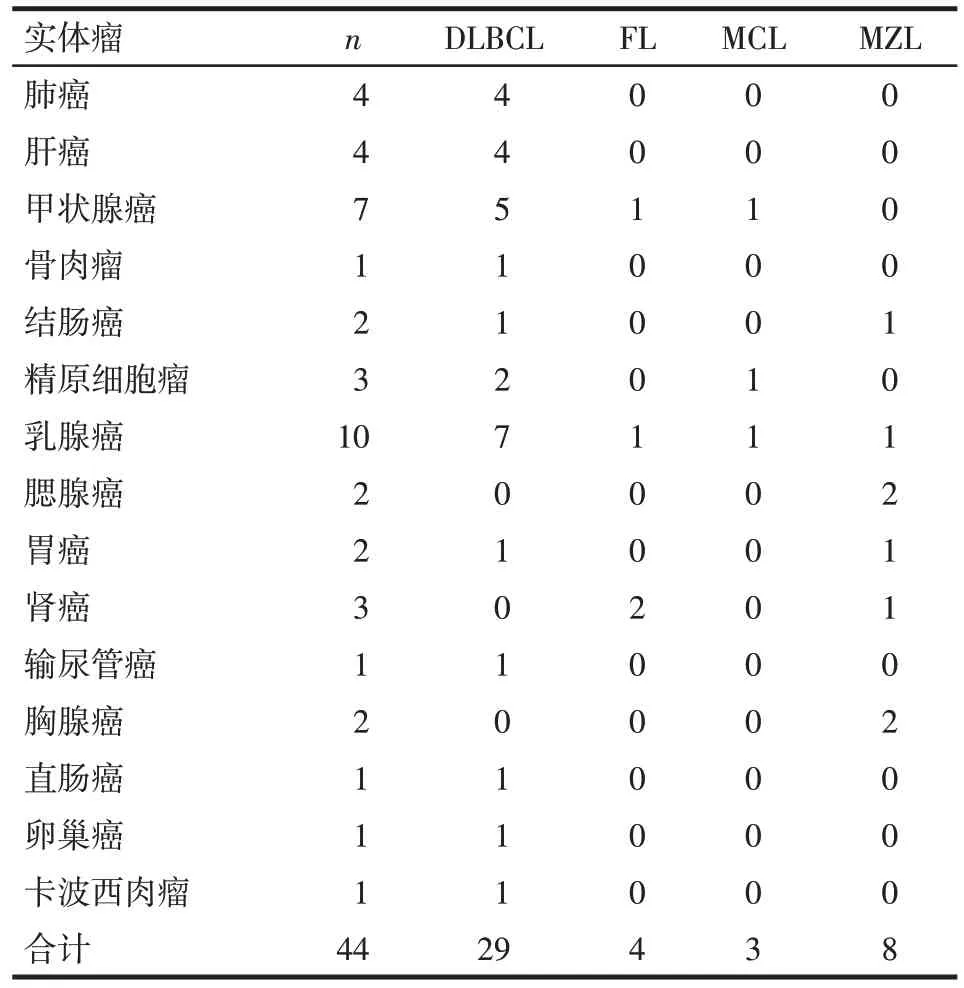
Tab.1 The distribution of primary first malignant tumors for sNHL表1 B细胞型sNHL第一恶性肿瘤分布情况
2.2 疗效评价及生存分析 中位随访时间11.4(4.2,28.8)个月。随访结束时12 例患者死亡,其中FL患者1例,MZL患者3例,DLBCL患者8例)。患者中位DFS 为9.6(4.1,26.0)个月。患者的3 年总生存率为73.5%,其中29 例DLBCL 患者的3 年总生存率为66.4%,见图1。一线治疗后CR率为38.6%,RR率为63.6%。-R 组和+R 组一线治疗CR 率(36.4%vs.45.5%)、RR率(54.5%vs.72.7%)差异无统计学意义(χ2分别为0.376、1.571,均P>0.05),总生存率(66.5%vs.81.1%)差异亦无统计学意义(Log-rankχ2=2.026,P>0.05),见图2。-R 组和+R 组中位生存时间分别为11.4(5.2,37.9)个月和 11.7(3.4,34.0)个月。GCB 和non-GCB 患者的1 年总生存率分别为62.5% 和83.1%,差异无统计学意义(Log-rankχ2=0.597,P>0.05),见图2。GCB和non-GCB患者的中位OS分别为6.7(3.7,14.5)个月和7.6(4.1,16.1)个月。

Fig.1 Survival curves of 44 cases of sNHL and 29 cases of DLBCL图1 44例sNHL和29例DLBCL患者的生存曲线
2.3 影响因素分析 单因素分析结果显示,对于第一原发恶性肿瘤或sNHL,生存分析均显示,诊断时年龄<60 岁患者总生存率高于诊断时年龄≥60 岁者,见图3。纳入Cox 回归模型,结果显示第一原发恶性肿瘤诊断年龄≥60 岁(赋值:<60 岁=0,≥60 岁=1;HR=4.745,95%CI:1.405~16.020)是影响sNHL患者生存率的独立危险因素。
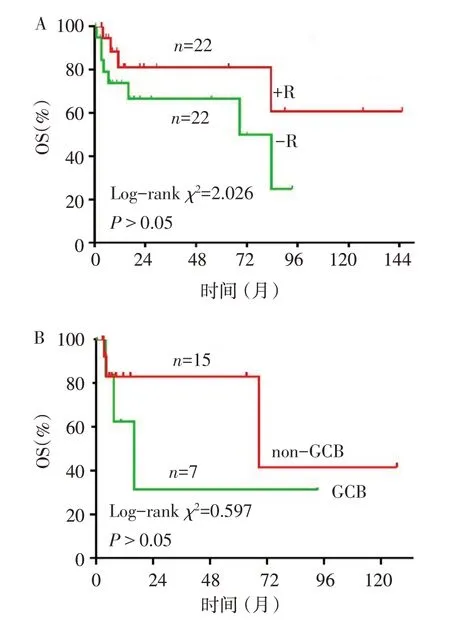
Fig.2 Survival curves of patients in different subgroups图2 不同分组患者的生存曲线
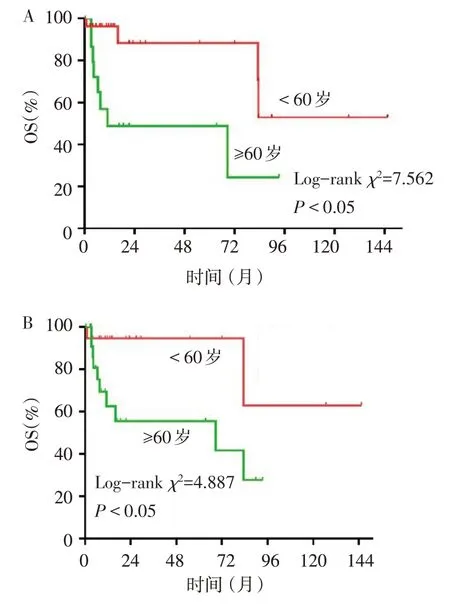
Fig. 3 Survival curves of sNHL patients with risk factors图3 sNHL患者危险因素分层的生存曲线
3 讨论
非血液系统恶性肿瘤继发NHL 属于MPMTs 的一种特殊类型。本研究中最常见的第一原发恶性肿瘤疾病类型为乳腺癌(10 例),最常见的sNHL 病理类型为DLBCL(29例),与原发性NHL一致[9]。
本研究中sNHL的预后与原发NHL相当。Pulte等[10]报道,与原发NHL患者相比,sNHL患者的结局更差,但这种差异在男性、sNHL 诊断年龄≥65 岁的患者中不存在,这可能与既往放化疗史引发患者对现阶段治疗的抵抗以及不耐受有关。另有学者推测sNHL 预后差可能与其存在更多的高侵袭性淋巴瘤等原因有关[11-12]。而Xavier等[13]在一项对于霍奇金淋巴瘤治疗后出现NHL 的研究中,对sNHL 和原发NHL 的预后生存进行了比较,表明侵袭性B 细胞淋巴瘤和T 细胞淋巴瘤患者的生存与原发NHL 相当,惰性B细胞淋巴瘤的预后较原发患者更差。本研究中,65.9%第一原发恶性肿瘤患者只接受手术治疗,为早期恶性肿瘤,这可能是本研究中sNHL的预后与原发NHL相当的原因,尚需扩大样本评估原发NHL与sNHL预后。
本研究发现第一原发恶性肿瘤诊断年龄是sNHL患者的独立预后因素。对于22例可以明确细胞起源的 DLBCL 患者,GCB 和 non-GCB 患者的 1 年总生存率差异无统计学意义。尚需扩大样本评估细胞分型与sNHL的预后关系。同时本研究也发现-R组和+R 组一线治疗CR 率、RR 率和总生存率差异均无统计学意义,提示sNHL患者应用利妥昔单抗的疗效尚待进一步研究验证。MPMT的肿瘤病理类型及治疗方式存在异质性,仍需进一步研究分析sNHL的预后相关因素。
目前对于 sNHL 病因尚不明确。Sacchi 等[14-15]研究证实高龄是第二肿瘤发生的危险因素。恶性肿瘤的放化疗、电离辐射也是继发性恶性血液病发生的重要原因以及预后的影响因素[16-17]。此外,一些抑癌基因的失活、免疫抑制剂的使用、环境污染等也与MPMTs的发生有关[18-19]。
综上所述,第一原发恶性肿瘤的诊断年龄是sNHL 患者的预后指标。随着基因组学及蛋白组学的快速发展,以及越来越多的大规模随机临床试验的开展,有望发现更多MPMTs 的发病机制、原发性和继发性恶性肿瘤之间是否存在某些联系以及制定出规范的sNHL治疗方案。
