紫苏叶多糖对糖尿病模型小鼠胰腺组织氧化应激及PI3K/AKT/GLUT4信号通路的影响
2020-08-16孙广平袁丽方晓琳杨海波
孙广平 袁丽 方晓琳 杨海波


摘 要 目的:研究紫苏叶多糖对糖尿病(DM)模型小鼠胰腺组织氧化应激及磷酸肌醇-3-激酶(PI3K)/苏氨酸蛋白激酶(AKT)/葡萄糖转运蛋白4(GLUT4)信号通路的影响。方法:取60只小鼠,采用腹腔注射链脲佐菌素(60 mg/kg)的方法复制糖尿病模型。将造模成功的40只小鼠随机分为模型组、二甲双胍组(阳性对照,200 mg/kg)和紫苏叶多糖高、低剂量组(400、200 mg/kg),每组10只;另取10只健康小鼠作为正常组(生理盐水)。每天灌胃给药1次,连續给药28 d。实验期间,观察小鼠一般状况和体质量变化;进行口服葡萄糖耐量(OGTT)实验[测定灌胃40%葡萄糖溶液0、30、60、120 min后的空腹血糖(FBG)水平]。末次给药后,测定小鼠血糖相关指标[FBG、空腹胰岛素(FINS)和胰岛素敏感指数(ISI)、胰岛素抵抗指数(IRI)]、血脂相关指标[血清中高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)]和氧化应激相关指标[胰腺组织中丙二醛(MDA)含量和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性]的变化,并测定小鼠胰腺组织中PI3K、磷酸化AKT(p-AKT)和GLUT4蛋白表达水平。结果:实验期间,与正常组比较,模型组小鼠行动迟缓,饲料消耗量和饮水量增多,体质量显著增加(P<0.05);给予葡萄糖0、30、60、120 min后,小鼠的FBG水平均显著升高(P<0.05);末次给药后,血清中FINS、HDL-C含量和ISI以及胰腺组织中SOD、CAT、GSH-Px活性和PI3K、p-AKT、GLUT4蛋白表达水平均显著降低(P<0.05),而血清中FBG、LDL-C、TC、TG含量和IRI以及胰腺组织中MDA含量均显著升高(P<0.05)。与模型组比较,各给药组小鼠一般情况和OGTT情况均有好转;血清中FINS、HDL-C含量和ISI以及胰腺组织中SOD、CAT、GSH-Px活性和PI3K、p-AKT、GLUT4蛋白表达水平均显著升高(P<0.05),而血清中FBG、LDL-C、TC、TG含量和IRI以及胰腺组织中MDA含量均显著降低(P<0.05)。结论:紫苏叶多糖具有抗糖尿病作用,该作用可能与降低氧化应激水平和促进PI3K/AKT/GLUT4信号通路的活化有关。
关键词 紫苏叶多糖;氧化应激;PI3K/AKT/GLUT4信号通路;糖尿病;小鼠
ABSTRACT OBJECTIVE: To study the effects of Purple frutescens leaves polysaccharides (PPLPs) on oxidative stress and PI3K/AKT/GLUT4 signaling pathway of pancreatic tissues in diabetes mellitus (DM) model mice. METHODS: Totally 60 mice were given intraperitoneal injection of STZ (60 mg/kg) to induce DM model. The 40 successful modeling mice were randomly divided into model group, metformin group (positive control, 200 mg/kg), PPLPs high-dose and low-dose groups (400, 200 mg/kg), with 10 mice in each group. Another 10 healthy mice were selected as the normal group (normal saline). They were given relevant medicine intragastrically, once a day, for consecutive 28 days. During the experiment, general information and body weight of mice were observed; oral glucose tolerance (OGTT) test (determining FBG at 0, 30, 60, 120 min after giving 40% glucose solution) was conducted. After last medication, the changes of related blood glucose indexes (FBG, FINS, ISI, IRI), blood lipid indexes (HDL-C, LDL-C, TC, TG) and oxidant stress indexes (MDA content and the activities of SOD, CAT, GSH-Px) as well as the protein expressions of PI3K, p-AKT and GLUT4 in pancreatic tissue were determined. RESULTS: During the experiment, compared with normal group, the mice were slow in action, the feed consumption and water consumption increased, and body weight significantly increased in model group (P<0.05). 0, 30, 60, 120 min after giving glucose, the FBG content of mice were all increased significantly (P<0.05). After last medication, the contents of FINS and HDL-C in serum as well as ISI, the activities of SOD, CAT and GSH-Px as well as the protein expressions of PI3K, p-AKT and GLUT4 in pancreatic tissue were all decreased significantly (P<0.05); the contents of FBG and LDL-C, TC and TG in serum as well as IRI, MDA content in pancreatic tissue were all increased significantly (P<0.05). Compared with model group, the general condition and OGTT of mice in each administration group was improved; the contents of FINS and HDL-C in serum as well as ISI, the activities of SOD, CAT and GSH-Px as well as the protein expressions of PI3K, p-AKT and GLUT4 in pancreatic tissue were all increased significantly (P<0.05); the contents of FBG, LDL-C, TC and TG in serum as well as IRI, MDA content of pancreatic tissue were decreased significantly (P<0.05). CONCLUSIONS: PPLPs has anti-diabetic effects, which are related to reducting oxidative stress level and promoting the activation of PI3K/AKT/GLUT4 signaling pathway.
KEYWORDS Purple frutescens leaves polysaccharides; Oxidative stress; PI3K/AKT/GLUT4 signaling pathway; Diabetes; Mice
糖尿病在当前世界范围内呈现广泛流行趋势,已成为威胁人类健康的最重要的慢性非传染性疾病之一[1]。国际糖尿病联盟2019年的统计数据表明,全球糖尿病患者人数已高达4.63亿人,而到2045年这一数据将增长至7亿人[2]。糖尿病患病率的日益增长给社会带来了沉重的负担。双胍类、葡萄糖苷酶抑制剂类、格列奈类、磺酰脲类药物是目前临床应用的主要口服降糖药,虽具有一定的降糖作用,但同时也存在着低血糖、肾毒性及肝毒性等多种副作用[3]。而中药治疗糖尿病及其并发症历史悠久,具有低毒副作用、疗效明确等优势[4]。
紫苏叶为唇形科植物紫苏[Perilla frutescens(L.) Britt.]的干燥叶(或带嫩枝),具有调节糖脂代谢、抗氧化、抗抑郁、止咳平喘、解热、镇静等多种功效,其中所含的多糖类、挥发油类、黄酮类、酚酸类及脂肪酸类成分是其主要活性成分[5]。有研究发现,给予自发性糖尿病模型大鼠紫苏茶叶后,可延缓其糖尿病的发生[6]。并且已有研究报道,紫苏叶总黄酮提取物可调节糖尿病模型小鼠糖脂代谢紊乱,具有较好的抗糖尿病作用[7]。然而,作为紫苏叶中主要活性成分之一的多糖类成分是否具有抗糖尿病作用目前尚未见报道。氧化应激和磷酸肌醇-3-激酶(PI3K)/苏氨酸蛋白激酶(AKT)/葡萄糖转运蛋白 4(GLUT4)信号通路在糖尿病的发生发展中扮演着重要角色[8-9]。因此,本研究主要研究紫苏叶多糖对糖尿病模型小鼠是否具有改善作用,并明确该作用与氧化应激及PI3K/AKT/GLUT4信号通路的关联性,初步阐明其抗糖尿病的作用及机制,为其进一步的临床应用奠定基础。
1 材料
1.1 仪器
AL204型分析天平(德国Mettler-Toledo公司);AU600型全自动生化分析仪(日本Olympus公司);1800型酶标仪(上海闪谱科技生物有限公司);T6型紫外-可见分光光度计(北京普析通用仪器有限责任公司);Universal Hood Ⅱ型凝胶成像系统、170-3930型蛋白电泳及转印仪(美国Bio-Rad公司);卓越纤巧型血糖仪(瑞士Roche公司)。
1.2 药品与试剂
紫苏叶药材于2018年8月采摘自吉林省吉林市地区,经北华大学药学院苑广信教授鉴定为唇形科植物紫苏[P. frutescens (L.) Britt.]的叶片;盐酸二甲双胍片(中美上海施贵宝公司,批号:20190427,规格:0.5 g);链脲佐菌素(STZ)对照品(美国Sigma公司,批号:S0130,纯度:≥98%);空腹血糖(FBG)、空腹胰岛素(FINS)测定试剂盒(湖南三诺生物公司,批号:190116、190223);高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)测定试剂盒(泉州睿信生物科技有限公司,批号:20190415、20190426、20190302、20190517);丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒(南京建成生物工程研究所,批号:20180908、20181120、20191120、20181018);兔源PI3K、磷酸化AKT(p-AKT)、GLUT4多克隆抗体(美国Abcam公司,批号:ab140307、ab8805、ab654);兔源β-肌动蛋白(β-actin)多克隆抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗(杭州景杰生物公司,批号:180526、180603);其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
SPF级昆明种小鼠70只,雄性,体质量为18~22 g,购自吉林大学实验动物中心,实验动物生产许可证号:SCXK(吉)2016-0001。饲养環境温度为20~25 ℃、相对湿度为40%~70%,饲养期间小鼠自由饮食。本实验经吉林市化工医院实验动物伦理委员会批准,按照中国伦理委员会有关动物研究指导原则开展。
2 方法
2.1 紫苏叶多糖的制备
将采摘的紫苏叶清洗、沥干和干燥后,粉碎过40目筛。称取500 g紫苏叶粉末,加入10倍体积(mL/g)水,在80 ℃水浴条件下浸提6 h,滤过。滤液加入3倍体积的无水乙醇进行沉淀,再经4%H2O2溶液脱色及Sevag法除蛋白[10],最终制得紫苏叶多糖,经苯酚-硫酸法[11]检测其多糖含量为75.6%。
2.2 造模、分组与给药
小鼠适应性饲养1周后,随机取60只小鼠,一次性腹腔注射以柠檬酸/柠檬酸钠缓冲液(0.1 mol/L,pH 4.4)新鲜配制的STZ溶液(60 mg/kg),复制糖尿病模型。注射3 d后,小鼠尾静脉取血并用血糖仪测定FBG含量,糖尿病小鼠模型成功建立的标准为FBG>16.7 mmol/L[12]。剩余10只健康小鼠作为正常组,注射等体积、同浓度和pH的柠檬酸/柠檬酸钠缓冲液。共有43只小鼠造模成功。选取造模成功的40只小鼠随机分为模型组、二甲双胍组(阳性对照,200 mg/kg)和紫苏叶多糖高、低剂量组(400、200 mg/kg),每组10只。正常组和模型组小鼠灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,灌胃体积均为0.2 mL/10 g,每天给药1次,连续给药28 d。其中,二甲双胍组小鼠的给药剂量是参考文献方法[13]设置的,紫苏叶多糖的剂量是参考文献方法[14]并结合预实验结果设置的。
2.3 小鼠一般情况及体质量测定
实验期间,每日观察各组小鼠行为活动、精神状态、毛色、大小便量、进食量及饮水量等情况,并在给药前及末次给药后分别称定小鼠的体质量。
2.4 小鼠口服葡萄糖耐量实验
灌胃给药21 d后,各组小鼠禁食不禁水12 h,随后灌胃40%葡萄糖溶液(2 g/kg)。分别于灌胃糖溶液0、30、60、120 min后,断尾取血并用血糖仪测定FBG含量。
2.5 小鼠血清中血糖、血脂相关指标测定
末次给药12 h后,各组小鼠摘眼球取血,以3 000 r/min离心10 min,分离血清。采用血糖仪测定FBG含量,酶联免疫吸附法测定FINS含量,全自动生化分析仪测定HDL-C、LDL-C、TC、TG含量。按公式计算胰岛素敏感指数(ISI)和胰岛素抵抗指数(IRI):ISI=ln(1/FBG× FINS);IRI=FBG×FINS/22.5。
2.6 小鼠胰腺组织中氧化应激水平测定
各组小鼠取血后处死,无菌操作分离其胰腺组织,将部分组织充分碾磨并经RIPA裂解液裂解后,以3 000 r/min离心10 min,制备组织上清液。采用硫代巴比妥酸法测定MDA含量,黄嘌呤氧化酶法测定SOD活性,硫代硫酸钠法测定CAT活性,二硫对硝基苯甲酸法测定GSH-Px活性,具体操作按照相应试剂盒说明书进行。
2.7 小鼠胰腺组织中PI3K、p-AKT、GLUT4蛋白表达水平测定
取各组小鼠另一部分胰腺组织,按“2.6”项下方法制备组织上清液,二喹啉甲酸(BCA)法测定总蛋白含量后,煮沸使蛋白变性。取蛋白20 μg,行12%聚丙烯酰胺凝胶电泳分离目的蛋白(其中浓缩胶电压为70 V,电泳时间为40 min;分离胶电压为120 V,电泳时间约为1.5 h),然后电转(电流为120 mA,时间为2 h)至硝酸纤维素膜上;用牛奶封闭1 h,分别加入稀释比例均为1 ∶ 2 000的PI3K、p-AKT、GLUT4和β-actin一抗,在4 ℃条件下孵育过夜;以TBST漂洗3次后,加入相应二抗(稀释比例为 1 ∶ 5 000),在常温下继续孵育40 min;以TBST漂洗3次,加入ECL试剂显色。采用凝胶成像系统显影后,以Image J v1.8.0软件分析各条带灰度值,以目的蛋白条带灰度值与内参β-actin条带灰度值的比值表示目的蛋白的相对表达水平。
2.8 统计学方法
采用SPSS 18.0统计学软件进行数据分析。结果以x±s表示,多组间比较采用单因素方差分析,方差齐时组间两两比较采用Bonferroni法,方差不齐时组间两两比较采用Nemenyi法。P<0.05表示差异具有统计学意义。
3 结果
3.1 紫苏叶多糖对糖尿病模型小鼠一般状况及体质量的影响
正常组小鼠行动活跃,精神状态良好,皮毛干燥光滑,大小便量、进食量及饮水量均正常;模型组小鼠行动较迟缓,精神萎靡不振,毛发有不同程度的脱落或纠结成簇,大小便量增加,饲料消耗量和饮用水增多;二甲双胍组和紫苏叶多糖高、低剂量组小鼠一般状况较模型组均有一定程度的改善。给药前,各组小鼠的体质量差异均无统计学意义(P>0.05);灌胃给药28 d后,与正常组比较,模型组小鼠体质量显著降低(P<0.05);与模型组比较,二甲双胍组和紫苏叶多糖高、低剂量组小鼠体质量均有不同程度的升高,但差异均无统计学意义(P>0.05)。上述结果提示,紫苏叶多糖可以改善糖尿病模型小鼠的一般状况,但对体质量并无明显影响。各组小鼠体质量测定结果见表1。
3.2 紫苏叶多糖对糖尿病模型小鼠口服葡萄糖耐量的影响
灌胃葡萄糖溶液0~30 min后,各组小鼠的FBG水平均呈逐渐增加的趋势;而在灌胃30~120 min后,其血糖水平又均呈逐渐降低的趋势。与正常组比较,模型组小鼠在灌胃葡萄糖溶液0、30、60、120 min后FBG水平均显著升高(P<0.05);与模型组比较,二甲双胍组和紫苏叶多糖高、低剂量组小鼠在灌胃葡萄糖溶液0、30、60、120 min后其FBG水平均显著降低(P<0.05)。各组小鼠灌胃葡萄糖溶液不同時间后的FBG测定结果见表2。
3.3 紫苏叶多糖对糖尿病模型小鼠血清中FBG、FINS含量及ISI、 IRI的影响
与正常组比较,模型组小鼠血清中FBG含量和IRI均显著升高(P<0.05),而FINS含量和ISI均显著降低(P<0.05);与模型组比较,二甲双胍组和紫苏叶多糖高、低剂量组小鼠血清中FBG含量和IRI均显著降低(P<0.05),FINS含量和ISI均显著升高(P<0.05)。各组小鼠血清中FBG、FINS含量及ISI、 IRI测定结果见表3。
3.4 紫苏叶多糖对糖尿病模型小鼠血清中HDL-C、LDL-C、TC和TG含量的影响
与正常组比较,模型组小鼠血清中HDL-C含量显著降低(P<0.05),LDL-C、TC、TG含量均显著升高(P<0.05);与模型组比较,二甲双胍组和紫苏叶多糖高、低剂量组小鼠血清中HDL-C含量均显著升高(P<0.05),LDL-C、TC、TG含量均显著降低(P<0.05)。各组小鼠血清中HDL-C、LDL-C、TC和TG含量测定结果见表4。
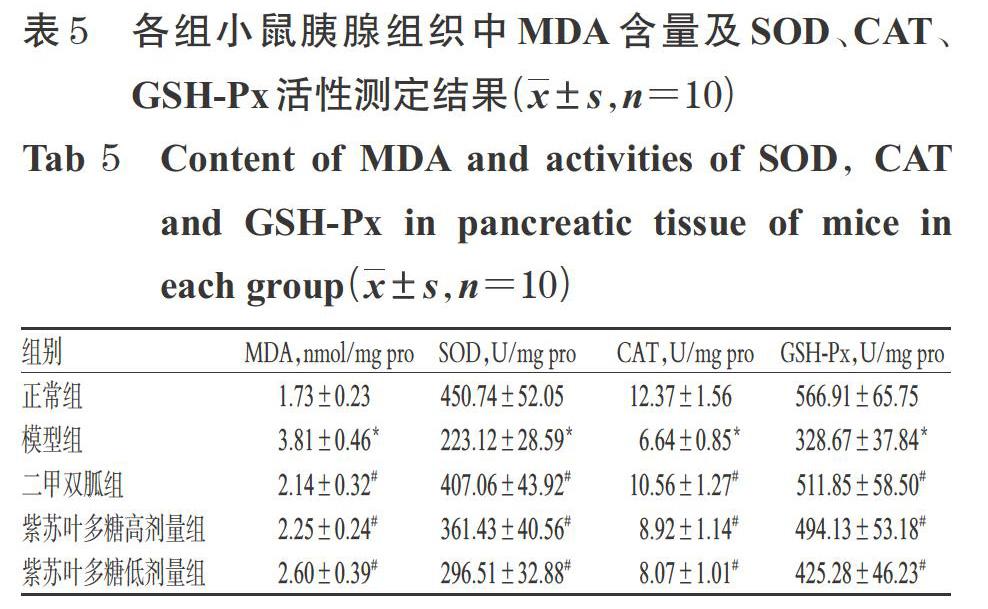
3.5 紫苏叶多糖对糖尿病模型小鼠胰腺组织中MDA含量和SOD、CAT、GSH-Px活性的影响
与正常组比较,模型组小鼠胰腺组织中MDA含量显著升高(P<0.05),SOD、CAT、GSH-Px活性均显著降低(P<0.05)。与模型组比较,二甲双胍组和紫苏叶多糖高、低剂量组小鼠胰腺组织中MDA含量均显著降低(P<0.05),SOD、CAT、GSH-Px活性均显著升高(P<0.05)。各组小鼠胰腺组织中MDA含量及SOD、CAT、GSH-Px活性测定结果见表5。
3.6 紫苏叶多糖对糖尿病模型小鼠胰腺组织中PI3K、p-AKT和GLUT4蛋白表达水平的影响
与正常组比较,模型组小鼠胰腺组织中PI3K、p-AKT、GLUT4蛋白表达水平显著降低(P<0.05);与模型组比较,二甲双胍组和紫苏叶多糖高、低剂量组小鼠胰腺组织中PI3K、p-AKT、GLUT4蛋白表达水平均显著升高(P<0.05)。各组小鼠胰腺组织中PI3K、p-AKT和GLUT4蛋白表达的电泳图见图1,蛋白表达水平测定结果见表6。
4 讨论
本研究通过口服葡萄糖耐量实验,发现紫苏叶多糖可改善糖尿病模型小鼠的葡萄糖耐受。灌胃给予紫苏叶多糖28 d后,发现其可升高模型小鼠血清中FINS、HDL-C含量和ISI,并降低血清中FBG、LDL-C、TC、TG含量和IRI。以上结果表明,紫苏叶多糖具有抗糖尿病作用,并可调节糖尿病模型小鼠的血脂代谢紊乱。
氧化应激在糖尿病早期、进程及并发症进展中具有重要作用,与糖尿病的发生、发展密切相关[15]。抗氧化疗法目前已是临床上糖尿病治疗的重要手段,在降低糖脂水平的前提下进行抗氧化治疗,能够更加有效地提高胰岛素的敏感性,改善葡萄糖耐受水平[16]。已有研究证实,植物多糖可通过降低氧化应激水平发挥其抗糖尿病作用:例如,黄芪多糖可以升高2型糖尿病模型大鼠骨骼肌中SOD、GSH含量,降低MDA含量,进而缓解糖尿病的进程[17];再如,金耳环多糖也可通过提高机体抗氧化能力,进而调节实验性2型糖尿病模型大鼠的血脂代谢紊乱[18]。本研究通过检测紫苏叶多糖对糖尿病模型小鼠胰腺组织中氧化应激指标MDA含量和SOD、CAT、GSH-Px活性的影响,发现其可以有效降低MDA含量并升高SOD、CAT、GSH-Px活性。以上结果提示,紫苏叶多糖可能通过改善机体氧化应激水平,进而发挥其抗糖尿病作用。
相关研究证实,PI3K/AKT/GLUT4信号通路的活化对胰岛β细胞分泌胰岛素具有重要意义,其不仅可以促进组织对葡萄糖的摄取,还可以减弱胰岛素抵抗[19]。AKT为PI3K信号通路下游的重要靶蛋白;GLUT4是葡萄糖转运的主要转运体,其介导的跨膜运转是葡萄糖摄取的关键步骤[20]。当胰岛素信号到达细胞膜后,与胰岛素受体底物1(IRS1)结合,引起酪氨酸蛋白激酶活化;后者又使IRS1发生磷酸化反应并与PI3K调节亚基p85发生结合,激活催化亚基p110,活化PI3K;活化的PI3K可以促进下游靶蛋白AKT发生磷酸化,使细胞质膜上的p-AKT释放并转移至细胞质内,诱导GLUT4表达,介导葡萄糖转运至细胞,最终发挥升高胰岛素敏感性及调节血糖的作用[21]。而氧化应激与PI3K/AKT/ GLUT4信号通路的活化有关,氧化应激水平的增加可以促使活性氧(ROS)大量生成,进而阻断PI3K/AKT GLUT4信号通路的激活[22]。通过促进PI3K/AKT/GLUT4信号通路的活化而发挥抗糖尿病的作用也已被研究证实:例如马欢等[23]研究发现,糖通饮可降低糖尿病模型大鼠血糖水平并改善胰岛素抵抗水平,其机制可能与升高PI3K/AKT/GLUT4信号通路中p-AKT的表达水平有关;再如,Rai U等[24]也发现,川芎嗪也可以通过激活PI3K/AKT/GLUT4信号通路,促进PI3K、p-AKT和GLUT4的表达,最终降低高脂饮食联合STZ诱导的2型糖尿病模型小鼠的血糖。本研究结果显示,给予糖尿病模型小鼠紫苏叶多糖后,其胰腺组织中PI3K、p-AKT和GLUT4蛋白表达水平均显著升高,这表明紫苏叶多糖的抗糖尿病作用可能也与促进PI3K/AKT/GLUT4信号通路的活化有关。
综上,紫苏叶多糖具有抗糖尿病作用,该作用与降低氧化应激水平和促进PI3K/AKT/GLUT4信号通路的活化有关。
参考文献
[ 1 ] WANG J,WANG MY,WANG H,et al. Status of glycosy- lated hemoglobin and prediction of glycemic control among patients with insulin-treated type 2 diabetes in North China:a multicenter observational study[J]. Chin Med J:Engl,2020,133(1):17-24.
[ 2 ] IWASAKI T,FUKUDA H,KITAMURA M,et al. Association between number of pairs of opposing posterior teeth,metabolic syndrome,and obesity[J]. Odontology,2019,107(1):111-117.
[ 3 ] BAGEPALLY BS,GURAV YK,ANOTHAISINTAWEE T,et al. Cost utility of sodium-glucose cotransporter 2 inhibitors in the treatment of metformin monotherapy failed type 2 diabetes patients:a systematic review and meta-analysis[J]. Value Health,2019,22(12):1458-1469.
[ 4 ] 宋保兰.抗2型糖尿病中藥活性成分研究进展[J].时珍国医国药,2017,28(5):1193-1195.
[ 5 ] 何育佩,郝二伟,谢金玲,等.紫苏药理作用及其化学物质基础研究进展[J].中草药,2018,49(16):3957-3968.
[ 6 ] KISHI H,KOMATSU W,MIURA Y,et al. Effects of habitual perilla (shiso) tea drinking on the incidence of diabetes mellitus in spontaneously diabetic Trii (SDT) rats[J]. Biosci Biotechnol Biochem,2010,74(12):2490- 2493.
[ 7 ] 何佳奇,李效贤,熊耀康.紫苏总黄酮提取物对四氧嘧啶致糖尿病小鼠糖脂代谢及抗氧化水平的影响[J].中华中医药学刊,2011,29(7):1667-1669.
[ 8 ] NEWSHOLME P,CRUZAT VF,KEANE KN,et al. Molecular mechanisms of ROS production and oxidative stress in diabetes[J]. Biochem J,2016,473(24):4527- 4550.
[ 9 ] GUO X,SUN W,LUO G,et al. Panax notoginseng saponins alleviate skeletal muscle insulin resistance by regula- ting the IRS1-PI3K-AKT signaling pathway and GLUT4 expression[J]. FEBS Open Bio,2019,9(5):1008-1019.
[10] 张芸,倪德江,余志,等.乌龙茶多糖的聚酰胺柱层析法纯化工艺[J].食品科学,2014,35(14):1-4.
[11] 于淼,王冰,付叶珊,等.响应面法优化刺五加根废弃物多糖提取工艺的研究[J].中草药,2019,20(7):1610-1613.
[12] SHUANG J,YONG T,YANG B,et al. Protective effect of Coptis chinensis polysaccharide against renal injury by suppressing oxidative stress and inflammation in diabetic rats[J]. Natural Product Communications,2019,14(9):1-7.
[13] 刘率男,刘泉,孙素娟,等.二甲双胍对2型糖尿病KKAy小鼠胰岛β细胞功能的影响及初步作用机制探讨[J].药学学报,2014,49(11):1554-1562.
[14] 李冲伟,宋永,孙庆申.微波辅助提取紫苏多糖及保肝降酶活性的研究[J].中国农学通报,2014,30(9):285-290.
[15] ARDESHIRLARIJANI E,TABATABAEI-MALAZY O,MOHSENI S,et al. Effect of probiotics supplementation on glucose and oxidative stress in type 2 diabetes mellitus:a meta-analysis of randomized trials[J]. DARU,2019,27(2):827-837.
[16] OGUNTIBEJU OO. Type 2 diabetes mellitus,oxidative stress and inflammation:examining the links[J]. Int J Physiol Pathophysiol Pharmacol,2019,11(3):45-63.
[17] 贺映侠,朱虹.黄芪多糖对2型糖尿病大鼠骨骼肌氧化应激水平及SIRT3表达的影响[J].中国老年学杂志,2018,38(12):3023-3025.
[18] 周多强,李溥,罗良琦,等.水药金耳环多糖对实验性2型糖尿病模型大鼠糖脂代谢、肾功能及氧化应激的影响[J].中国药房,2017,28(31):4415-4419.
[19] ZUO ML,WANG AP,TIAN Y,et al. Oxymatrine ameliorates insulin resistance in rats with type 2 diabetes by regulating the expression of KSRP,PETN,and AKT in the liver[J]. J Cell Biochem,2019,120(9):16185-16194.
[20] 陈洁,刘一然.姜黄素对2型糖尿病大鼠脂肪细胞葡萄糖转运及PI3K/Akt信号通路的影响[J].中国比较医学,2019,29(5):90-97.
[21] LIU Y,DENG J,FAN D. Ginsenoside Rk3 ameliorates high-fat-diet/streptozocin induced type 2 diabetes mellitus in mice via the AMPK/Akt signaling pathway[J]. Food Funct,2019,10(5):2538-2551.
[22] 张雷,李东哲,陈志宏.丝胶蛋白对2型糖尿病大鼠肾脏氧化应激损伤和PI3K/Akt信号通路的影响[J].中国老年学杂志,2020,40(4):831-834.
[23] 马欢,高楠楠,陈俞如,等.糖通飲对2型糖尿病大鼠胰腺组织PI3K-AKT通路的影响[J].贵州医科大学学报,2020,45(1):1-6.
[24] RAI U,KOSURU R,PRAKASH S,et al. Tetramethylpyrazine prevents diabetes by activating PI3K/Akt/GLUT-4 signalling in animal model of type-2 diabetes[J]. Life Sci,2019. DOI:10.1016/j.lfs.2019.116836.
(收稿日期:2020-02-03 修回日期:2020-06-02)
(编辑:林 静)
