龙胆苦苷对人胰腺癌细胞PANC-1凋亡及IL-6/JAK2/STAT3信号通路的影响
2020-08-16孟松周耀柱马永超徐松涛金少举
孟松 周耀柱 马永超 徐松涛 金少举
摘 要 目的:研究龍胆苦苷对人胰腺癌细胞PANC-1凋亡的影响,并从白细胞介素6(IL-6)/Janus激酶2(JAK2)/信号转导与转录激活因子3(STAT3)信号通路角度研究其作用机制。方法:以PANC-1细胞为研究模型,采用MTT法测定0(阴性对照)、2、4、8、16、32、64、128 mg/L龙胆苦苷作用于细胞72 h后的增殖抑制率,并计算其半数抑制浓度(IC50)。分别将细胞分为阴性对照组、吉西他滨组(阳性对照,4 mg/L)和龙胆苦苷低、中、高浓度组(15、30、60 mg/L)。分别于培养1、3、5、7 d后,采用台盼蓝拒染法进行活细胞计数,考察各组细胞的生长情况;培养72 h后,采用克隆形成试验考察细胞的克隆形成率,采用Hoechst 33258染色法检测细胞凋亡率,采用逆转录-聚合酶链式反应法和Western blotting法分别测定细胞中IL-6、JAK2、STAT3 mRNA及其蛋白表达水平。结果:4~28 mg/L龙胆苦苷均可显著抑制细胞的增殖(P<0.05或P<0.01),并具有一定的浓度依赖性趋势,IC50为9.54 mg/L。与阴性对照组比较,吉西他滨组和龙胆苦苷中、高浓度组活细胞计数(作用3、5、7 d)和细胞中IL-6、JAK2、STAT3 mRNA及其蛋白表达水平均显著降低(P<0.05或P<0.01),细胞凋亡率均显著升高(P<0.01);吉西他滨组和龙胆苦苷高浓度组细胞的克隆形成率均显著降低(P<0.01)。与吉西他滨组比较,龙胆苦苷高浓度组细胞中上述指标水平差异均无统计学意义(P>0.05)。结论:30、60 mg/L龙胆苦苷可显著抑制PANC-1细胞的增殖、诱导其凋亡,60 mg/L龙胆苦苷的作用与吉西他滨相当;其作用机制可能与抑制细胞中IL-6/JAK2/STAT3信号通路的激活有关。
关键词 龙胆苦苷;人胰腺癌细胞PANC-1;凋亡;白细胞介素6;Janus激酶2;信号转导与转录激活因子3;机制
ABSTRACT OBJECTIVE:To study the effects of gentiopicroside on the apoptosis of human pancreatic cancer cells PANC-1,and to explore its mechanism from the perspective of IL-6/JAK2/STAT3 signaling pathway. METHODS:Using PANC-1 cells as model,the proliferation inhibition rate of cells was tested by MTT assay after treated with 0 (negative contro),2,4,8,16,32,64,128 mg/L gentiopicroside for 72 h and IC50 were calculated. The cells were divided into negative control group,gemcitabine group (positive control, 4 mg/L) and gentiopicroside low-concentration,medium-concentration and high-concentration groups (15,30, 60 mg/L). After cultured for 1,3,5,7 d,Trypan blue exclusion staining was used to count the survival cell,and the growth of cells was investigated. After cultured for 72 h,colony formation assay was used to observe colony formation rate of cells; the apoptotic rate of cells was detected by Hoechst 33258 staining; the mRNA and protein expressions of IL-6,JAK2,STAT3 in cells were detected by RT-PCR and Western blotting assay. RESULTS:4-28 mg/L gentiopicroside could inhibit the proliferation of cells (P<0.05 or P<0.01), in concentration dependent trend; IC50 was 9.54 mg/L. Compared with negative control group, survival cell count (cultured from 3,5,7 d),mRNA and protein expressions of IL-6,JAK2 and STAT3 in cells were decreased significantly in gemcitabine group,gentiopicroside medium-concentration and high-concentration groups (P<0.05 or P<0.01), while the apoptotic rate was increased significantly (P<0.01). The colony formation rate of cells were decreased significantly in gemcitabine group and gentiopicroside high-concentration group (P<0.01). Compared with gemcitabine group,there was no statistical significance in above indexes of gentiopicroside high- concentration group (P>0.05). CONCLUSIONS:30,60 mg/L gentiopicroside could inhibit the proliferation and induce apoptosis of PANC-1 cells,and 60 mg/L gentiopicroside is similar to gemcitabine in the effects. Its mechanism may be related to inhibiting the activation of IL-6/JAK2/STAT3 signaling pathway.
KEYWORDS Gentiopicroside; Human pancreatic cancer cells PANC-1; Apoptosis;IL-6; JAK2; STAT3; Mechanism
胰腺癌(Pancreatic cancer)是臨床上常见的消化系统肿瘤,具有起病隐匿、早期诊断困难、预后差及病死率高等特点,恶性程度极高[1-2]。胰腺癌发病机制复杂,目前认为炎症反应与其发生、发展、转移及预后密切相关,加速了疾病的进程[3-4]。白细胞介素6(IL-6)/Janus激酶2(JAK2)/信号转导与转录激活因子3(STAT3)信号通路是目前发现的重要的炎症信号通路之一,参与了机体的免疫调节、血管生成及细胞的增殖分化等多种生理病理过程,与肿瘤的发生、发展、转移及侵袭等生物学行为密切相关,且其表达异常对肿瘤的预后有重要指导意义[5-6]。因此,抑制和调控IL-6/JAK2/STAT3信号通路有助于肿瘤的防治及改善预后,同时其也是筛选抗肿瘤药物的重要靶点之一[7-8]。龙胆苦苷(Gentiopicroside)是从秦艽、龙胆草等龙胆科龙胆属植物中提取的一种环烯醚萜苷类单体化合物,具有抗炎、抗氧化应激、抗风湿及抗肝损伤等药理作用[9];亦有报道指出,龙胆苦苷具有抑制卵巢癌、肝癌及肺癌等肿瘤细胞的增殖、迁移等作用[10-12],但龙胆苦苷对胰腺癌的影响尚未见文献报道。基于此,本文通过研究龙胆苦苷对胰腺癌细胞PANC-1增殖、凋亡的影响,同时检测IL-6/JAK2/STAT3信号通路相关因子表达水平的变化,初步探讨其抗胰腺癌的作用及机制,旨在为深入研究龙胆苦苷抗肿瘤药理作用提供依据。
1 材料
1.1 仪器
CKX53型荧光倒置显微镜[奥林巴斯(中国)有限公司];ST-360型酶标仪(上海科华生物工程股份有限公司);Forma 系列3水套式CO2培养箱[赛默飞世尔科技(中国)有限公司];SJ-CJ-2FD型超净工作台[苏洁医疗器械(苏州)有限公司];GelDoc XR+型凝胶成像仪、Mini-PROTEAN? Tetra Cell型小型垂直电泳槽、小型Trans-Blot转印槽、S1000TM 96 Deep Well 型聚合酶链式反应(PCR)仪[伯乐生命医学产品(上海)有限公司];AE224型电子天平(上海恒平科学仪器有限公司)。
1.2 药品与试剂
龙胆苦苷标准品[南京泽朗生物科技有限公司,批号:20180526,纯度:≥98%;临用时用含0.1%二甲基亚砜(DMSO)的培养基配制为相应药液];胎牛血清(美国HyClone公司,批号:20180415);Beyozol总RNA抽提试剂、BeyoRTTM Ⅲ cDNA第一链合成试剂盒、Easy-LoadTM PCR Master Mix(Blue,2×)、琼脂糖(碧云天生物技术有限公司,批号:R0011、D7178S、D7251、ST004L);Giemsa染色液(南京建成生物工程研究所,批号:180215);Hoechst 33258染色液、NP-40裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒(武汉博士德生物工程有限公司,批号:AR1169、AR0107、AR0197、AR0138);兔抗IL-6、JAK2、STAT3多克隆抗体以及辣根过氧化物酶标记的羊抗兔免疫球蛋白G(H+L) 二抗(美国 Affinity Biosciences公司,批号:DF6087、AF6022、AF6294、A0001);DMEM高糖培养基(北京索莱宝科技有限公司);其余试剂均为分析纯,水为超纯水。PCR试验所需引物由苏州金唯智生物科技有限公司设计与合成。
1.3 细胞
人胰腺癌细胞株PANC-1购自中国科学院上海生命科学研究院细胞资源中心。
2 方法
2.1 细胞培养与处理
将PANC-1细胞置于含12%胎牛血清的DMEM培养基中,于5%CO2、饱和湿度、37 ℃条件CO2培养箱中培养(培养条件下同),每2~3 天更换1次培养液,当细胞长满至培养瓶80%~95%时进行传代。待细胞生长至对数生长期(3~4代细胞)时进行相关试验,每项试验均重复3次。
2.2 龙胆苦苷对PANC-1细胞增殖的影响考察
采用MTT法进行测定。收集对数生长期PANC-1细胞,以0.25%胰酶消化后制成密度为5×103个/mL的细胞悬液,按200 μL/孔的细胞密度接种于96孔板中,培养24 h待细胞贴壁后,分别加入终质量浓度为0(阴性对照)、2、4、8、16、32、64、128 mg/L的含龙胆苦苷培养基,每个质量浓度设3个复孔。培养72 h后,加入0.5% MTT溶液20 μL,继续培养4 h后终止培养。小心吸弃培养孔内上清液,然后加入DMSO 150 μL,于水平摇床上振荡15 min使结晶物充分溶解,最后用酶标仪于490 nm波长处测定各孔吸光度(OD)值,OD值越高,则细胞活性越高。按照公式计算龙胆苦苷对PANC-1细胞的增殖抑制率:增殖抑制率(%)=(1-试验孔OD值/阴性对照孔OD值)×100%。应用Graphpad Prism 5.0软件计算半数抑制浓度(IC50)。
2.3 龙胆苦苷对PANC-1细胞生长的影响考察
采用台盼蓝拒染法进行测定。收集对数生长期PANC-1细胞,以0.25%胰酶消化后制成密度为1×104 个/mL的细胞悬液,按100 μL/孔的细胞密度接种于96孔板中。将细胞分为阴性对照组、阳性对照组和龙胆苦苷低、中、高浓度组,每组设3个复孔。待细胞贴壁后,阴性对照组细胞加入100 μL常规培养液,阳性对照组细胞加入终质量浓度为4 mg/L的含吉西他滨培养基[13],龙胆苦苷低、中、高浓度组细胞分别加入终质量浓度为15、30、60 mg/L的含龙胆苦苷培养基。于给药培养第1、3、5、7 天,分别收集细胞并制成悬液,与0.4%台盼蓝溶液以9 ∶ 1(V/V)的比例混合均匀,在3 min内,用计数板计数活细胞数(显微镜下观察,死细胞被染成淡蓝色,而活细胞拒染)。
2.4 龙胆苦苷对PANC-1细胞克隆形成的影响考察
采用克隆形成试验进行测定。收集对数生长期PANC-1细胞,以0.25%胰酶消化后制成細胞悬液,按500个/皿接种于60 mm培养皿中,按“2.3”项下方法分组、给药,培养72 h。吸弃培养皿中培养液,更换为无药新鲜培养基后继续培养,直至每个培养皿中均出现50个以上克隆即终止试验。将培养皿中培养基小心倒弃,以磷酸盐缓冲液(PBS)漂洗细胞3 min×2~3次,甲醇固定20 min,再用Giemsa溶液染色15 min,然后置于倒置显微镜下计数大于50个细胞的克隆数。按照公式计算克隆形成率:克隆形成率(%)=克隆数/接种细胞数×100%。
2.5 龙胆苦苷对PANC-1细胞凋亡的影响考察
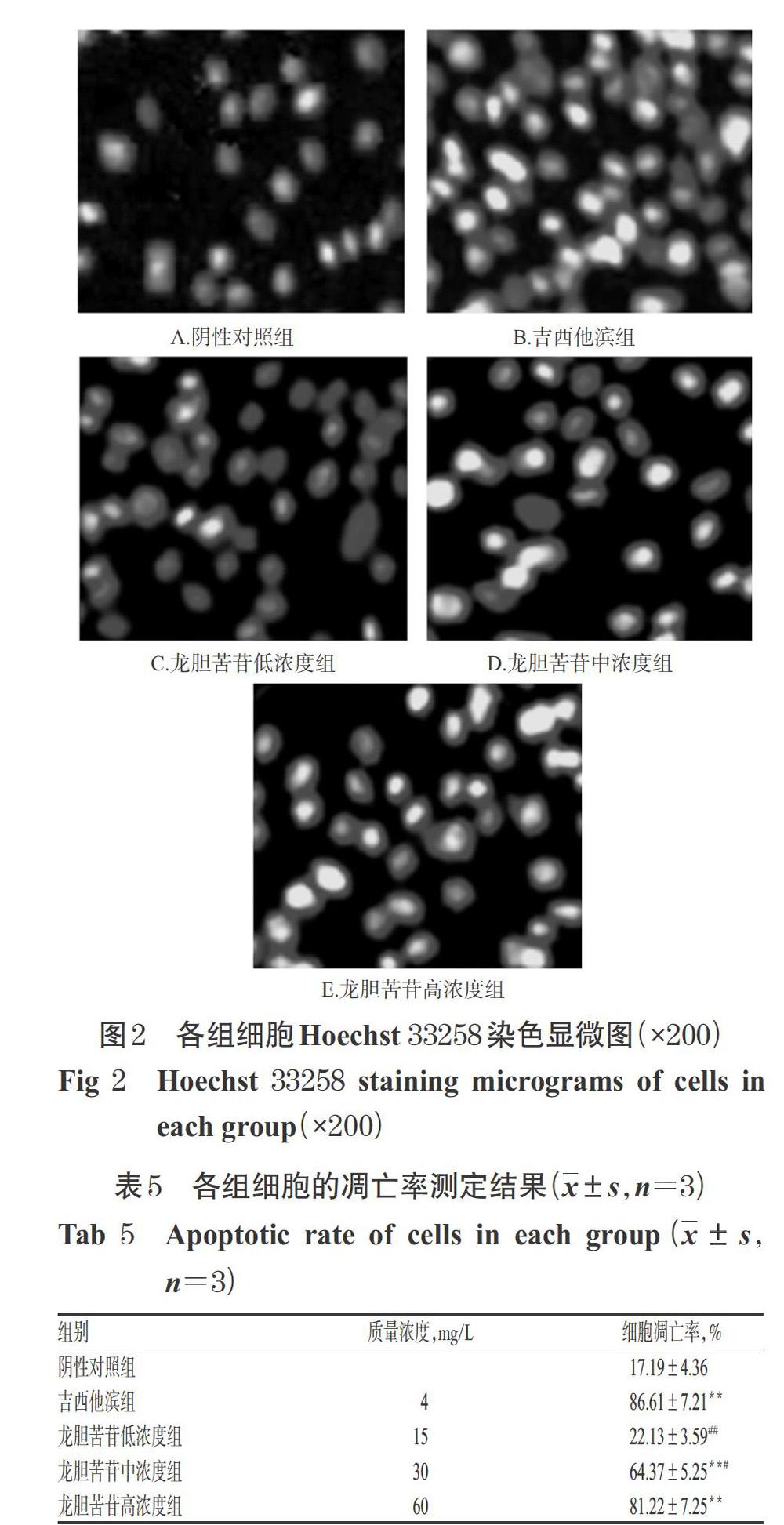
采用Hoechst 33258荧光染色法进行测定。收集对数生长期PANC-1细胞,以0.25%胰酶消化后制成密度为2×105个/mL的细胞悬液,以2 mL/孔接种于6孔板中,按“2.3”项下方法分组、给药,培养72 h。吸弃培养液,用无菌PBS溶液漂洗细胞3 min×2~3次,用4%多聚甲醛溶液固定30 min,然后加入Hoechst 33258染色液(5 μg/mL),室温下避光染色15 min,再在超净工作台中风干后,于荧光倒置显微镜下观察细胞凋亡情况(正常细胞核染为均匀蓝色,凋亡细胞核固缩、呈强蓝色致密浓染)。按照公式计算细胞凋亡率:细胞凋亡率(%)=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
2.6 龙胆苦苷对PANC-1细胞中IL-6、JAK2和STAT3 mRNA表达的影响考察
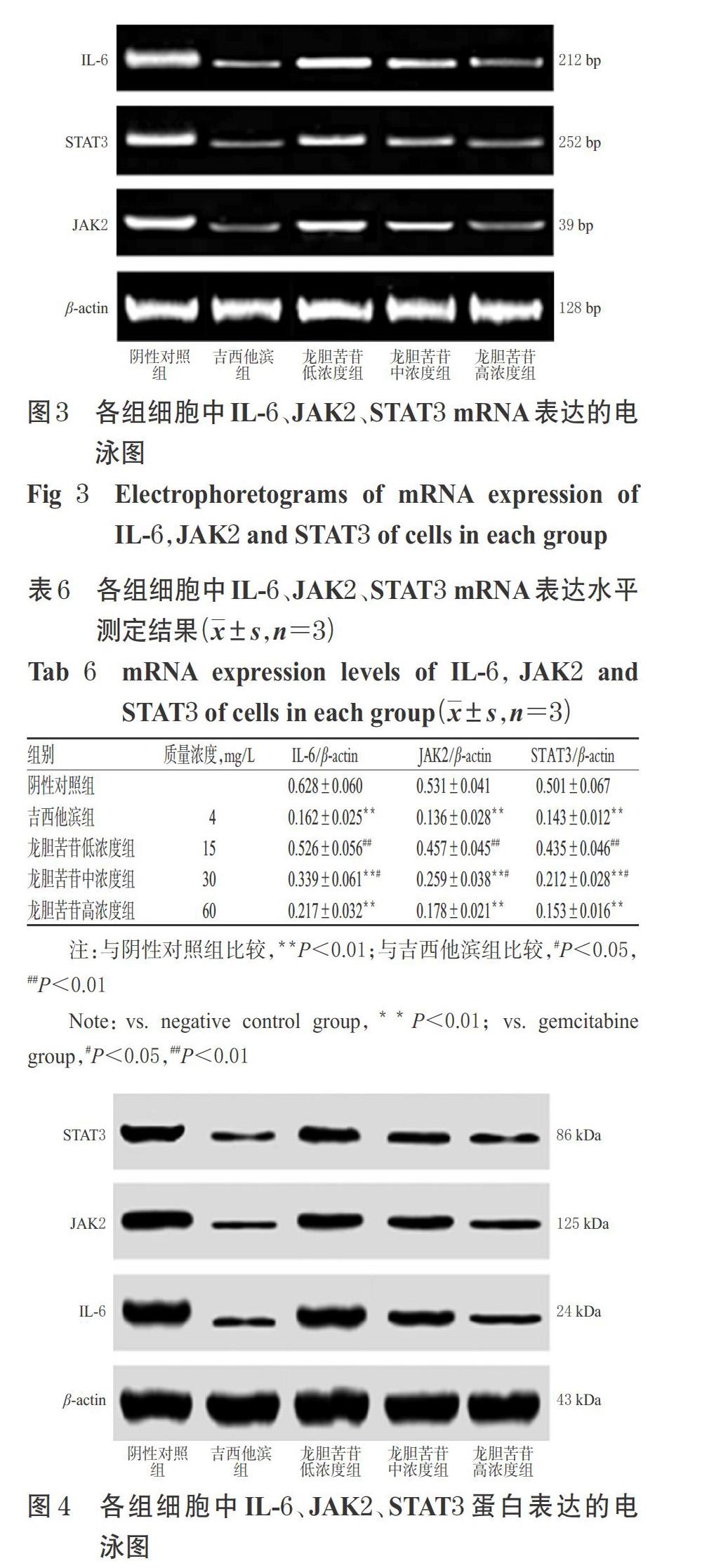
采用逆转录(RT)-PCR法进行测定。收集对数生长期PANC-1细胞,以0.25%胰酶消化后制成细胞悬液,按2×105个/孔接种于6孔板中,然后按“2.3”项下方法分组、给药,培养72 h。吸弃培养液,收集细胞,用Beyozol试剂提取细胞总RNA[取2 μL总RNA样品,于260、280 nm波长下分别检测RNA样品的吸光度(A),A260/A280值介于1.8~2.0之间,表明样品纯度较高]。将总RNA逆转录为cDNA,然后以cDNA为模板进行PCR扩增试验。反应体系(25 μL):cDNA模板5 μL,上、下游引物各1 μL,2× Master Mix 12.5 μL,ddH2O 5.5 μL。扩增条件:94 ℃预变性3 min;94 ℃变性45 s,57 ℃退火75 s,72 ℃延伸90 s,共30个循环;最后以72 ℃充分延伸10 min,结束反应。取5 μL PCR产物进行琼脂糖凝胶(2%)电泳,凝胶成像仪下拍照成像,用Quantity One 4.6.2软件分析条带光密度值。以目的基因条带光密度值与内参(β-actin)条带光密度值的比值表示目的基因mRNA的相对表达水平。待测基因引物序列及产物扩增长度见表1。
2.7 龙胆苦苷对细胞中IL-6、JAK2和STAT3蛋白表达的影响考察
采用Western blotting法进行测定。按“2.6”项下方法接种、分组、给药,培养72 h。收集细胞于1.5 mL离心管中,加入1 mL RIPA蛋白裂解液于冰上充分裂解30 min,提取细胞总蛋白,按BCA试剂盒方法测定各样本蛋白浓度并调整一致。然后将蛋白在95 ℃水中加热5 min变性,80 V电压下行SDS-PAGE电泳,300 mA恒流下将蛋白转移至聚偏氟乙烯(PVDF)膜上;室温下用5.0%脱脂奶粉封闭1 h,然后分别加入IL-6(1 ∶ 1 000)、JAK2(1 ∶ 1 000)、STAT3(1 ∶ 1 000)、β-actin(1 ∶ 1 000)一抗,4 ℃孵育过夜;用TBST缓冲液漂洗3 min×3次,加入二抗(1 ∶ 2 000),室温孵育1 h;然后加入化学发光(ECL)显色液,于凝胶成像仪下显影拍照,用Quantity One 4.6.2软件分析条带灰度值。以目的蛋白条带灰度值与内参(β- actin)条带灰度值的比值表示目的蛋白的相对表达水平。
2.8 统计学方法
应用SPSS 20.0软件进行统计分析。计量资料以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 龙胆苦苷对PANC-1细胞增殖的影响
与阴性对照比较,4、8、16、32、64、128 mg/L龙胆苦苷作用72 h后细胞的OD值均显著降低(P<0.05或P<0.01),表明其可不同程度地抑制细胞的增殖,并且具有浓度依赖性趋势。龙胆苦苷对PANC-1细胞的IC50为9.54 mg/L。结果见表2。
3.2 龙胆苦苷对PANC-1细胞生长的影响
在培养1 d后,各组的活细胞计数差异均无统计学意义(P>0.05)。与阴性对照组比较,在培养3、5、7 d后,吉西他滨组和龙胆苦苷中、高浓度组活细胞计数均明显减少(P<0.05或P<0.01)。与吉西他滨组比较,龙胆苦苷中浓度组在培养3 d后的活细胞计数以及龙胆苦苷高浓度组在培养3、5、7 d后的活细胞计数差异均无统计学意义(P>0.05)。结果见表3。
3.3 龙胆苦苷对PANC-1细胞克隆形成的影响
与阴性对照组比较,吉西他滨组和龙胆苦苷高浓度组细胞的克隆形成数显著减少(P<0.01),克隆形成率显著降低(P<0.01)。与吉西他滨组比较,龙胆苦苷高浓度组细胞的克隆形成数和克隆形成率差异均无统计学意义(P>0.05)。结果见图1、表4。
3.4 龙胆苦苷对PANC-1细胞凋亡的影响
与阴性对照组比较,吉西他滨组和龙胆苦苷中、高浓度组细胞凋亡率显著升高(P<0.01)。与吉西他滨组比较,龙胆苦苷高浓度组细胞凋亡率差异无统计学意义(P>0.05)。结果见图2、表5。
3.5 龙胆苦苷对PANC-1细胞中IL-6、JAK2、STAT3 mRNA表达水平的影响
与阴性对照组比较,吉西他滨组和龙胆苦苷中、高浓度组细胞中IL-6、JAK2、STAT3 mRNA表达水平显著降低(P<0.01)。与吉西他滨组比较,龙胆苦苷高浓度组细胞中IL-6、JAK2、STAT3 mRNA表达水平差异均无统计学意义(P>0.05)。结果见图3、表6。
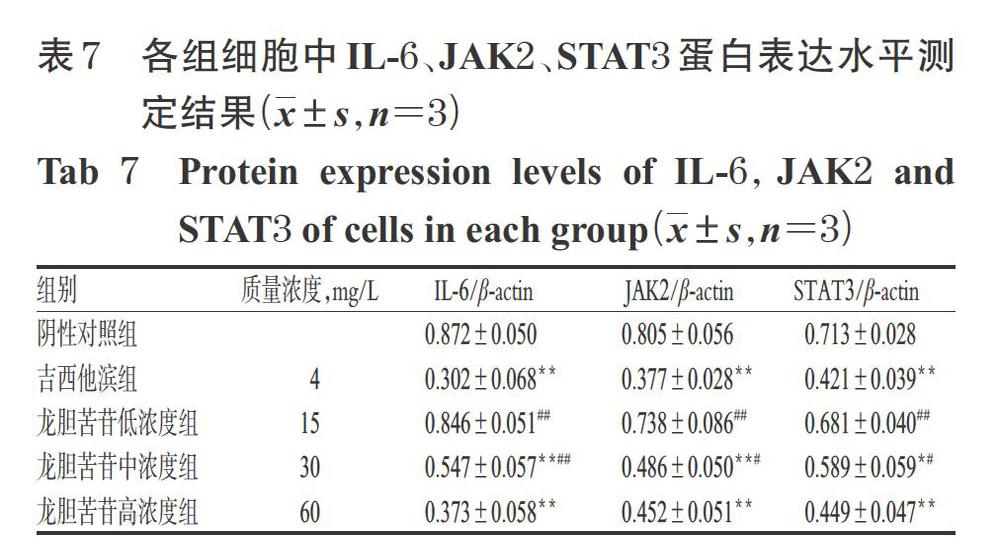
3.6 龙胆苦苷对PANC-1细胞中IL-6、JAK2、STAT3蛋白表达水平的影响
与阴性对照组比较,吉西他滨组和龙胆苦苷中、高浓度组细胞中IL-6、JAK2、STAT3蛋白表达水平显著降低(P<0.05或P<0.01)。与吉西他滨组比较,龙胆苦苷高浓度组细胞中IL-6、JAK2、STAT3蛋白表达水平差异均无统计学意义(P>0.05)。结果见图4、表7。
4 讨论
炎症信号通路IL-6/JAK2/STAT3在肿瘤的发生、发展过程中发挥着至关重要的作用[14]。临床研究发现,胰腺癌患者肿瘤组织中IL-6、JAK2、STAT3等的表达异常升高,且与肿瘤的恶性程度及预后不良呈正相关[15]。其中,IL-6是目前研究较多且功能广泛的细胞因子之一,其参与了炎症反应、免疫调控、细胞分化及增殖等生理病理过程,其表达升高可促进肿瘤的发生、发展、迁移及侵袭等生物学行为,也是判断恶性肿瘤预后的重要指标之一[16]。IL-6与其靶细胞上相应的IL-6受体结合后,激活细胞膜表面的糖蛋白130(GP130),从而激活与GP130关联的JAK,促进受体蛋白酪氨酸激酶活化,并与STAT3结合,使STAT3发生磷酸化激活后,诱导核因子 κB(NF-κB)从NF-κB/NF-κB抑制蛋白(IκB)复合体上解离为游离的磷酸化状态,然后通过核膜进入细胞核内,与其相应的DNA反应元件结合,调控炎症、凋亡或增殖相关因子的表达,促进细胞增殖、抑制细胞凋亡,参与到肿瘤细胞的增殖、迁移及侵袭等生物学行为中[17-20]。因此,采取有效治疗措施下调IL-6/JAK2/STAT3信号通路的表达有助于肿瘤的防治。本研究发现,30、60 mg/L龙胆苦苷可显著抑制PANC-1细胞的增殖、生长和克隆形成,促进细胞凋亡,下调细胞中IL-6、JAK2、STAT3 mRNA及其蛋白表达,并且60 mg/L龙胆苦苷的作用与4 mg/L吉西他滨的作用相近(吉西他滨是临床上治疗胰腺癌的基础化疗药物[21],故在本研究中将其设为阳性对照)。
综上所述,龙胆苦苷对人胰腺癌细胞PANC-1具有抑制增殖、诱导凋亡的作用,其机制可能与抑制IL-6/ JAK2/STAT3信号通路的激活有关,但其更多的作用机制后续需进一步研究。
参考文献
[ 1 ] ABBASSI R,SCHMID RM. Evolving treatment paradi- gms for pancreatic cancer[J]. Visc Med,2019,35(6):362-372.
[ 2 ] 刘梦奇,吉顺荣,徐晓武,等. 2019年胰腺癌研究及诊疗新进展[J].中国癌症杂志,2020,30(1):1-10.
[ 3 ] WANG Y,YANG G,YOU L,et al. Role of the micro- biome in occurrence,development and treatment of pancreatic cancer[J]. Mol Cancer,2019,18(1):173-186.
[ 4 ] STONE ML,BEATTY GL. Cellular determinants and therapeutic implications of inflammation in pancreatic cancer[J]. Pharmacol Ther,2019,201(9):202-213.
[ 5 ] ZHANG X,LU H,HONG W,et al. Tyrphostin B42 atte- nuates trichostatin A-mediated resistance in pancreatic cancer cells by antagonizing IL-6/JAK2/STAT3 signaling[J]. Oncol Rep,2018,39(4):1892-1900.
[ 6 ] LIU X,WANG J,WANG H,et al. REG3A accelerates pancreatic cancer cell growth under IL-6-associated inflammatory condition:involvement of a REG3A-JAK2/STAT3 positive feedback loop[J]. Cancer Lett,2015,362(1):45-60.
[ 7 ] ZHAO H,GUO Y,LI S,et al. A novel anti-cancer agent icaritin suppresses hepatocellular carcinoma initiation and malignant growth through the IL-6/JAK2/STAT3 pathway[J]. Oncotarget,2015,6(31):31927-31943.
[ 8 ] 劉建民,黄良文,朱旭红,等. 3种活血化瘀中药复方含药血清对神经胶质瘤U251细胞JAK/STAT信号通路的影响[J].中国药房,2017,28(16):2176-2179.
[ 9 ] 谢小倩,李贺,王亚乐,等.龙胆苦苷对佐剂性关节炎大鼠的抗炎作用[J].中国实验方剂学杂志,2020,26(6):58- 63.
[10] XIE X,LI H,WANG Y,et al. Therapeutic effects of gen- tiopicroside on adjuvant-induced arthritis by inhibiting inflammation and oxidative stress in rats[J]. Int Immu- nopharmacol,2019. DOI:10.1016/j.intimp.2019.105840.
[11] 王美灵,张雷明,郝妍斐,等.龙胆苦苷对类风湿性关节炎的保护作用及其机制[J].中国药理学与毒理学杂志,2019,33(9):721.
[12] LI X,YANG C,SHEN H. Gentiopicroside exerts convincing antitumor effects in human ovarian carcinoma cells (SKOV3) by inducing cell cycle arrest,mitochondrial mediated apoptosis and inhibition of cell migration[J]. J Buon,2019,24(1):280-284.
[13] 梁春丽,王峥,李炳,等.姜黄素对人胰腺癌PANC-1细胞甲基化转移酶表达影响的体外研究[J].上海中医药杂志,2015,49(10):77-79、97.
[14] KIM JH,CHOI HS,KIM SL,et al. The PAK1-Stat3 signaling pathway activates IL-6 gene transcription and human breast cancer stem cell formation[J]. Cancers:Basel,2019,11(10):1527-1546.
[15] RAZIDLO GL,BURTON KM,MCNIVEN MA.Interleukin-6 promotes pancreatic cancer cell migration by rapidly activating the small GTPase CDC42[J]. J Biol Chem,2018,293(28):11143-11153.
[16] 陈涛,曾永鸿.肿瘤微环境中异常表达的白介素6对肿瘤进程的影响[J].解剖学杂志,2016,39(4):501-503.
[17] 任为,牟宜双,许可,等.迷迭香酸通过诱导凋亡及抑制NF-κB信号通路发挥抗肝癌作用的机制研究[J].中药药理与临床,2016,32(2):31-35.
[18] 张曼泽,李峰生,王思念,等. IL-6通過JAK2/STAT3信号通路促进CD133-肺腺癌细胞(A549)获得干性特征[J].军事医学,2018,42(9):678-683.
[19] LIU Z,CHEN T,LU X,et al. Overexpression of variant PNPLA3 gene at I148M position causes malignant transformation of hepatocytes via IL-6-JAK2/STAT3 pathway in low dose free fatty acid exposure:a laboratory investigation in vitro and in vivo[J]. Am J Transl Res,2016,8(3):1319-1338.
[20] 李雷雷,郭彬,郭佳培,等.肿瘤相关巨噬细胞通过JAK2/STAT3途径调控肝癌细胞凋亡的机制研究[J].现代预防医学,2017,44(13):2406-2410.
[21] 彭梦媛,邱峰,黄丹,等.姜黄素对胰腺癌SW1990细胞耐吉西他滨的逆转作用及机制研究[J].中国药房,2019,30(9):1192-1197.
(收稿日期:2020-02-24 修回日期:2020-06-12)
(编辑:林 静)
