贵州白山羊ADIPOQ 基因生物信息及组织表达特异性分析
2020-08-16安清明黄永震孟金柱赵园园田秀珍吴震洋
安清明 ,王 星,黄永震,孟金柱,赵园园,田秀珍,吴震洋*
(1.铜仁学院农林工程与规划学院,贵州铜仁 554300;2.西北农林科技大学动物科技学院,陕西杨凌 712100;3.华珍牧业有限公司,贵州铜仁 554300)
脂肪组织能分泌一类具有生物活性的脂肪因子从而调节机体能量代谢,因此在机体能量储存、脂肪酸代谢和糖类代谢中扮演十分重要的角色。脂联素(Adiponectin,ADIPOQ、APM1或Acrp30)是一种由脂肪细胞分泌的脂肪因子,由4个结构域构成,分别为信号肽区、可变区、N-胶原蛋白三螺旋区域和C-球状区域[1-2]。脂联素由Adiponectin(ADIPOQ)基因编码,该基因包含3个外显子和2个内含子。脂联素主要通过结合其他蛋白从而协同调节特殊的生理功能,如脂联素能通过相关结合蛋白直接参与调节AMP激酶与PPAR配体活性,并且间接调节脂肪酸氧化和糖类摄取[3]。ADIPOQ在不同人群中已被标记与机体肥胖、胰岛素耐受性、糖尿病等重要性状具有关联性[4],且是目前为止发现不多的一种由脂肪组织分泌并与肥胖呈负相关的调节因子。ADIPOQ基因遗传变异对家畜生产性能具有一定影响,如该基因的核苷酸变异对猪的胴体性状及肉质[5]、猪肩部脂肪量[6]、牛眼肌面积、牛背膘厚度、牛胴体性状均有显著影响[7-8];而在山羊中ADIPOQ基因的研究较少,目前仅发现954G/A位点突变与山羊产羔数有一定关联性[9]。
贵州白山羊是中国著名的白山羊品种之一,主要分布在黔东南、黔东北等地区,存栏量100多万只,为贵州目前群体数量最大的白山羊品种,是发展贵州畜牧业的重要种质资源。贵州白山羊具有性成熟早、繁殖力强、适应性强等特性,但存在个体较小、生长速度慢、产肉量少等缺点。基于ADIPOQ基因在家畜动物脂肪累积中的重要特性,本研究拟通过对贵州白山羊ADIPOQ基因全长CDS区序列的生物信息、系统进化及组织表达进行分析,进一步增进对贵州白山羊的遗传多样性、发育情况和起源进化的了解,以期为贵州白山羊遗传资源的保护和利用提供基础数据。
1 材料和方法
1.1 实验材料 于2019年6月在贵州省铜仁市沿河土家族自治县选取8只(公、母各4只)健康的1周岁龄贵州白山羊,屠宰后用FTA卡采集贵州白山羊血液,同时采集新鲜的心脏、肝脏、脾脏、肺脏和肾脏组织,DEPC冲洗干净后用锡箔纸包装迅速置于液氮中带回实验室,-80℃保存备用。
1.2 主要试剂 Tris碱、乙二胺四乙酸、氢氧化钠、TE缓冲液(实验室自备)、PCR Mix、DNA Marker、核酸染料GoldView、琼脂糖等均购自上海大山生物科技有限公司。
1.3 引物设计与合成 根据Genbank数据库中山羊ADIPOQ基因序列(登录号:NC_019458.2),利用Primer Premier 5.0引物设计软件设计5对基因外显子特异性引物(表1),扩增ADIPOQ基因所有3个外显子的核苷酸序列,引物由上海生工生物工程有限公司合成。

表1 PCR引物信息
1.4 DNA提取 本研究用FTA卡采集贵州白山羊血液,常温保存。采用“两步法”提取基因组DNA[10]。从FTA上打孔取样(孔径1.2 mm)置于PCR管中,加入200 μL 20 mmol/L NaOH溶液,60℃加热20 min至FTA变为白色,吸净NaOH液体,再加入200 μL 1×TE溶液,室温静置5 min,吸净TE液体,自然晾干后用于PCR扩增。
1.5 PCR反应 PCR反应体系20 μL:含血样1.2 mm的FTA卡圆片1个,Taq PCR Master Mis试剂11 μL,10 mmol/L上下游混合引物1 μL,加ddH2O至20 μL。PCR扩增程序:94℃预变性2 min,94℃变性30 s,退火30 s,72℃延伸30 s,37个循环,延伸7 min,4℃保存。PCR产物用1%琼脂糖凝胶电泳检测,观察电泳结果。
PCR产物送生工生物工程(上海)股份有限公司测序。测序结果应用DNAStar软件进行序列比对分析,并与NCBI中序列进行对比。
1.6 生物信息学分析 利用ExPASY中的ProtParam程序预测ADIPOQ基因编码氨基酸序列的理化性质(http://expasy.org/tools/protparam.htmL),利用Protscale(http://web.expasy.org/protscale/)分析蛋白质亲疏水性;利用TMHMM(http://genome.cbs.dtu.dk/services/TMHMM/)分析蛋白质的跨膜结构;利用在线工具SignalP4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)分析蛋白潜在信号肽剪切位点;利用TargetP(http://cbs.dtu.dk/services/TargetP/)、PSORTII Prediction(https://psort.hgc.jp/form2.html)预测蛋白质的亚细胞定位;利用Smart(http://smart.embl-heidelberg.de/)分析预测氨基酸序列的保守结构域;利用NetPhos 3.1 Server在线工具(http://www.cbs.dtu.dk/services/NetPhos/)预测贵州白山羊ADIPOQ蛋白的磷酸化位点;通过STRING在线数据库(https://string-db.org/)分析蛋白相互作用网络预测;利用IBCP(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)预测蛋白质的二级结构;利用SWISS-MODEL(https://www.swissmodel.expasy.org/)预测蛋白质的三级结构;利用DNAStar软件分析其同源性及构建系统发育树。
1.7 组织表达分析 采用Trizol法提取贵州白山羊各组织(心、肝、脾、肺和肾)总RNA,分光光度计测定RNA浓度,通过反转录试剂盒(北京全式金)将提取到的总RNA反转录合成cDNA,设计ADIPOQ基因特异性引物(表2),以GAPDH为内参基因进行实时荧光定量PCR检测[11],按照RT-qPCR说明书指导配制反应体系并设定反应程序,反应体系10 μL:SYBR premix Dimer Eraser(2℃)5 μL,上、下引物(10 pmol/mL)各0.4 μL,无菌去离子水3.2 μL,cDNA(20 ng/μL)1 μL。定量程序:95 ℃预变性30 s,95 ℃ 5 s,55 ℃30 s,72℃ 30 s,40个循环。采用RT-qPCR方法分析ADIPOQ基因mRNA在白山羊心、肝、脾、肺和肾脏中的表达情况。荧光定量实验设计3个重复,采用2-△△CT方法对定量数据进行均一化处理,计算相对表达量,利用Minitab16.0进行显著性差异分析。

表2 RT-qPCR引物信息及扩增条件
2 结果与分析
2.1 PCR扩增 贵州白山羊ADIPOQ基因3个外显子,经5对引物P1~ P5扩增后片段均为400 bp左右,与预期目标一致,目的片段无杂带,特异性较好,可用于下一步测序,结果见图1。利用DNAStar软件将5段序列进行拼接比对,获得贵州白山羊ADIPOQ基因CDS区序列全长为720 bp的序列,共编码239个氨基酸。
2.2 生物信息学分析
2.2.1 贵州白山羊ADIPOQ蛋白的理化性质分析 利用ExPASY在线服务器对贵州白山羊ADIPOQ蛋白理化性质进行预测分析,结果如表3所示,贵州白山羊ADIPOQ蛋白由20种239个氨基酸组成,该蛋白分子式C1169H1774N314O348S5,相对分子质量为25 955.14 ku,理论等电点为5.96,说明该蛋白为酸性蛋白质,蛋白正、负电荷氨基酸残基总数分别为19、24个,半衰期为30 h,不稳定系数为29.30,脂肪总数为75.40,总平均亲水性(GRAVY)为-0.408。
2.2.2 疏水性、亲水性分析 利用ExPASY在线服务器对贵州白山羊ADIPOQ蛋白氨基酸序列的亲水性进行分析,结果表明第7位氨基酸疏水值最大(3.111,正值),第136位氨基酸亲水值最小(-2.633,负值),由图2可知,整个多肽链亲水性氨基酸多于疏水性氨基酸,说明ADIPOQ蛋白整个多肽链表现为亲水性。
2.2.3 跨膜结构域预测 利用TMHMM在线跨膜运输分析软件预测ADIPOQ蛋白跨膜结构,结果表明ADIPOQ蛋白无跨膜区域,说明其不属于跨膜蛋白或不能定位于细胞膜上。

表3 贵州白山羊ADIPOQ蛋白氨基酸组成
2.2.4 潜在信号肽剪切位点预测 利用在线工具SignalP4.0在线预测ADIPOQ蛋白的N端信号肽结构,结果表明,ADIPOQ蛋白1~17位为信号肽区域,第18位为潜在信号肽剪切位点,18位氨基酸以后为成熟蛋白区,表明该蛋白为分泌蛋白。
2.2.5 亚细胞定位 利用TargetP分析贵州白山羊ADIPOQ蛋白的亚细胞定位情况,利用PSORTII Prediction在线软件进行确证,结果表明,ADIPOQ蛋白属于分泌蛋白,且其在胞外、分泌系统囊泡和线粒体中的分布比例分别是66.7%、22.2%和11.1%,在胞外分布最多(表4)。

表4 TargetP预测ADIPOQ亚细胞定位
2.2.6 ADIPOQ蛋白结构域分析 由图3可知,ADIPOQ蛋白1~17位氨基酸为Signal peptide结构域,75~95位氨基酸为Low Complexity结构域,101~237位氨基酸为C1Q保守结构域。
2.2.7 ADIPOQ蛋白磷酸化位点预测 通过NetPhos 3.1 Server在线工具预测贵州白山羊ADIPOQ蛋白的磷酸化位点,当潜在的磷酸化位点的阈值为0.5时,贵州白山羊ADIPOQ蛋白存在多个磷酸化位点,但只有8个苏氨酸、4个丝氨酸和4个酪氨酸的磷酸化能力超过了阈值,表明贵州白山羊ADIPOQ蛋白存在16个潜在的蛋白激酶磷酸化位点。预测结果显示,在贵州白山羊ADIPOQ蛋白上可能有CDK5、p38MAPK、GSK、unsp、CKI2、cdc2、PKC、PKG、IGFR、PKA这10种保守的蛋白激酶结合位点,且在56处unsp得分最高,为0.988。
2.2.8 ADIPOQ蛋白与其他蛋白信息互作分析 通过STRING在线数据库搜索与贵州白山羊ADIPOQ蛋白相互作用信息,选取与山羊物种亲缘关系最近的牛为参考生物,置信度设置为最高值0.900,交互树参数设置为10个以内,以此构建山羊ADIPOQ蛋白与其他蛋白相互作用网络(图4),结果表明,ADIPOQ蛋白共与10蛋白存在互作效应,且与ADIPOR1、ADIPIR2、CDH13和LEP蛋白之间的互作效应最高。
2.2.9 ADIPOQ蛋白二级结构与三级结构预测 程序分析表明,贵州白山羊ADIPOQ蛋白中,α-螺旋(Alpha helix,h)占9.62%;无规则卷曲(Random coil,c)占66.11%;延伸链(Extended strand,e)占24.27%(图5),由此推测,无规则卷曲是ADIPOQ蛋白的主要结构原件,延伸链散布于整个蛋白质中。由图6可知,ADIPOQ蛋白的三级结构中无规则卷曲所占比例最高,其次为延伸链,与其二级结构预测结果相一致。
2.2.10 贵州白山羊ADIPOQ基因编码蛋白同源性及系统发育树 利用MegAlign软件对山羊(本研究结果)、绵羊(NC_019458.2)、牦牛(NW_005396942.1)、普通牛(NC_037328.1)、马(NC_009162.3)、猕猴(NC_027894.1)、家鼠(NC_000082.6)、大鼠(NC_005110.4)、猪(NC_010455.5)、鸡(NC_006096.5)和人(NC_0000 03.12)的ADIPOQ基因编码蛋白进行同源性分析,并构建系统发育树(表5、图7)。结果表明,贵州白山羊ADIPOQ基因编码蛋白序列与绵羊的同源性最高,为99.2%,与其他物种同源性依次为牦牛(95.0%)、普通牛(94.6%)、野猪(84.5%)、马(84.0%)、猕猴(83.6%)、人(82.4%)、家鼠(81.6%)、大鼠(78.7%)和鸡(66.1%)。构建系统进化树结果与序列同源性结果一致,贵州白山羊同样与绵羊亲缘关系最近,符合物种进化规律,说明ADIPOQ基因编码区在物种间相对保守。
2.2.11 贵州白山羊ADIPOQ基因在不同组织中的表达分析 如图8所示,ADIPOQ基因mRNA在不同组织中的表达存在性别差异,其中在母羊脾脏、肺脏和心脏的表达量显著高于公羊,而在公羊肝脏和肾脏中的表达量显著高于母羊。
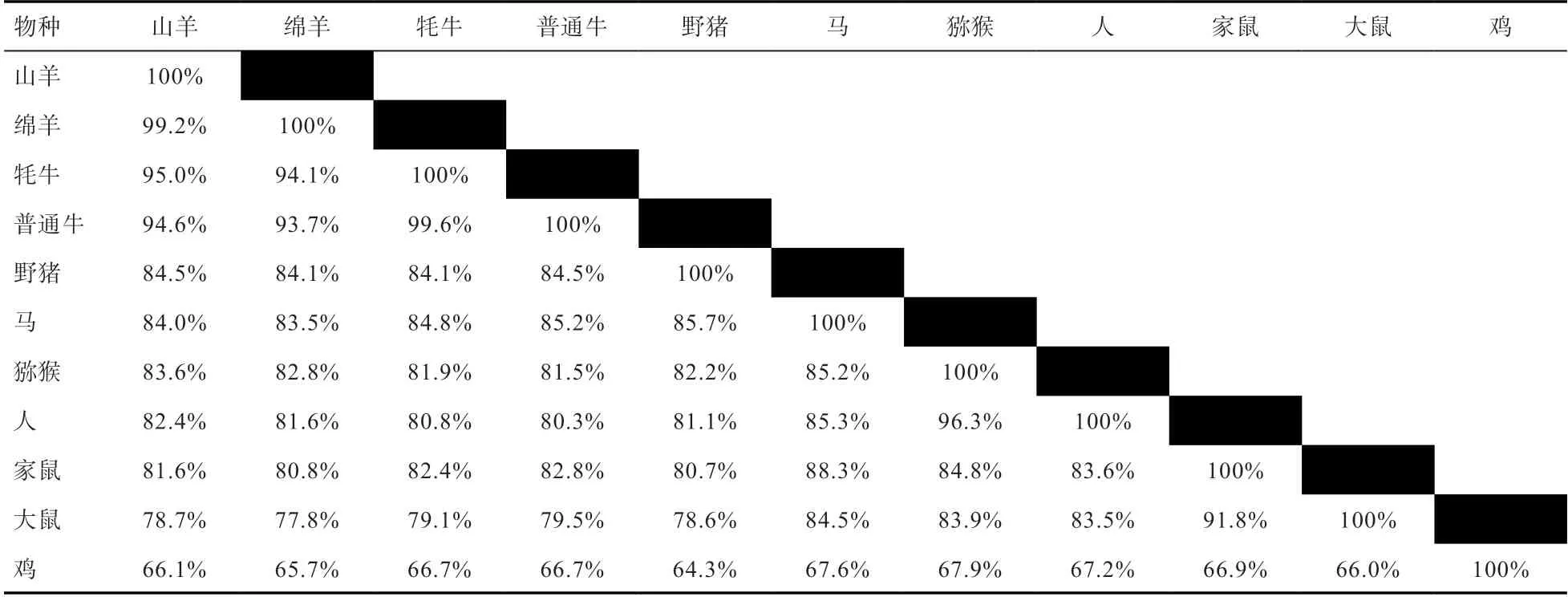
表5 山羊与10个物种ADIPOQ氨基酸序列同源性比
3 讨论
ADIPOQ基因编码蛋白是一种胶原血浆蛋白,已有研究结果表明其主要通过与受体1、2结合才能发挥作用[3],进而调节脂肪酸氧化和葡萄糖代谢等功能,这与本实验中蛋白互作分析预测结果一致,且是目前为止在脂肪细胞中发现的唯一与肥胖呈负相关的细胞因子,同时发现其与II型糖尿病、动脉粥样硬化及肥胖等多种疾病相关[12-13]。目前,国内外少有针对云贵高原特有物种贵州白山羊ADIPOQ基因的研究,本实验对贵州白山羊ADIPOQ基因编码产物进行预测和表达分析,为进一步揭示白山羊ADIPOQ基因的遗传功能特性提供理论参考。
本研究结果分析所得贵州白山羊ADIPOQ基因的分子大小、编码蛋白质大小、氨基酸同源性及系统发育树同源性结果均一致,且与动物分类学观点也基本一致,这说明山羊ADIPOQ蛋白在长期进化过程中较为保守,且起源进化偏向于野生型分支。不同物种ADIPOQ基因序列比对分析发现序列第4位碱基G为偏好基因,遵循Kozak规则,表明贵州白山羊ADIPOQ基因翻译效率较高[14]。但氨基酸对比发现,不同物种氨基酸数目略有区别,发现贵州白山羊的总氨基酸数目比牛的少1个(牛:240个),比猪少4个(猪:243个),这可能与进化过程中不同物种行使脂肪累积功能的差异有关。
本研究结果表明,ADIPOQ蛋白为亲水性蛋白,且其存在信号肽区域,第18位氨基酸为潜在信号肽剪切位点,ADIPOQ蛋白结构域功能分析也表明该蛋白1~17位信号肽区域,且101~237为较为保守的C1Q功能区,再结合ADIPOQ蛋白在亚细胞结构中发现其主要存在于胞外和分泌系统中,多角度证明ADIPOQ蛋白为分泌蛋白,这与ADIPOQ蛋白具体功能的体现需要结合受体才能实现的结果相一致[15]。
潜在磷酸化修饰位点分析结果表明,ADIPOQ蛋白在翻译后可能受到磷酸化修饰的调控,而磷酸化是蛋白质生物合成后活性调节的一种重要化学修饰,这可能与ADIPOQ蛋白与其受体结合有一定联系相关。同时,ADIPOQ蛋白相互作用网络预测结果表明,ADIPOQ蛋白主要与ADIPOR1、ADIPIR2、CDH13和LEP蛋白进行信息互作,这进一步证明ADIPOQ蛋白主要与ADIPOR受体蛋白相结合共同行使相关功能,同时预测ADIPOQ蛋白并不是独立行使脂肪的代谢调节功能,需要与CDH13蛋白和LEP蛋白等其他蛋白协同参与,CDH13蛋白在信号转导和细胞生长调节方面发挥重要作用[16],而LEP蛋白在调节脂肪沉积和能量代谢方面具有重要调节作用[17]。对贵州白山羊内脏器官进行ADIPOQ基因mRNA表达量检测,结果表明在所检测器官中均有表达,但在肺脏中表达量最高,在肾脏中表达量最低,这与李雪梅等研究结果存在差异[18],但与陈宇光等[19]研究结果相似,结果均发现ADIPOQ基因mRNA在肾脏组织中的表达量最低,且这种表达存在性别差异,而ADIPOQ蛋白是一种与肥胖呈负相关的细胞因子,这种表达差异可能与公、母羊不同器官在脂肪累积中的功能差异相关。
4 结论
本研究得到了贵州白山羊ADIPOQ基因全长720 bp的CDS区序列。生物信息学分析结果表明,贵州白山羊ADIPOQ基因编码239个氨基酸,具有17个氨基酸组成的信号肽,具有16个磷酸化位点、1个C1Q保守结构域,属于分泌蛋白,与绵羊、牦牛的亲缘关系最近,与ADIPOR1/2、CDH13和LEP蛋白互作效应最强,在肾脏中表达量最低,且在不同组织中的表达存在性别差异,预测ADIPOQ蛋白主要在脂肪调节功能具有关键作用,本研究为进一步探讨贵州白山羊在脂肪生长过程中的功能研究奠定了遗传信息基础。
