酶法-超声联合提取紫色马铃薯花青素的工艺研究
2020-08-14洪豆阿丽雅江宇峰朱玲丽吴淑清
洪豆,阿丽雅,江宇峰,朱玲丽,吴淑清*
(1.长春大学 食品科学与工程学院,长春 130022;2.浙江李子园食品股份有限公司,浙江 金华 321031)
紫色马铃薯又名黑土豆,富含大量的优质蛋白质、氨基酸、维生素等营养物质,此外,还富含花青素[1],花青素具有清除自由基、抗癌及抑菌等生理活性功能[2-4]。紫色马铃薯花青素属于天然色素,其在食品、医学、化妆品等领域均有应用[5]。因此,紫色马铃薯将成为未来重要的粮食作物和食品、医药原材料,必将具有广阔的发展前景[6]。
目前,紫色马铃薯花青素的提取主要以溶剂法和超声提取法为主[7,8],而采用酶法-超声联合技术提取紫色马铃薯花青素的研究鲜有报道。由于紫色马铃薯含有大量的纤维素[9],利用纤维素酶可将其纤维素水解,有效地破坏细胞壁和细胞膜,加速花青素的溶出,从而达到提高提取率的目的[10]。超声波产生的机械作用能击破细胞结构,加快体系的传质和传热速度,加速有效成分的扩散和浸出[11]。综上,本试验采用酶法-超声联合技术提取紫色马铃薯花青素,并对其提取工艺条件进行优化,为此类花青素的开发利用提供了理论依据。
1 材料与方法
1.1 材料与试剂
紫色马铃薯:市售;纤维素酶:酶活≥50 U/mg,上海桥星贸易有限公司;盐酸、乙醇:分析纯,上海研生生化试剂有限公司。
1.2 仪器与设备
Christ ALPHA 1-2 LD plus冷冻干燥机 德国Marin Christ公司;BH1200R超速冷冻离心机 上海卢湘仪离心机仪器有限公司;KQ2200超声波清洗器 昆山市超声仪器有限公司;UV-2700紫外可见分光光度计 日本岛津公司。
1.3 试验方法
1.3.1 花青素提取
将紫色马铃薯洗净,将表皮水分用滤纸拭干后切成1 cm的薄片后,快速地于-20 ℃下预冻24 h。24 h后真空冷冻干燥,粉粹过80目筛得到紫色马铃薯粉,置于密闭容器中备用。准确称取1.0 g紫色马铃薯粉置于250 mL锥形瓶中,加入体积分数为0.1%的HCl-C2H5OH溶液(酸醇比为1∶1)和纤维素酶,于200 W超声提取,然后以7000 r/min的转速离心15 min,取上清液。定容后测定花青素提取液的吸光度,计算花青素含量。
1.3.2 花青素含量计算
采用pH示差法对提取后的花青素进行定量分析[12]。在试验中,每个样本进行3次吸光值的测定,得出的数据为9次测定的平均值。根据pH示差法,按下式进行计算:
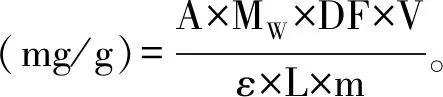
式中:A为吸光值,A=(A530 nm-A700 nm)pH 1.0- (A530 nm-A700 nm)pH 4.5;MW为矢车菊素-3-葡萄糖苷的分子量,449.2 g/mol;DF为稀释倍数;V为提取液体积,mL;ε为矢车菊素-3-葡萄糖苷的消光系数26900 L/(mol·cm);L为光程,1 cm;m为原料质量,g。
1.3.3 工艺优化
1.3.3.1 单因素试验设计
将料液比、酶添加量、超声时间、超声温度分别设为单因素,再分别改变单一因素用量,其他条件不变。以花青素含量为评价指标,采用单因素试验确定各因素的最适范围。单因素试验因素与水平设计见表1。
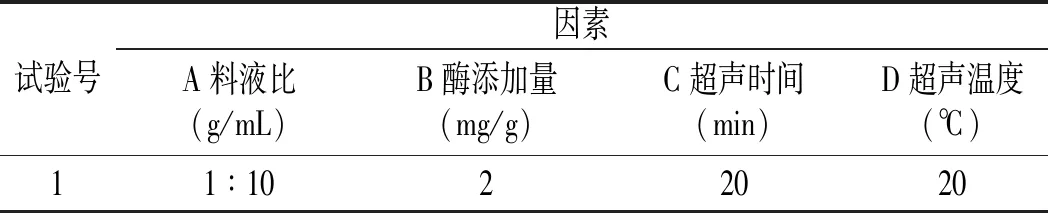
表1 单因素试验因素与水平设计Table 1 Factors and levels of single factor experiments
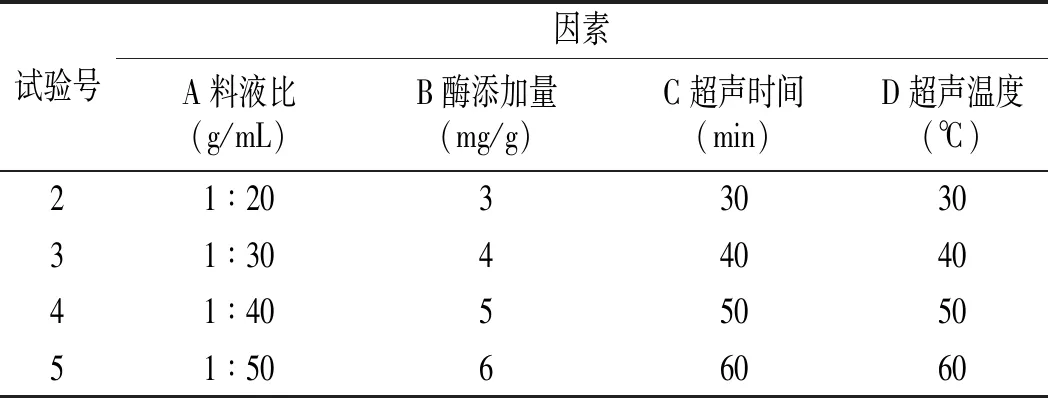
续 表
1.3.3.2 工艺条件的响应面试验
利用Box-Behnken试验设计原理,以花青素含量(Y)作为响应值,通过Design-Expert 8.0.6软件对试验数据进行处理,确定紫色马铃薯花青素最优的提取工艺,试验因素与水平见表2。

表2 响应面试验因素及水平表Table 2 Factors and levels of response surface test
2 结果与分析
2.1 单因素试验
2.1.1 料液比对花青素提取的影响
由图1可知,随着料液比的增加,花青素含量呈先升后降的趋势,当料液比为1∶30 (g/mL)时,花青素含量达到最高值。随着溶液量的增加,提取液和紫色马铃薯粉末之间的接触面积增大,这更利于纤维素酶对紫色马铃薯细胞壁纤维素的降解,使得细胞迅速破裂,加快花青素的溶出[13]。但是随着料液比的不断增加,提取液中纤维素酶的浓度随之减小,酶解反应速率降低。因此,选择1∶30 (g/mL)作为最佳料液比。
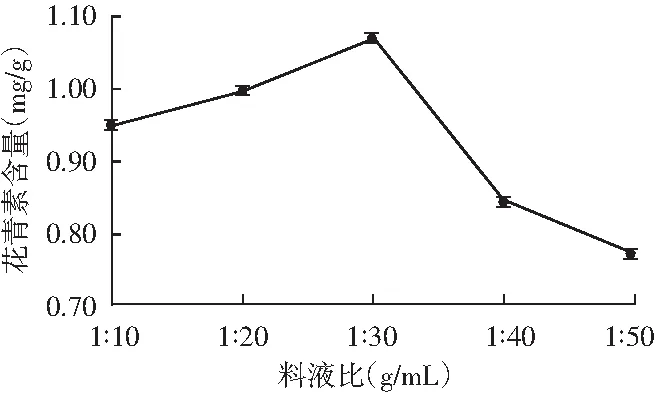
图1 料液比对花青素提取的影响Fig.1 Effect of solid-to-liquid ratio on extraction of anthocyanins
2.1.2 酶添加量对花青素提取的影响
由图2可知,当酶添加量增加时,花青素含量呈现先缓慢增加后迅速增加的趋势,酶添加量达到4 mg/g时花青素含量达到最高值,之后趋势基本保持稳定。这是因为酶降解细胞壁有利于花青素的溶出。当酶添加量≤4 mg/g时,细胞壁开始被降解,花青素含量开始缓慢增加;随着酶添加量增加,细胞壁降解增多,导致花青素含量迅速增加。当酶添加量达到4 mg/g时,细胞壁降解完全,故此时花青素含量达到最高值。而当酶添加量>4 mg/g时,细胞壁的降解已经比较充分,花青素的溶出量基本保持稳定,继续添加酶对提高花青素含量的效果不明显。因此,选择4 mg/g作为最佳酶添加量。
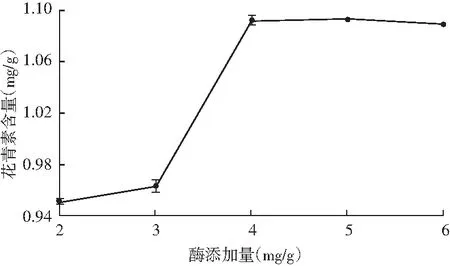
图2 酶添加量对花青素提取的影响Fig.2 Effect of enzyme additive amount on extraction of anthocyanins
2.1.3 超声时间对花青素提取的影响
由图3可知,随着超声时间的增加,花青素含量呈先升后降的趋势,在30 min时,花青素含量达到最高值。在超声初期,溶剂中花青素含量少,紫色马铃薯粉末中花青素含量多,两个体系间存在较高的浓度差,传质推动力大,所以花青素溶出快。但当提取时间继续增加时,由于花青素的热稳定性较差,长时间高温提取会导致花青素发生变性,溶液中的花青素含量会降低。因此,选择30 min作为最佳提取时间。
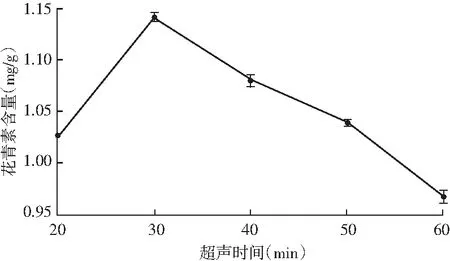
图3 超声时间对花青素提取的影响Fig.3 Effect of ultrasonic time on extraction of anthocyanins
2.1.4 超声温度对花青素提取的影响
由图4可知,随着提取温度的升高,花青素含量呈先升后降的趋势,40 ℃时花青素含量达到最高值。这说明在一定范围内升高温度有利于花青素的提取,升高温度能提高花青素的溶解度和扩散系数,也有利于提高细胞膜的通透性,从而提高花青素的提取率。但高温容易导致花青素被氧化或降解,所以当超声温度高于40 ℃时花青素含量会降低[14]。因此,选择40 ℃作为最佳提取温度。
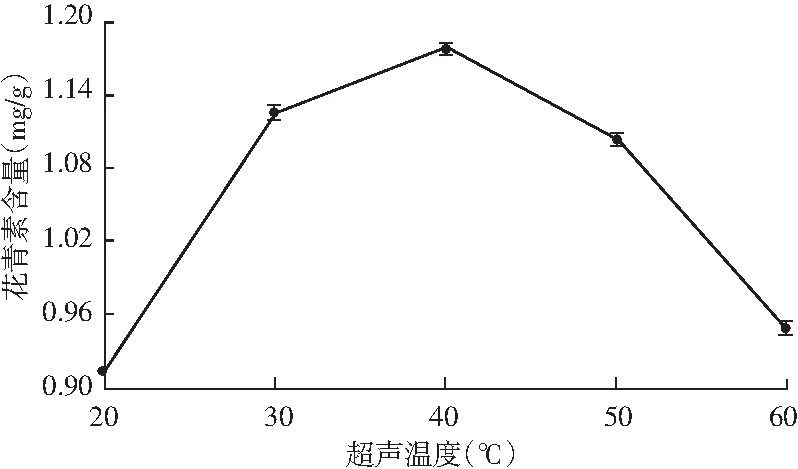
图4 超声温度对花青素提取的影响Fig.4 Effect of ultrasonic temperature on extraction of anthocyanins
2.2 响应面试验结果及分析
在单因素试验的基础上,以料液比(A)、酶添加量(B)、超声时间(C)、超声温度(D)为影响因素,以花青素含量(Y)作为响应值,通过Design-Expert 8.0.6 软件对试验数据进行处理,确定紫色马铃薯花青素最优的提取工艺条件,试验设计及结果见表3。

表3 响应面试验设计与结果Table 3 Response surface test design and results
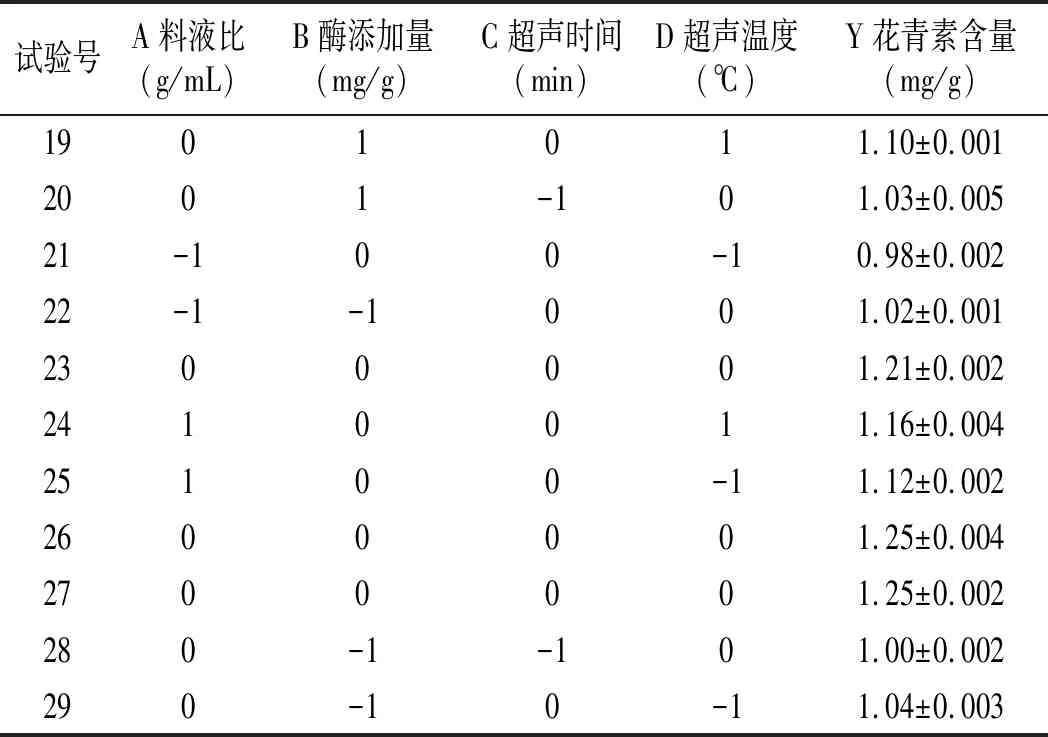
续 表
利用Design-Expert 8.0.6软件对表3中结果进行回归方程拟合,得到花青素含量的响应面回归方程:
Y=1.23+0.030A+0.021B+0.046C+0.033D-0.022AB-(3.750×10-3)AC-0.034AD+(4.500×10-3)BC-0.046BD-(4.250×10-3)CD-0.073A2-0.076B2-0.085C2-0.046D2。
根据响应面设计方案进行回归模型方差分析,结果见表4。
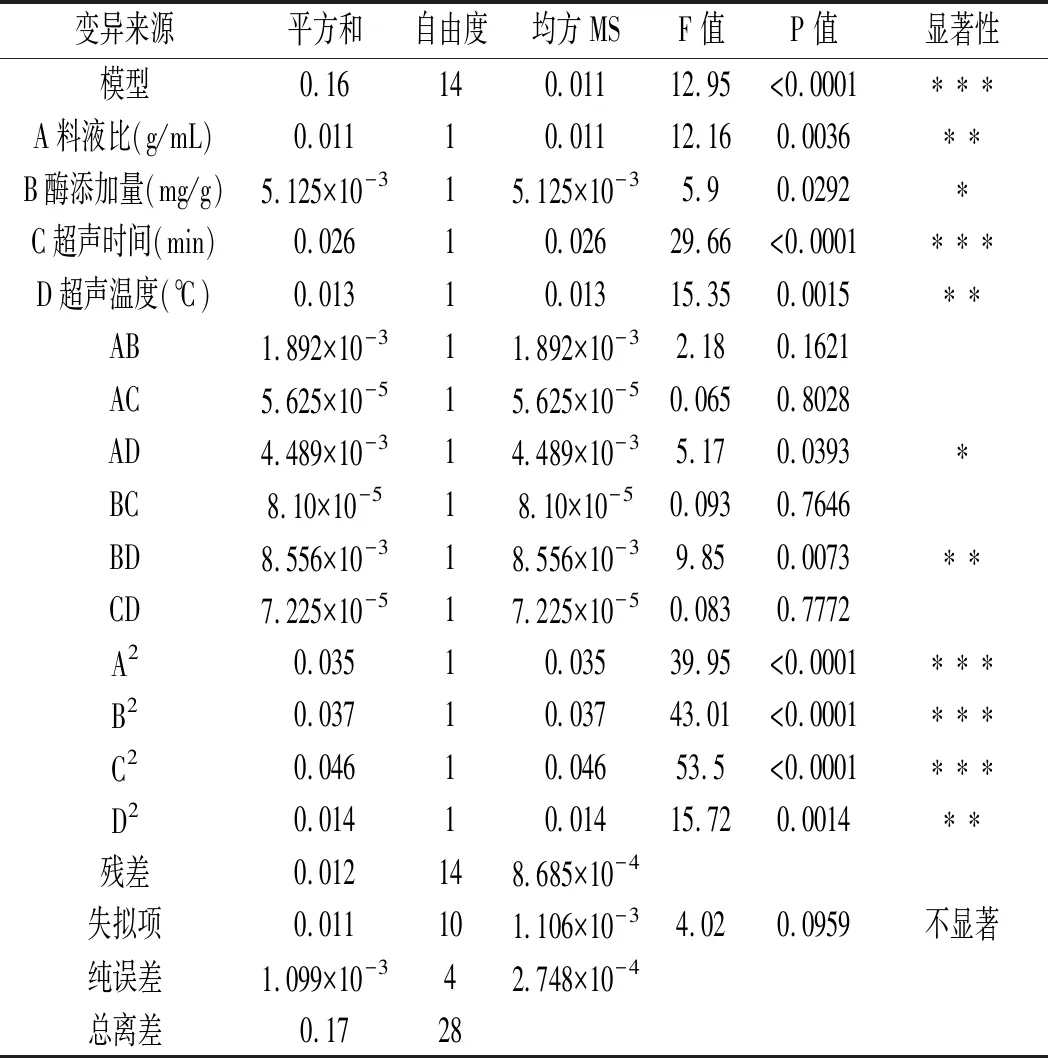
表4 回归模型方差分析Table 4 Analysis of variance of regression models
由表4可知,当模型F=12.95时,P<0.0001,说明该模型是极显著的,当失拟项F=4.02时,P=0.0959>0.05,说明模型的失拟项不显著。决定系数R2=0.9283,校正决定系数RAdj2=0.8566,表示花青素含量的实际值和预测值之间有较好的拟合度,因而证明该模型能够很好地对紫色马铃薯花青素的提取工艺进行分析和预测。该模型中的C、A2、B2和C2对结果影响极显著(P<0.0001),A、D、BD和D2对结果影响较显著(P<0.01),B和AD对结果影响显著(P<0.05)。影响花青素含量的主次顺序为超声时间>酶添加量>料液比>超声温度。
利用Design-Expert软件对回归方程进行运算,分别做出两个交互项之间的等高线图,结果见图5。在试验所选择的水平范围内,因素AD、BD之间交互作用对花青素含量的影响相似,随着因素水平的增加,花青素含量都呈现先增加达到最大值后又降低的趋势,响应值存在最大值,即因素AD、BD之间有一定交互作用。
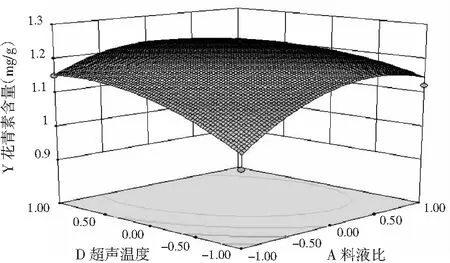
图5 因素AD、BD之间对花青素含量交互影响的响应面图Fig.5 Response surface diagrams of the interaction effects between AD and BD on anthocyanin content
通过Design-Expert软件对已建立的回归方程进行优化分析,得到最佳提取工艺条件为料液比1∶30 (g/mL)、酶添加量4 mg/g。超声时间30 min、超声温度40 ℃。在此提取工艺条件下提取的紫色马铃薯花青素含量理论值可达到1.25 mg/g。
2.3 验证试验
为了检验响应面法所得结果的可靠性,对上述结果进行验证试验,条件设定为料液比1∶31.2 (g/mL)、酶添加量4.04 mg/g、超声时间33 min、超声温度43 ℃,经过3次平行试验,实际测得花青素含量为(1.24±0.004) mg/g,与预测值相近,说明试验优化得到的技术参数是可靠、稳定的。
3 结论
紫色马铃薯花青素属于天然植物色素,相较于合成色素安全性更高,并且具有很高的营养和保健价值,可用于食品、医药等领域,具有十分广阔的应用前景[15]。本研究采用酶法-超声联合提取法,对紫色马铃薯花青素的提取工艺进行了研究。根据响应面法优化提取工艺,得到最佳工艺条件为料液比1∶30 (g/mL)、酶添加量4 mg/g、超声时间30 min、超声温度40 ℃。在此条件下紫色马铃薯花青素的提取含量可达(1.25±0.002) mg/g。该结果可为深层次开发天然色素的研究提供理论依据,并有益于紫色马铃薯花青素在食品工业中的推广与应用[16]。
