Fe3O4@Au模拟酶快速检测亚硫酸盐的研究
2020-08-14关桦楠宋岩刘博韩博林龚德状彭博张娜
关桦楠,宋岩,刘博,韩博林,龚德状,彭博,张娜
(哈尔滨商业大学 食品工程学院,哈尔滨 150076)
亚硫酸盐是食品加工领域的必需品,具有贮藏保鲜、杀菌、漂白、增酸等作用,在食品工业中常用作防腐剂以抑制酶促和非酶促褐变,并且在酿造工业中用作抗菌剂和抗氧化剂[1-3]。作为一种传统的食品添加剂,亚硫酸盐在新鲜的水果和蔬菜、果脯、果汁、葡萄酒、淀粉类产品以及海产品的工业化生产中具有广泛的应用,可延长食品的贮藏时间,确保许多加工食品和饮料的营养充足性、适口性和安全性[4-6]。自20世纪以来,亚硫酸盐的安全问题就已经引起人们的重视。亚硫酸盐是一种常见的过敏原,易引发过敏反应。它能与蛋白质巯基进行反应,过量摄入或长期摄入会对机体造成一定的损伤。而在其使用过程中释放的二氧化硫对机体的多种器官均有毒理作用,是一种全身性毒物[7,8]。因此,我国及世界其他国家和组织都制定了亚硫酸盐在食品加工过程中的限量标准[9]。但在实际加工生产中,人为添加剂量过大甚至滥用亚硫酸盐防腐剂的现象仍时有发生,极易对人体神经、呼吸及消化系统产生危害[10]。在食品加工领域,亚硫酸盐的毒性作用不可忽视,因此建立有效的检测方法就显得尤为重要。目前,应用于食品中亚硫酸盐检测的方法主要有离子色谱法、电化学传感器及荧光分析法[11-14],具有灵敏度高、检测限低、可靠性强等优势,但存在前处理复杂和需要大型仪器等缺点,无法实现现场快速检测[15]。因此,针对亚硫酸盐建立简单、快速和精准的可视化检测体系具有重要的应用价值和实际意义。
Fe3O4@Au纳米微粒具有模拟过氧化物酶活性,能够有效地催化ABTS产生显色反应[16]。与天然酶相比,具有制备简单、成本低廉、稳定性高、催化性能可调控等优点,可替代天然酶应用于酶法食品分析及食品安全快速检测[17]。本课题组曾报道了金磁微粒模拟酶用于食品中葡萄糖的比色检测[18]。试验设计了一种基于Fe3O4@Au纳米微粒催化特性的亚硫酸根快速检测方法,利用亚硫酸根离子具有较强的还原性,可使氧化的显绿色的ABTS+褪色为ABTS的原理来实现对亚硫酸根的比色传感检测。试验中建立了最优的比色传感体系,探讨了体系的抗干扰性,为实现食品中亚硫酸盐的快速定量检测提供了理论依据。
1 材料与方法
1.1 材料与试剂
氯化铁(FeCl3·H2O)、醋酸钠(NaAc·3H2O)、无水醋酸钠、冰醋酸、PEG-4000、氯金酸、过氧化氢:天津市科密欧化学试剂有限公司;乙二醇:天津市华东试剂厂;乙醇:上海振兴化工一厂;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):国药集团化学试剂有限公司;3-氨丙基三乙氧基硅烷(APTES):淮安和元化工有限公司,均为分析纯。
1.2 仪器与设备
FC204型电子天平 沈阳龙腾电子有限公司;YZHR-25型水热反应釜 上海耀冠仪器有限公司;HWS24型电热恒温水浴锅 上海一恒科学仪器有限公司;H-113ATC型分光光度计 北京普析通用仪器有限责任公司;KQ3200型超声波清洗器 昆山市超声仪器有限公司;VSM LDJ 9600型振动磁强计 北京翠海佳诚磁电科技有限责任公司;Advanced-D8型X-射线粉末衍射仪 德国Bruker公司。
1.3 方法
1.3.1 Fe3O4纳米粒子的制备
将1.35 g的FeCl3·6H2O溶于40 mL乙二醇中,依次加入3.6 g的NaAc·3H2O与1.0 g PEG-4000,形成均一的溶液,再搅拌30 min。向水热反应釜中倒入搅拌后的溶液,200 ℃保持8 h,结束后冷却至室温,所得黑色的产物用乙醇和水各洗涤3次。
1.3.2 金纳米粒子的绿色制备
将10 g新鲜橘子皮粉碎后浸泡于100 mL的去离子水中,再将浸泡液于4000 r/min条件下,离心3 min后取上清液。此上清液作为工作液,于冰箱4 ℃条件下保存。在室温条件下启动磁力搅拌器,在烧杯中加入20 mL提前4 ℃预冷的氯金酸溶液中(1%,W/V),温和搅拌。待2 min后,迅速加入5 mL预先制备的橘皮浸泡工作液,并立即观察有无颜色上的变化,即由黄色变成紫色后再变为酒红色,当变为酒红色时,提高搅拌速度,10 min后制得金纳米粒子,随即将其置于冰箱4 ℃条件下保存。
1.3.3 金磁微粒的制备
取2 g合成的Fe3O4纳米微粒超声分散在50 mL含有20%乙醇水溶液中,室温条件下,边搅拌边缓慢滴加1 mL APTES,7 h后得到浅棕色带细微颗粒的悬浊液即为反应结束,产物即为氨基化修饰后的Fe3O4纳米微粒。此产物用0.1 mol/L的HCl-乙醇溶液磁分离清洗3次,烘干后备用。取上述制备的氨基修饰的Fe3O4纳米微粒2 g于室温下150 r/min搅拌中迅速加入20 mL所制备的金纳米粒子溶液中,混合溶液由棕色逐渐变淡,低速搅拌反应12 h后,获得金磁微粒Fe3O4@Au。
1.3.4 表征
将制备的磁性材料粉末用适量的蒸馏水稀释,置于超声波清洗器上超声振荡使其均匀分散。采用X-射线粉末衍射仪对Fe3O4@Au结构进行表征,在室温下通过振动磁强计测量Fe3O4@Au的磁学性能。用适量的蒸馏水稀释磁性材料的合成粉末并使其均匀并通过超声波清洗分离。Fe3O4@Au的结构用X射线粉末板表征,Fe3O4@Au的磁性能在室温下由振荡器测量。
1.3.5 单因素优化金磁微粒检测亚硫酸根的体系
体系中加入3 mL HAc-NaAc 缓冲溶液(0.1 mol/L,pH 4.4),500 μL的H2O2(0.005,0.01,0.05,0.1,0.5 mol/L),200 μL 的ABTS溶液(25 mmol/L),100 μL的纳米Fe3O4@Au粉末混悬液(0.1 g/mL),将反应体系放置于(30,40,50,60,70 ℃)水浴锅中,水浴30 min后(水浴过程中每过1 min温和倒转一次)取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处打的吸光度,再加入200 μL亚硫酸钠溶液(0.01 mol/L)反应(5 s、10 s、30 s、1 min、2 min)测定420 nm处的吸光度。重复试验3次,计算反应前后吸光度差值。
1.3.6 正交试验设计优化检测体系
根据正交设计表选择 L9(34)正交试验,体系中加入3 mL HAc-NaAc 缓冲溶液(0.1 mol/L,pH 4.4),500 μL不同浓度的H2O2,200 μL的ABTS溶液(25 mmol/L),100 μL的纳米Fe3O4@Au粉末混悬液(0.1 g/mL),将反应体系放置于不同温度的水浴锅中,水浴30 min后(水浴过程中每过1 min温和倒转一次)取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处的吸光度,再加入200 μL亚硫酸钠溶液(0.01 mol/L)反应不同时间后测定420 nm处的吸光度。重复试验3次,计算反应前后吸光度差值。确定因素影响的主次顺序及优选方案。
1.3.7 亚硫酸根检测体系工作曲线、检测限、回收率和选择性的测定
在最适浓度、最适温度、时间体系下,加入3 mL HAc-NaAc 缓冲溶液(0.1 mol/L,pH 4.4),500 μL的H2O2,200 μL 的ABTS溶液(25 mmol/L),100 μL的纳米Fe3O4@Au粉末混悬液(0.1 g/mL),将反应体系放置于水浴锅中,水浴30 min后(水浴过程中每过1 min温和倒转一次)取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处的吸光度,再加入200 μL亚硫酸钠溶液(0.001,0.0025,0.005,0.0075,0.01,0.02 mol/L)反应后测定420 nm处的吸光度。重复试验3次,计算反应前后吸光度差值。根据不同浓度亚硫酸根与吸光度值差值绘制标准曲线,计算最低检出限和回收率。在正交试验优化的条件下向检测体系中分别添加0.2 mol/L的PO34-、SO42-、Ca2+、Mg2+、Cl-、Na+、K+作为对比体系进行反应,扫描体系的紫外-可见光吸收光谱。
1.4 数据处理
试验数据采用DPS 软件处理,并采用Origin 8.0软件作图。
2 结果与分析
2.1 金磁微粒的表征
对所制备的Fe3O4纳米粒子用硅烷偶联剂APTES进行表面改性,APTES改性的目的是在磁性粒子的表面形成一层分子结合剂。在介孔孔道中引入带正电荷的氨基,有利于中和反应机制的进行,并能利用静电力、氢键的相互作用有效提高对金纳米粒子的吸附能力[19]。
由图1可知,基于JCPDS 19-0629卡,衍射峰(111)和(311)对应Au;衍射峰(220)、(311)、(400)、(511)、(422)和(440)对应Fe3O4,说明该微粒中含有Au和Fe3O4。其中,(111)和(311)对应的衍射峰2θ为38.56°和77.58°,基于JCPDS 80-3697卡,结果表明Fe3O4@Au中所负载的金纳米粒子为催化裂化型晶格,有助于提升金磁微粒的催化性能。Fe3O4衍射峰所对应的2θ为30.17°、35.54°、43.27°、53.62°、57.11°、62.85°,基于JCPDS 19-0629卡,结果表明Fe3O4@Au中的Fe3O4为立方反尖晶石结构,具备较好的磁电性能。

图1 金磁微粒X-射线衍射图谱Fig.1 X-ray diffraction map of gold magnetic particles
由图2可知,氨基化Fe3O4和Fe3O4@Au的磁学性质分析结果表明,饱和磁化值分别为78 emu/g和59 emu/g,说明金纳米粒子的吸附弱化了磁核的磁性。包覆Au的含量升高会导致复合微粒磁化强度的轻微降低,这一结论和其他同类磁性纳米复合微粒的磁学性质一致[20]。磁学性质分析结果表明,氨基化作用后其依然具有超顺磁性,磁饱和强度值(M)为 43 emu/g,说明氨基化作用不会显著影响磁球的超顺磁性特点。与纳米Fe3O4相比,氨基化Fe3O4纳米粒子的磁饱和,可有效防止纳米磁球聚合,使得纳米磁球能够稳定地分散在水溶液中。
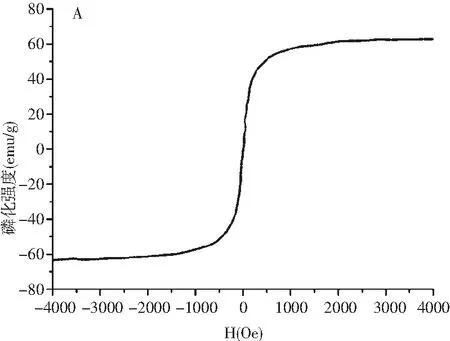
图2 氨基化Fe3O4和金磁微粒的磁滞回线Fig.2 The hysteresis loop of aminated Fe3O4 and gold magnetic particles
2.2 不同催化条件对Fe3O4@Au模拟酶检测体系的影响
2.2.1 过氧化氢浓度对检测体系的影响
由图3可知,过氧化氢的浓度对模拟酶检测亚硫酸根体系有直接影响。H2O2浓度在0.005~0.05 mol/L范围内时,吸光度差值随H2O2浓度的增加呈快速上升趋势。H2O2浓度在0.05~0.1 mol/L时,随H2O2浓度的增加,吸光度差值处于缓慢增加阶段。H2O2浓度在0.1~0.5 mol/L范围内时,体系中H2O2浓度较高,SO32-被消耗,用来还原ABTS+的离子减少,吸光度差值呈下降趋势。由此可知,H2O2浓度在0.1 mol/L时检测效果最好。因此,H2O2浓度因素选择0.05,0.1,0.5 mol/L这3个水平进行正交试验。
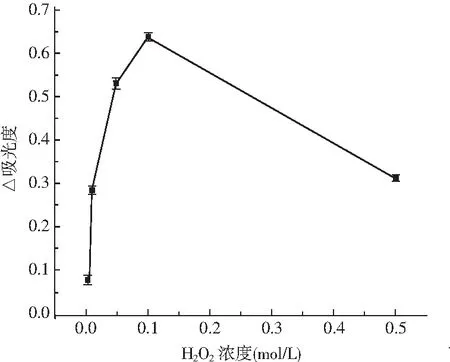
图3 过氧化氢浓度对检测体系的影响结果Fig.3 Effect of hydrogen peroxide concentration on detection system
2.2.2 催化温度对检测体系的影响
由图4可知,温度在30~60 ℃范围内,随着催化温度不断升高,吸光度差值呈上升趋势。在固定化温度为60~70 ℃以后,吸光度差值缓慢平稳上升,表明随着温度的升高,模拟酶的催化活性增强,温度越高检测效果越好。考虑到过高温度不适用于即时检测,以及在60 ℃以后体系的反应速率变缓,因此,催化温度因素选择吸光度差值最好的3个水平50,60,70 ℃进行正交试验。
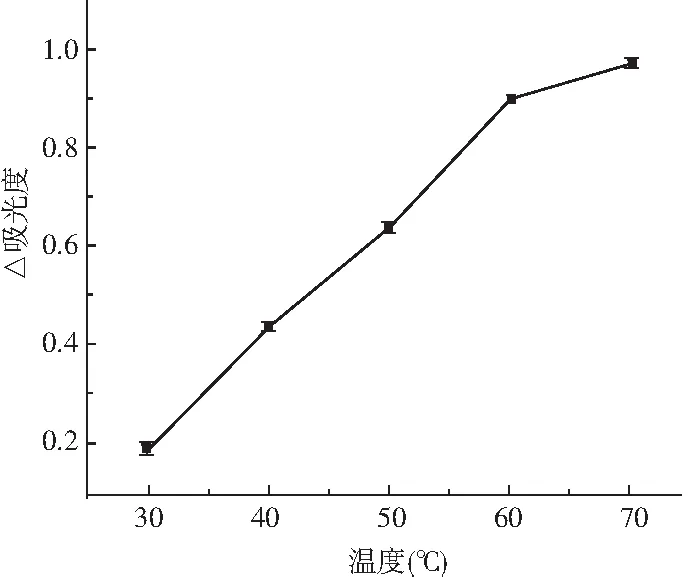
图4 催化温度对检测体系的影响结果Fig.4 Effect of catalytic temperature on detection system
2.2.3 反应时间对检测体系的影响
由图5可知,反应时间在5~10 s时,随着反应时间的延长,吸光度差值呈上升趋势。时间在10~60 s时,吸光度差值呈缓慢平稳下降趋势。反应时间在60~120 s时,吸光度差值呈快速下降趋势。结果表明,当H2O2浓度和催化温度相同时,在5~10 s内,反应时间越长,亚硫酸根检测效果越好。在10~60 s范围内检测速率变慢,检测效果基本达到最优,过长的反应时间不利于快速检测,因此10 s为最优反应时间,反应时间因素选择10,30,60 s这3个水平进行正交试验。
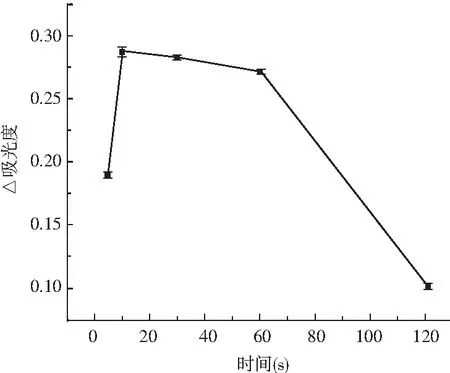
图5 反应时间对检测体系的影响结果Fig.5 Effect of reaction time on detection system
2.3 正交试验结果
在单因素试验结果的基础上,采用L9(34)正交试验表进行正交实验,对Fe3O4@Au模拟酶催化体系进行正交试验优化,结果见表1。
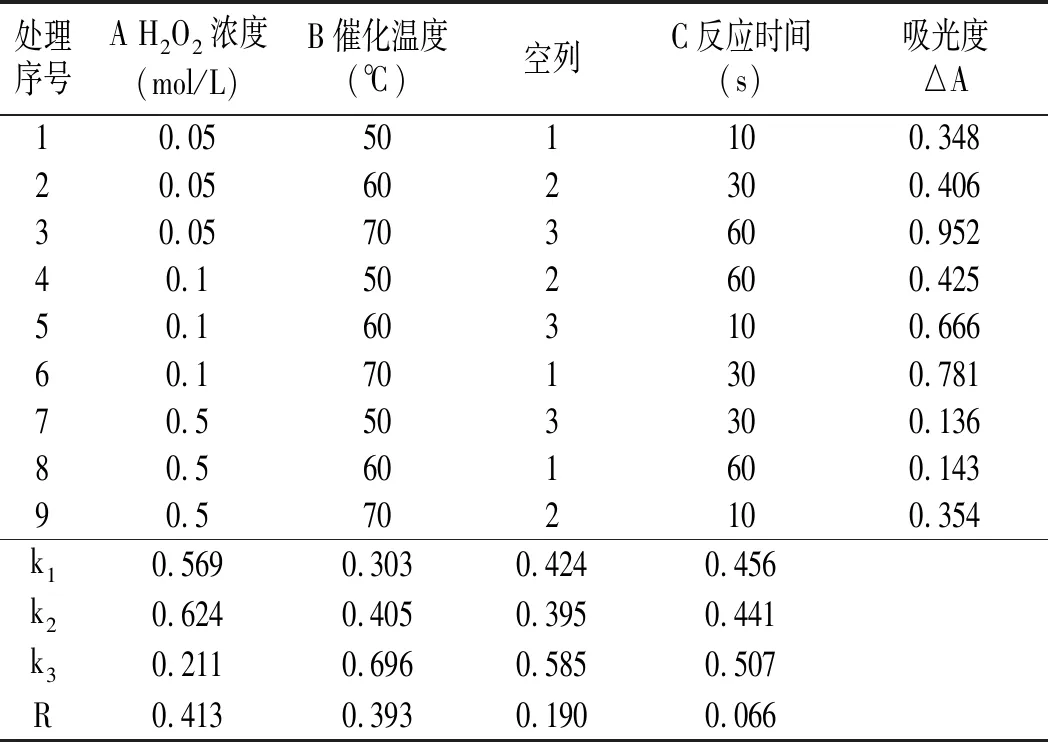
表1 正交试验设计及结果分析Table 1 Analysis of orthogonal experiment design and results
由表1极差分析结果可知,3个因素对Fe3O4@Au模拟酶催化体系的影响由大到小依次为H2O2浓度(A)>催化温度(B)>反应时间(C)。在正交试验设计范围内,得到Fe3O4@Au模拟酶催化体系的优化条件为A2B3C3,即H2O2浓度为0.1 mol/L,催化温度为70 ℃,反应时间为60 s。综合上述分析,可以说明H2O2浓度是影响检测体系的主要因素,催化温度和反应时间对反应体系也有相应的影响。
2.4 亚硫酸根检测体系的响应效果
2.4.1 最低检出限及回收率
对不同浓度的亚硫酸根做工作曲线,结果见图6。

图6 亚硫酸根检测体系工作曲线Fig.6 Standard curve of sulfite ion detection system
在最优反应条件下,反应体系在420 nm处吸光度的降低程度ΔA(y)与亚硫酸根的浓度c(x)成正比,亚硫酸根浓度在 0.001~0.02 mol/L范围内具有良好的线性关系,其线性方程为 y=67.652x+0.0713(R2=0.9872),检测限为1.47 μmol/L,样品回收率为95.26%~110%。
在相同反应体系下,定量检测0.01,0.005 mol/L亚硫酸根溶液的吸光度值,带入工作曲线回归方程,样品回收率分别为95.20%和102.36%,说明建立的检测方法符合检测准确度和重复性的要求。
2.4.2 检测体系选择性研究
选择性是比色检测体系的重要指标。试验过程考察了检测体系的选择性,结果见图7。
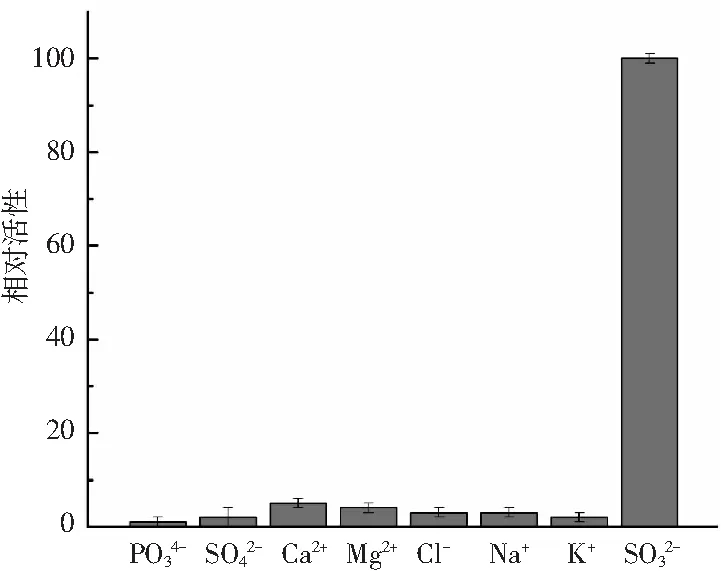
图7 亚硫酸根检测体系的选择性Fig.7 Selectivity of sulfite ion detection system
亚硫酸根检测体系与其他干扰离子检测体系的差异度非常显著,PO34-、SO42-、Ca2+、Mg2+、Cl-、Na+、K+基本不干扰亚硫酸根离子的测定,说明该模拟酶检测亚硫酸根的体系具有较高的检测特异性,不需要掩蔽这些离子。
3 结论
本文以Fe3O4@Au纳米材料作为过氧化物模拟酶建立一种灵敏度高、选择性好的亚硫酸根快速比色检测方法。将使用APTES氨基化修饰的磁性Fe3O4微粒和金纳米粒子采用组装法制备Fe3O4@Au复合材料,利用其催化活性建立亚硫酸根检测体系,探求体系最优工艺组合,评估体系检测性能。结果表明:氨基化后的Fe3O4纳米粒子负载金纳米粒子有助于提高金磁微粒的催化性能,基于其过氧化物模拟酶的活性建立的亚硫酸根检测方法特异性好、准确且可重复。该研究使现场快速可视化检测亚硫酸根的方法变得更加多元,为实际样品中亚硫酸根的检测奠定了基础。
