响应面法优化超高压提取蓝莓花色苷工艺及其活性研究
2020-08-14王鑫韩茜宇薛宏坤于国萍
王鑫,韩茜宇,薛宏坤,于国萍
(1.大理大学 公共卫生学院,云南 大理 671003;2.黑龙江国际旅行卫生保健中心,哈尔滨 150090;3.清华大学 工程物理系,粒子与辐射成像教育部重点实验室,北京 100084;4.东北农业大学 食品学院,哈尔滨 150030)
蓝莓(blueberry)果实体型小、呈诱人的蓝色,是世界上最重要的浆果之一,主要种植在我国东北和西南地区。果实中富含花色苷、超氧化物歧化酶、多种维生素等活性成分[1],大量研究表明花色苷具有抗氧化、抗炎、抗肿瘤及增强视力等功效[2,3],此外,花色苷颜色诱人,风味独特,通常作为天然的色素和食品添加剂,被广泛用于饮料、奶制品及膨化食品行业。蓝莓是天然花色苷色素的重要来源,如何快速、高效地从蓝莓中提取花色苷是当前研究的热点。
目前,蓝莓花色苷提取以传统溶剂提取为主,但由于该方法效率低、耗时长,同时溶剂被大量消耗[4],无法满足高效提取花色苷的需求。近年来,越来越多的新型提取技术被广泛用于花色苷的提取,如超声、微波和酶制剂(纤维素酶、果胶酶和蛋白酶等)等提取技术,以上提取技术均可以有效改善花色苷的提取效率,但同时这些新技术对设备要求较高、提取条件苛刻,且提取成本较高,均存在一定的局限性。而超高压提取技术作为物理提取方法更适用于热敏性成分的提取,其原理是利用超高压破坏离子键、疏水键及膜蛋白结构,从而降低活性成分的传质阻力[5];此外,超高压能增强细胞膜的通透性,加速目标成分溶解[6]。对比传统的提取技术,超高压提取技术具有提取时间短、提取效率高、杂质少、节能、安全等特点[7]。故超高压提取技术被广泛应用于茶多酚、植物多糖和黄酮的提取[8-10]。在花色苷活性方面,已有研究表明蓝莓经提取后获得的花色苷提取物能有效抑制肝癌HepG2细胞的增殖。薛宏坤等[11]和刘奕琳等[12]分别研究发现蓝莓果渣花色苷提取物和蓝靛果花色苷乙醇洗脱物均能抑制HepG2细胞的增殖。目前,采用超高压提取技术从蓝莓中提取花色苷的工艺及其提取物抗肿瘤作用机制的研究报道较少。因此,本研究首先探究提取压力、保压时间、乙醇体积分数和料液比4个因素对蓝莓花色苷含量的影响,并采用响应面方法优化其提取工艺参数;在此基础上,探究蓝莓花色苷提取物的体外活性及其机制,为蓝莓中天然色素的开发提供了理论依据,同时拓展了天然色素在食品中的应用价值。
1 材料与方法
1.1 材料与试剂
蓝莓:新鲜的蓝莓于2018年7月下旬采摘于黑龙江省大兴安岭地区,样品经除杂、清洗,置于-20 ℃冰箱中冷冻。
肝癌HepG2细胞:上海信裕生物科技有限公司;二甲基亚砜(DMSO):常州市恒誉化工有限公司;磷酸盐缓冲液(PBS):北京全式金生物技术有限公司;MTT和DMEM完全培养基:北京百奥莱博科技有限公司;乙醇、过硫酸钾、水杨酸和盐酸:南京中淳生物科技有限公司;三氯乙酸、硫酸亚铁和铁氰化钾:天津市金中化工原料销售有限责任公司;矢车菊素-3-葡萄糖苷(纯度≥98%):美国Sigma公司。
1.2 仪器与设备
EVOS M7000倒置显微镜 赛默飞世尔科技(中国)有限公司;HPP600 MPa/30 L超高压处理装置 包头科发高压科技有限公司;DRYER真空冷冻干燥器 德国西门子公司;RE-6000AT型旋转蒸发器 上海耀裕仪器设备有限公司;PRACTUM224-1CN分析天平 德国赛多利斯仪器有限公司;PHS-550雷磁pH计 上海仪电科学仪器有限公司;JYL-Y912九阳破壁机 杭州九阳股份有限公司。
1.3 方法
1.3.1 蓝莓粉末的制备
在试验前,从冰箱中将冷冻的蓝莓取出,室温解冻3 h,然后将其打浆,将果浆置于真空冷冻干燥机干燥72 h,采用植物粉碎机将其粉粹,过40目筛,制成蓝莓果粉,最后将果粉避光密封保存在-18 ℃冰箱中备用。
1.3.2 蓝莓花色苷超高压提取
将蓝莓果粉(2.0000±0.0005) g置于真空包装袋中,按照不同料液比加入不同体积分数的乙醇溶液,使其充分混合,封口,然后置于超高压设备中进行提取,提取温度为50 ℃,提取结束后,将萃取液置于离心机中以4000 r/min离心15 min,真空抽滤得上清液,将滤渣按上述方法重复提取2次,合并3次滤液,将滤液采用真空冷冻干燥机冻干,即获得蓝莓花色苷提取物粉末,置于-18 ℃冰箱中备用。
1.3.3 超高压提取蓝莓花色苷的单因素试验
将蓝莓粉末样品(2.0000±0.0005) g作为提取对象,考察不同提取压力、保压时间、乙醇体积分数和料液比对蓝莓粉末中花色苷含量的影响。在预试验的基础上,设定提取压力100,150,200,250,300 MPa 5个水平;保压时间2,4,6*,8,10 min 5个水平;乙醇体积分数40%、50%、60%*、70%、80% 5个水平;料液比1∶10、1∶20、1∶30*、1∶40、1∶50 (g/mL),每组试验重复3次(注:“*”表示当考察其他参数对花色苷含量影响时,用“*”标记的因素保持恒定水平)。
1.3.4 响应面法试验
在单因素试验结果的基础上,以提取压力(X1)、保压时间(X2)、乙醇体积分数(X3)和料液比(X4)为自变量,以花色苷含量(Y)为响应值。依据Box-Behnken试验设计原理,优化超高压提取蓝莓花色苷的工艺。试验因素与水平设计见表1。

表1 试验因素与水平设计Table 1 The factors and levels design of experiment
采用响应面分析法得到二次回归模型,见公式(1):
(1)
式中:b0为截距回归系数;bi为线性回归系数;bii为二次项回归系数;bij为交互项回归系数;Xi,Xj为自变量。
1.3.5 蓝莓花色苷含量的测定
参考于泽源等[13]的方法测定不同提取条件下蓝莓中花色苷含量,具体操作:从1.3.2所得的样品溶液中取出1 mL,然后分别加入9 mL pH 1.0 KCl缓冲液和9 mL pH 4.5 CH3COONa缓冲液,避光静置1 h,分别在520 nm和700 nm处测定其吸光值,依据公式(2)计算蓝莓中花色苷含量。
(2)
式中:c为蓝莓中花色苷含量,mg/g;A为样品的吸光值;DF为稀释倍数;V为样品提取液的体积,mL;Mw为矢车菊素-3-葡萄糖苷的相对分子质量(449.2);ε为矢车菊素-3-葡萄糖苷的消光系数(26900);l为光程,1 cm;m为蓝莓果粉的质量,g。
1.3.6 蓝莓花色苷提取物抗肿瘤活性
1.3.6.1 HepG2细胞的培养
将HepG2细胞培养于DMEM培养基(含体积分数10% FBS、1%青霉素和链霉素)中,培养条件为37 ℃、5% CO2恒温细胞培养箱中培养。
1.3.6.2 MTT法测定蓝莓花色苷提取物对HepG2细胞存活率的影响
采用MTT法测定不同浓度的蓝莓花色苷提取物(在上述最优工艺条件下获得的花色苷提取物)对HepG2细胞存活率的影响。操作方法同文献[3],并依据公式(3)计算细胞存活率。
细胞存活率(%)=As/Ac×100。
(3)
式中:As为试验组的吸光度值;Ac为空白对照组的吸光度值。
1.3.6.3 蓝莓花色苷提取物对HepG2细胞形态学的影响
调整HepG2细胞密度为1×106个/mL,以2 mL/皿接种于玻璃底小皿中,37 ℃、5% CO2培养过夜,换为终质量浓度为0,50,100,200 μg/mL蓝莓花色苷提取物的DMEM培养液,37 ℃、5% CO2继续培养48 h,在倒置显微镜下观察细胞形态。
1.3.6.4 蓝莓花色苷提取物对HepG2细胞凋亡的影响
取对数期HepG2细胞密度调整为2.5×105个/孔,接种于60 mm细胞培养板上,培养24 h,用不同浓度(0,50,100,200 μg/mL)的蓝莓花色苷提取物干预48 h,移除培养基,用胰蛋白酶消化,收集细胞,用PBS洗2次,然后采用Annexin V-FITC/PI双标记染色法流式检测细胞凋亡。
1.3.7 数据处理
每组试验重复3次,结果用平均值±标准差表示;采用SPSS 22.0软件对每组数据进行方差分析(ANOVA),组间差异比较用Duncan检测,P<0.05表示组间具有显著性差异;采用Origin 9.0进行绘图,采用Design Expert ver8.0软件设计组合试验。
2 结果与分析
2.1 单因素对蓝莓花色苷含量的影响
超高压提取蓝莓花色苷的单因素试验结果见图1。
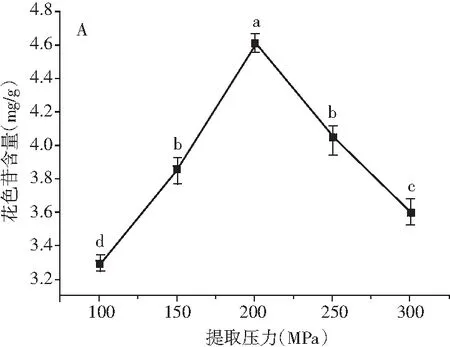
图1 提取压力(A)、保压时间(B)、乙醇体积分数(C)和料液比(D)对蓝莓花色苷含量的影响Fig.1 Effects of extraction pressure (A), pressure-holding time (B), ethanol volume fraction (C) and solid-to-liquid ratio (D) on the yield of anthocyanins from blueberry注:在误差线上的不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。
由图1中A可知,当提取压力低于200 MPa时,蓝莓花色苷含量随着提取压力的增加呈现显著增加趋势(P<0.05),当提取压力为200 MPa时,花色苷含量达到最大值(4.61±0.05) mg/g。其原因是高压破坏了离子键、疏水键和细胞膜上的结构蛋白,导致细胞膜通透性增加,传质阻力降低[14],有利于蓝莓细胞中的花色苷扩散到周围溶剂中;此外,升高的压力能提高花色苷的传质系数和溶解度,故花色苷提取率增加。但当压力超过200 MPa时,继续增加提取压力,花色苷含量呈现显著降低的趋势(P<0.05)。其原因可能是过高的提取压力破坏了花色苷结构,降低了花色苷含量,同时过高的压力还会给提取设备增加负担[15],综合考虑,选择提取压力150,200,250 MPa作为后续组合试验的因素水平。
由图1中B可知,当保压时间在2~6 min时,随着保压时间延长,花色苷含量呈显著增加趋势(P<0.05),当保压时间在6 min时,花色苷含量达到最大值(4.47±0.07) mg/g。其原因是在萃取初期蓝莓细胞内外的浓度梯度较大,浓度梯度作为传质的驱动力,较大的浓度梯度有利于细胞内的花色苷大量扩散到溶剂中,使得花色苷含量显著增加。当保压时间超过6 min时,花色苷含量随着保压时间延长无显著变化(P>0.05)。其原因是随着保压时间延长,内外浓度梯度趋近于零,故花色苷含量无显著变化。综合考虑,选择保压时间4,6,8 min作为后续组合试验的因素水平。
由图1中C可知,当乙醇体积分数在40%~60%时,随着乙醇体积分数增加,花色苷含量显著增加(P<0.05)。当乙醇体积分数在60%时,花色苷含量达到最大值(4.71±0.06) mg/g。其原因是60%乙醇极性与花色苷极性相似,依据相似相容原理,此时花色苷溶解度最大,花色苷含量最大[16]。当乙醇体积分数超过60%时,过高的乙醇使杂质的溶出量增加,从而降低了花色苷的溶出量,进而导致花色苷含量降低;此外,高体积分数的乙醇会破坏花色苷的结构[17]。故选择乙醇体积分数50%、60%、70%作为后续组合试验的因素水平。
由图1中D可知,花色苷含量随着料液比增加呈现先显著增加后显著降低的趋势(P<0.05)。其原因是在萃取初期,随着料液比增加,固液界面浓度梯度较大,有利于花色苷扩散到溶液中。随后如果继续增加料液比,过多的溶剂会引起杂质的溶解,从而降低花色苷的溶解度[18]。另外,过多的溶剂会增加对花色苷的分离纯化难度。因此综合考虑,选择料液比1∶20、1∶30、1∶40 (g/mL)作为后续组合试验的因素水平。
2.2 响应曲面法试验结果
2.2.1 模型建立与显著性检验
采用响应面优化超高压提取蓝莓花色苷工艺参数,所得的试验方案和结果见表2。以花色苷含量(Y)为响应值,对试验所得的数据进行多元回归拟合分析,得到蓝莓花色苷含量对提取压力(X1)、保压时间(X2)、乙醇体积分数(X3)和料液比(X4)的回归方程,见公式(4)。
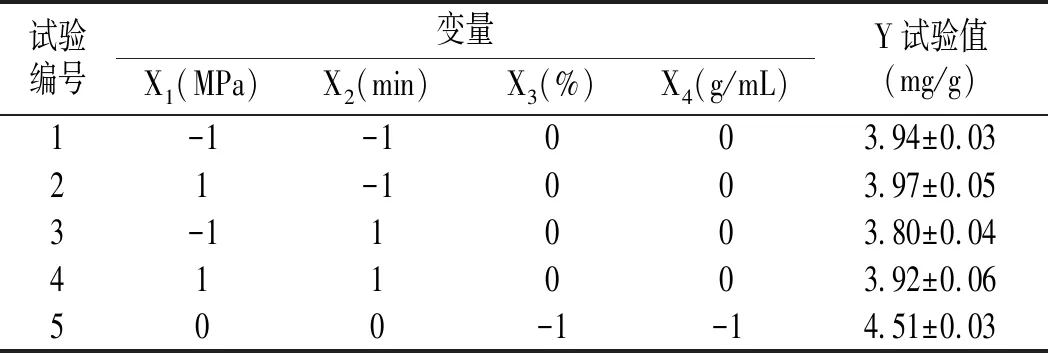
表2 响应面法试验设计及结果Table 2 Experimental design and results of response surface methodology

续 表
Y=4.80+0.036X1-0.043X2+0.10X3-0.14X4+0.022X1X2+0.025X1X3+0.040X1X4-0.028X2X3+0.035X2X4-0.018X3X4-0.58X12-0.32X22-0.12X32-0.22X42。
(4)
对回归方程系数进行显著性检验,结果见表3。
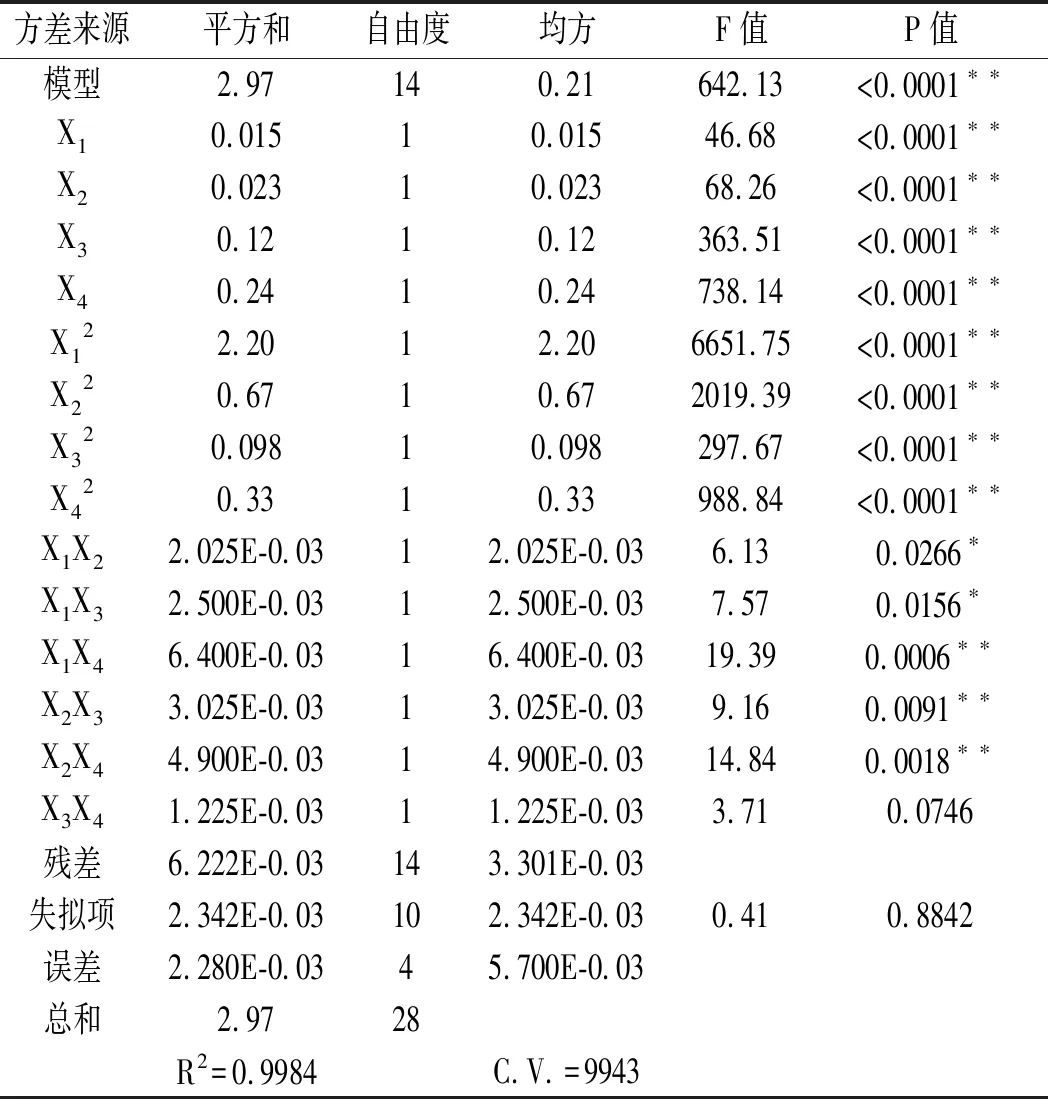
表3 超高压提取蓝莓花色苷回归模型系数的显著性检验报告Table 3 Significance test report of regression model coefficients of ultra-high pressure extraction of anthocyanins from blueberry
由表3可知,所得的回归模型决定系数R2=0.9984,F值为642.13,P值小于0.0001,表明所得模型极显著。该模型的失拟项P值=0.8842>0.05。上述数据分析表明该模型对试验数据拟合充分,可靠性较好。利用该模型可较好地描述各试验因素与响应值的真实关系,并且利用该模型可以优化超高压提取蓝莓花色苷的最佳工艺条件。
依据F值大小可以判断各试验因素对花色苷含量影响的程度,F值越大,表明该试验因素对提取效果的影响越显著。由表3可知,F(X1)=46.68、F(X2)=68.26、F(X3)=363.51和F(X4)=738.14,即各试验因素对蓝莓花色苷含量的影响大小为料液比>乙醇体积分数>保压时间>提取压力,且4个因素对花色苷含量的影响均达到极显著的水平。
采用响应面的坡度陡峭程度来衡量试验因素交互作用对响应值的影响强弱,响应曲面相对平缓,说明该因素交互作用对花色苷含量影响作用较小。各试验因素交互作用对蓝莓花色苷含量的影响见图2。
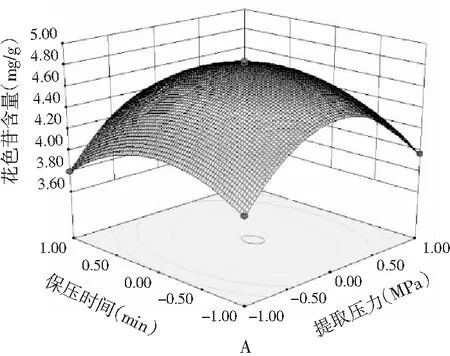
图2 各试验因素对蓝莓花色苷含量的交互影响Fig.2 Interaction effects of experimental factors on the yield of anthocyanins from blueberry
由表3中方差分析的结果可知,X1X4、X2X4和X2X3极显著影响花色苷含量(P<0.01);X1X3和X1X2显著影响花色苷含量(P<0.05);X3X4对花色苷含量的影响不显著(P>0.05)。由图2中A,B和C可知,随着提取压力增加,花色苷含量呈先显著增加后显著降低的趋势,当提取压力在175~225 MPa范围内,花色苷含量取得极大值。由图2中A,D和E可知,花色苷含量随着保压时间的延长呈现先显著增加后显著降低的趋势,当保压时间在5~7 min范围内,花色苷含量取得极大值。由图2中B,D和F可知,乙醇体积分数对花色苷含量的变化趋势较平缓。由图2中C,E和F可知,随着料液比增加,花色苷含量呈现先显著增加后显著降低的趋势,当料液比在1∶25~1∶35(g/mL)范围内,花色苷含量取得极大值。综上可知,各因素交互作用对蓝莓花色苷含量影响顺序为X1X4>X2X4>X2X3>X1X3>X1X2>X3X4。
2.2.2 验证试验
通过Design Expert软件对公式(4)的回归方程进行分析,得到最佳提取条件:提取压力187.28 MPa、保压时间5.91 min、乙醇体积分数56.75%、料液比1∶29.35 (g/mL),花色苷含量的理论值为5.02 mg/g,为验证该方法的可靠性,考虑实际情况,将最佳工艺参数修正为:提取压力187 MPa、保压时间6 min、乙醇体积分数57%、料液比1∶29 (g/mL),在此条件下进行超高压提取蓝莓花色苷的验证试验,所得花色苷含量的试验值为(5.16±0.12) mg/g,理论值和试验值相对误差为2.79%。说明模型可以较好地模拟和预测超高压提取蓝莓花色苷含量,也进一步证明了采用响应面法优化超高压提取蓝莓花色苷提取参数的可行性。
2.3 蓝莓花色苷提取物对HepG2细胞存活率的影响
不同浓度蓝莓花色苷提取物对HepG2细胞存活率的影响结果见图3。
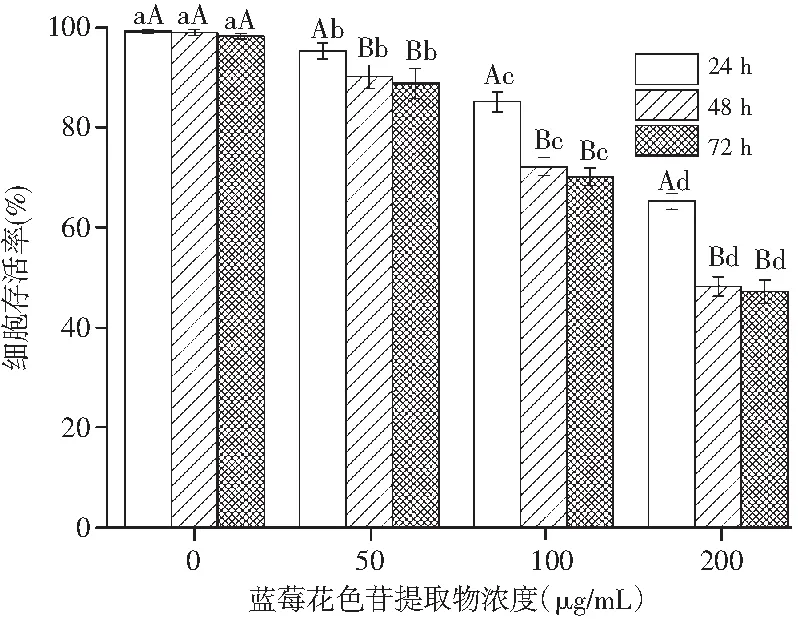
图3 蓝莓花色苷提取物对HepG2细胞生长抑制作用的剂量效应Fig.3 Dose effect of blueberry anthocyanin extracts on inhibition of HepG2 cells’ growth注:不同小写、大写字母分别表示不同样品间、不同剂量差异显著(P<0.05)。
由图3可知,在24,48,72 h后,HepG2细胞存活率均随着蓝莓花色苷提取物浓度增加呈现显著降低的趋势(P<0.05)。当蓝莓花色苷提取物浓度在50 μg/mL时,处理24,48,72 h后,HepG2细胞存活率分别为(95.35±1.59)%、(90.18±2.36)%、(88.83±3.04)%;当蓝莓花色苷提取物浓度在200 μg/mL时,处理24,48,72 h后,HepG2细胞存活率分别为(65.27±1.62)%、(48.19±1.96)%、(47.18±2.34)%,在24,48,72 h后,后者较前者HepG2细胞存活率分别降低了31.55%、46.56%、46.89%。
结果表明,蓝莓花色苷提取物能显著抑制HepG2细胞的增殖,且浓度越大,抑制效果越显著,表现出显著的剂量效应。当蓝莓花色苷提取物浓度一定时,24 h后HepG2细胞存活率显著高于48 h和72 h(P<0.05),而48 h和72 h后,HepG2细胞存活率无显著差别(P>0.05),因此,后续试验细胞培养选择48 h。
2.4 倒置显微镜观察蓝莓花色苷提取物对HepG2细胞形态的影响
不同质量浓度蓝莓花色苷提取物(0,50,100,200 μg/mL)作用48 h后HepG2细胞形态变化结果见图4。

图4 不同质量浓度的蓝莓花色苷提取物对HepG2细胞形态学的影响Fig.4 Effects of blueberry anthocyanin extracts with different concentration on morphology of HepG2 cells
由图4可知,当蓝莓花色苷提取物浓度为0 μg/mL时,细胞完全贴壁,细胞紧密相连,细胞数目较多。当采用蓝莓花色苷提取物干预HepG2细胞时,随着蓝莓花色苷提取物浓度增加,HepG2细胞数目显著降低,且细胞体积减小,大多数细胞由开始的菱形变成椭圆形,同时伴随凋亡小体的产生。
2.5 蓝莓花色苷提取物对HepG2细胞凋亡的影响
不同质量浓度蓝莓花色苷提取物(0,50,100,200 μg/mL)干预HepG2细胞48 h后癌细胞凋亡情况见图5。
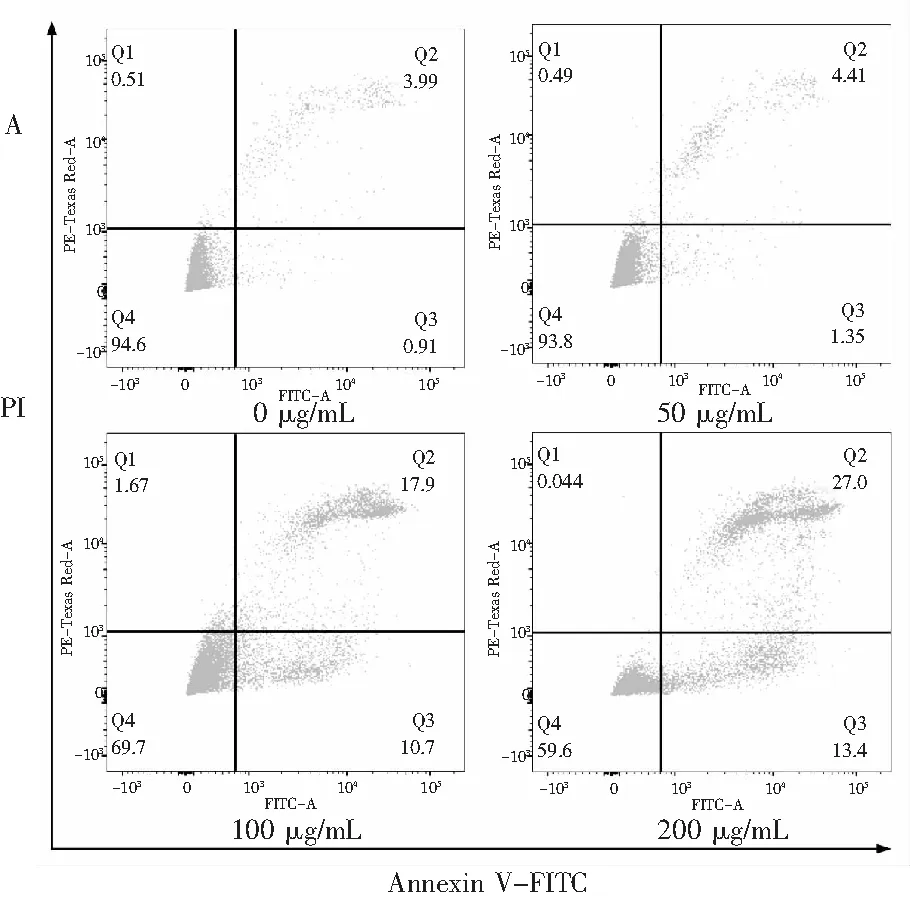
图5 蓝莓花色苷提取物对HepG2细胞凋亡的影响Fig.5 Effect of blueberry anthocyanin extracts on apoptosis of HepG2 cells注:A为流式检测蓝莓花色苷提取物处理HepG2细胞48 h凋亡;B为流式检测的统计结果分析。
目前,大量的研究已经证实蓝莓花色苷提取物具有显著的抗氧化能力[19],同时又能显著抑制癌细胞的增殖,加速癌细胞的凋亡[20]。因此,本试验在MTT的基础上,进一步探究蓝莓花色苷提取物对HepG2细胞凋亡的影响。由图5可知,当蓝莓花色苷提取物浓度为50,100,200 μg/mL时,HepG2细胞凋亡率分别为(5.76±0.43)%、(28.60±0.81)%和(40.40±1.27)%。结果表明,蓝莓花色苷提取物能显著提高HepG2细胞凋亡率,且蓝莓花色苷提取物浓度越大,HepG2细胞凋亡率越高,呈剂量效应。
3 结论
采用响应面法对蓝莓花色苷超高压提取工艺进行优化,确立最优的工艺参数组合为:提取压力187 MPa、保压时间6 min、乙醇体积分数57%、料液比1∶29 (g/mL),在此条件下花色苷含量为(5.16±0.12) mg/g。体外抗肿瘤活性表明蓝莓花色苷提取物能显著抑制HepG2细胞增殖,加速其凋亡。本研究结果为天然色素的快速提取提供了一种有效的手段,同时为开发功能性的食品添加剂提供了理论基础。
