外泌体APE1对非小细胞肺癌A549细胞顺铂敏感度的影响
2020-08-14戴楠赵晓龙代晓燕李梦侠
戴楠,赵晓龙,代晓燕,李梦侠
0 引言
肺癌是我国发病率和死亡率最高的恶性肿瘤[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的80%~85%[2],大部分NSCLC患者在发现时,已经进入晚期[3]。含铂方案是晚期无驱动基因突变NSCLC的主要化疗方案[4],但是由于大部分患者对铂类化疗不敏感,这些方案的治疗效果并不理想。因此探索NSCLC铂类耐药的机制,寻找有效的靶点,降低NSCLC对顺铂的抵抗能力,在NSCLC的治疗中显得尤为重要。
研究显示,对铂类化疗药物敏感度下降的NSCLC患者,血液中脱嘌呤脱嘧啶核酸内切酶(apurinic aprimidinic endonuclease 1,APE1)水平升高[5],提示外周循环中的APE1可能在铂类耐药中发挥重要作用。APE1是典型的核定位蛋白,缺乏典型分泌信号肽[6],目前其出核机制尚未完全阐明,因此血液中出现APE1蛋白这一反常现象引起了我们的思考。外泌体是内含核酸、蛋白、脂质等生物活性物质的细胞外小囊泡[7]。近年来,有研究显示APE1可通过外泌体分泌到细胞外[8]。由此,APE1可能存在于外泌体中,并通过外泌体传递到受体细胞,影响肿瘤细胞对铂类药物的敏感度。本研究选取NSCLC细胞株A549作为研究对象,观察细胞外泌体APE1的表达变化对受体细胞顺铂敏感度的影响。
1 材料与方法
1.1 试剂与仪器
RPMI 1640培养基、胎牛血清购自美国BI公司;10%去外泌体胎牛血清购自上海VivaCell公司;细胞上清外泌体提取试剂盒购自美国Invitrogen公司(货号4478359);抗APE1(货号ab137708)、Alix(货号ab117600)、CD9(货号ab223052),CD63(货号ab59479)、β-tubulin(货号ab6046)抗体购自英国Abcam公司,抗Calnexin(AF2425)、γ-H2AX(AF5836)抗体购自中国碧云天公司,PKH26购自美国Sigma-Aldrich公司,APE1敲低和高表达慢病毒购自上海吉凯基因科技有限公司,AT-101、E3330、inhibitor compound#3购自美国Selleckchem公司。MP-4型电泳仪及转印槽(Bio-Rad公司,美国),透射电子显微镜(JEOL公司,日本),纳米粒度颗粒跟踪分析仪(ZetaView S/N 17-310,德国),激光共聚焦显微镜(Olympus公司,日本),荧光倒置显微镜(Olympus公司,日本)。
1.2 实验方法
1.2.1 细胞培养 A549细胞购自美国ATCC公司(Manassas,VA,美国)。将细胞(1×105个/毫升)接种于细胞培养皿中,使用RPMI 1640培养基(含90%RPMI1640培养液,10%胎牛血清,1%的青-链霉素),置于37℃、5%饱和湿度的恒温培养箱中培养。待细胞生长至80%左右,换含10%去外泌体胎牛血清培养基,继续培养48 h后,收集细胞上清液用于提取外泌体。
1.2.2 外泌体分离和鉴定 取收集好的细胞培养上清液,4℃,500g离心10 min,取上清液重复一次,2 000g离心30 min,上清液用0.22 μm滤膜过滤后,用细胞上清外泌体提取试剂盒,按说明书步骤提取细胞培养上清外泌体。收集的外泌体沉淀采用RIPA裂解液重悬用于Western blot分析;无菌PBS重悬用于细胞共培养实验。外泌体样本置于-80℃冰箱保存备用。
1.2.3 Western blot分析 取收集好的外泌体裂解液,12 000g高速离心15 min,加入5×上样缓冲液,100℃变性5 min。配制SDS-Page胶,蛋白上样电泳,100 V恒压条件下转膜90 min,在5%的脱脂奶粉37℃封闭1 h,加入一抗稀释液(APE1 1:1 000,Alix 1:1 000,CD9 1:1 000,CD63 1:1 000,Calnexin 1:1 000,β-tubulin 1:2 000,γ-H2AX 1:1 000),4℃孵育过夜,TBST洗涤3次,加入相应种属二抗(1:5 000),37℃孵育1 h,TBST洗涤,采用化学发光显影系统显影。采用Gel-Pro Analyzer软件分析各组条带灰度值,计算目的蛋白与内参蛋白灰度值比值,用于评估目的蛋白表达量。
1.2.4 透射电子显微镜和纳米示踪分析(NTA)取外泌体样本5 μl滴加在载样铜网上,室温孵育5 min,孵育结束后,用吸水纸在一侧吸干多余液体;向铜网上滴加一滴2%的乙酸双氧铀,室温孵育3 min;孵育结束后,用吸水纸在一侧吸干液体,室温放置2 h晾干,透射电子显微镜观察外泌体形态。取冻存样本,25℃水浴解冻,冰上放置。取10 μl样本进行相应比例稀释,利用纳米粒度颗粒跟踪分析仪进行纳米示踪分析。
1.2.5 慢病毒转染 按1×105个/孔接种A549细胞于6孔板中,待细胞完全贴壁后,根据公式病毒体积=(MOI×细胞数目)/病毒滴度进行病毒感染,感染12 h补液培养至24 h后换正常培养基继续培养,72 h荧光表达丰度较高,用荧光显微镜观察感染效率80%左右且细胞生长状态良好,加入含一定浓度的嘌呤霉素培养基对感染的细胞进行筛选48 h,荧光显微镜下观察鉴定,扩大培养收集细胞冻存备用。细胞转染慢病毒空白或无义序列载体作为对照组(NC)。
1.2.6 APE1抑制剂处理细胞 细胞分别加入3种APE1功能抑制剂(inhibitor compound #3:APE1内切酶活性的催化抑制剂;E3330:临床试验广泛应用的APE1氧化还原活性抑制剂;AT101:醋酸棉酚的R-(-)型对映体,直接与APE1相互作用的APE1活性抑制剂)5 μmol/L,处理细胞48 h。
1.2.7 外泌体染色和观察 为了观察外泌体是否能够被受体细胞所吸收,采用外泌体染色试剂PKH26对外泌体染色3 min,加入血清终止染色,200 000g超速离心2 h,去上清液,100 μl含10%FBS的DMEM用枪头轻柔重悬。与A549细胞37℃下共同孵育4 h,对照组(Con)细胞加PBS代替外泌体悬液,1.4%多聚甲醛常温固定15 min,PBS洗涤后DAPI常温染色15 min,PBS洗三遍,加抗荧光淬灭剂,透明指甲油封片,激光共聚焦显微镜观察外泌体被细胞摄取情况。
1.2.8 CCK-8实验 相同数量的A549细胞接种于6孔板中,待细胞完全贴壁后加入100 ml细胞上清提取外泌体共培养48 h。将共培养细胞接种于96孔板中,5 000个/孔,加入不同浓度的CDDP处理48 h,每孔加入含10% CCK-8检测试剂的培养基,37℃孵育2 h,于波长450 nm处检测吸光度值,并计算细胞存活率,存活率(%)=试验组吸光度/对照组吸光度×100%。各组实验重复3次。
1.2.9 细胞免疫荧光 按照50%的密度接种A549细胞于6孔板中,待细胞完全贴壁后加入不同处理下的外泌体共培养48 h,将正常的A549细胞及共培养后的A549细胞按照60%的密度爬片于6孔板中,加入1 μg/ml CDDP处理48 h后进行免疫荧光染色。PBS清洗2次,加入4%多聚甲醛固定15 min,PBS清洗2次,37℃下加入0.1% Triton X100打孔1 h,PBS清洗2次,加入一抗γ-H2AX(1:400),4℃孵育过夜,PBS清洗2次,加入对应属性的荧光二抗,37℃孵育1 h,PBS清洗2次,DAPI染核,清洗后脱水封片于荧光显微镜下观察。
1.3 统计学方法
运用SPSS19.0软件进行统计分析,所有数据均采用均数±标准差(±s)表示,多组均数的比较采用单因素方差分析,两组均数的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞外泌体的收集与鉴定
透射电子显微镜下可见典型的双层膜囊泡状结构,见图1A,NTA显示其粒径为30~120 nm,粒径分布峰型单一,见图1B。Western blot检测显示外泌体中表达标志性蛋白(CD63,CD9,Alix),未检测到阴性对照蛋白Calnexin(一种内质网整合蛋白),见图1C、1D。
2.2 高表达APE1的细胞产生高表达APE1的外泌体
不同浓度的顺铂处理A549细胞48 h后,利用CCK-8检测得出IC50值为2.04±0.39 μg/ml,见图2A。Western blot检测发现顺铂处理细胞后,APE1表达升高(F=28.684,P=0.000),见图2B。用2 μg/ml顺铂处理A549细胞48 h后,提取A549细胞上清中的外泌体(EXOCDDP),Western blot 检测外泌体APE1蛋白表达,A549外泌体(EXO)作为对照,结果显示EXOCDDP的APE1蛋白升高(F=3.236,P=0.048),见图2C。采用慢病毒转染细胞,成功构建了高表达APE1的细胞——A549APE1细胞(F=3.691,P=0.001),见图2D,提取A549APE1细胞外泌体(EXOAPE1),Western blot检测发现外泌体APE1蛋白表达升高(F=2.822,P=0.013),见图2E。以上结果表明,高表达APE1的A549细胞能够产生高表达APE1的外泌体。
2.3 APE1以外泌体包装的形式被受体细胞所吸收
共聚焦显微镜观察显示,与染色后的外泌体共培养后,A549受体细胞内出现大量红色PKH26标记的外泌体,而对照组A549细胞内未出现红色信号,见图3A。将外泌体与受体细胞共同培养48 h,Western blot检测受体细胞APE1表达增加(F=32.176,P=0.000),见图3B。将带有GST标签的APE1纯化蛋白与A549细胞共同孵育48 h,Western blot检测发现,细胞内未检测到外源性的GSTAPE1纯化蛋白,见图3C。以上结果说明,APE1能够通过外泌体包装的方式进入细胞,而非游离蛋白形式。

图1 A549外泌体的鉴定Figure 1 Identification of A549 exosomes
2.4 外泌体APE1降低受体细胞对顺铂的敏感度
将顺铂处理细胞后产生的外泌体(EXOCDDP)与A549细胞共培养48 h后,CCK-8检测发现受体细胞在0.5 μg/ml(F=8.971,P=0.040)、1 μg/ml(F=0.259,P=0.012)、2 μg/ml(F=2.830,P=0.021)、4 μg/ml(F=0.015,P=0.018)、6 μg/ml(F=3.199,P=0.042)顺铂中的存活率明显升高,见图4A。将EXOAPE1与受体细胞共培养48 h,CCK-8检测发现受体细胞在1 μg/ml(F=4.359,P=0.004)、2 μg/ml(F=0.153,P=0.009)、4 μg/ml(F=0.603,P=0.028)、6 μg/ml(F=1.285,P=0.018)顺铂中的存活率也明显升高,见图4B。以上结果表明,高表达APE1的外泌体可以降低细胞对顺铂的敏感度。
2.5 APE1的碱基切除修复功能在外泌体介导的顺铂敏感度改变中发挥主要作用

图2 高表达APE1的A549细胞产生高表达APE1的外泌体Figure 2 A549 cells with high expression of APE1 produced exosomes with high expression of APE1

图3 APE1以外泌体包裹的形式进入受体细胞Figure 3 APE1 entered receptor cells in form of exosomes
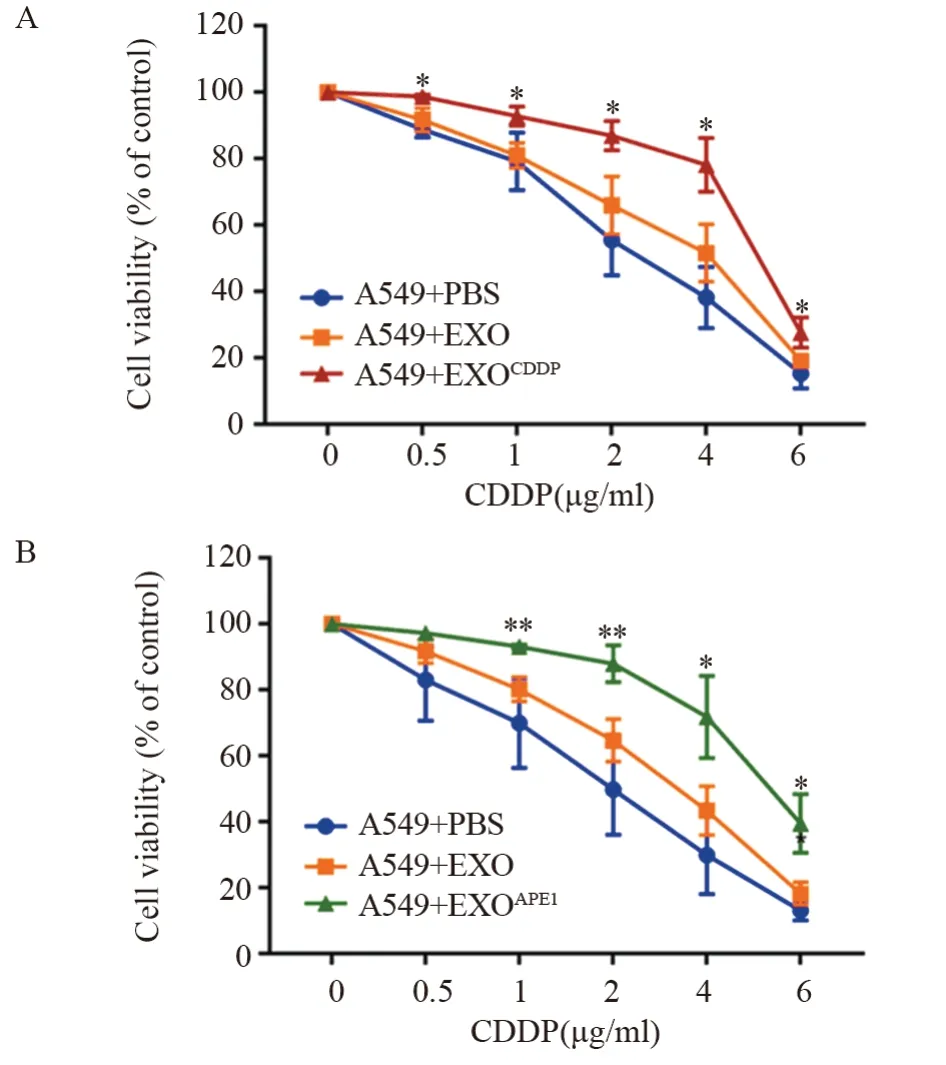
图4 外泌体APE1降低受体细胞对顺铂的敏感度Figure 4 Exosome APE1 reduced sensitivity of receptor cells to cisplatin
A549细胞采用APE1shRNA敲低内源性的APE1后(图5A),与EXOAPE1共培养48 h。分别加入3种APE1功能抑制剂,用CCK-8检测受体细胞在顺铂中的存活率,未加抑制剂的细胞作为对照组。结果显示,当使用inhibitor compound#3抑制剂后,细胞在0.5 μg/ml(F=0.199,P=0.000)、1 g/ml(F=1.090,P=0.000)、2 μg/ml(F=1.105,P=0.000)、4 μg/ml(F=1.968,P=0.017)顺铂中的敏感度明显恢复,见图5B。进一步观察顺铂刺激下γ-H2AX蛋白(DNA损伤的标志蛋白)的表达情况,免疫荧光显示,EXOAPE1处理受体细胞后γ-H2AX减少,使用inhibitor compound#3抑制剂后,γ-H2AX增多,见图5C,Western blot检测得到了相似的结果(F=7.007,P=0.027),见图5D。
3 讨论
以铂类为基础的联合化疗仍然是NSCLC的主要治疗手段。但是在铂类方案化疗过程中,NSCLC患者却常常由于受到耐药的制约而导致化疗失败[9]。近年来,外泌体(一种纳米粒径级别的膜性小囊泡),由于可通过其囊泡内携带的多种生物活性物质传递耐药性,而引起广泛关注[10]。APE1具有DNA损伤修复和氧化还原双功能,在NSCLC铂类耐药中发挥关键作用[11],然而APE1在外泌体传递耐药过程中发挥的作用及其机制尚未见报道。
我们通过对NSCLC A549细胞外泌体的检测发现,外泌体中确实存在APE1蛋白的表达,且在顺铂刺激下,外泌体APE1表达升高;进一步研究发现,APE1主要是以外泌体包装的形式被受体细胞所吸收。为了验证顺铂刺激下外泌体APE1升高的现象是否与NSCLC细胞对顺铂的敏感度相关,我们构建高表达APE1的外泌体(EXOAPE1),将其与A549细胞共培养,结果发现受体细胞对药物的敏感度明显下降。以上结果表明,外泌体中的APE1能够发挥其特有的生物学功能,降低受体细胞对顺铂的敏感度。

图5 A549受体细胞顺铂敏感度下降与APE1的碱基切除修复功能有关Figure 5 Decrease of sensitivity of A549 receptor cells to cisplatin was related to base excision and repair function of APE1
一些研究显示,APE1的碱基切除修复功能在化学药物导致的DNA损伤修复中发挥作用[12],另外一些研究则表明,APE1通过对一些转录因子的氧化还原调控[13],影响肿瘤细胞的耐药性。为此我们对外泌体APE1的功能进行了初步探索发现,分别采用3种不同的APE1功能抑制对细胞进行处理,结果显示,当采用APE1的内切酶活性抑制剂(inhibitor compound #3)后,与高表达APE1外泌体共培养的A549受体细胞对顺铂的敏感度得以恢复。顺铂主要通过损伤肿瘤细胞DNA,阻止其复制和转录,最终导致细胞死亡。结果提示,在顺铂的短期刺激下,APE1的碱基切除修复功能促进顺铂导致肺腺癌细胞的DNA损伤的修复,从而在外泌体介导的顺铂抵抗中发挥主要作用。
综上所述,NSCLC细胞释放的外泌体中含有APE1,而顺铂刺激会增加外泌体的APE1水平,外泌体APE1能够被A549受体细胞所吸收,最终导致A549细胞对顺铂的敏感度下降。其中APE1的碱基切除修复功能可能发挥关键作用。然而鉴于APE1还具有氧化还原调控、调节RNA代谢[14]等多种功能,后续还需要对包括肿瘤间质细胞在内的多种不同来源的外泌体APE1的功能进行进一步的验证。此外,APE1是生物体细胞内的关键蛋白,对细胞的生存和发展至关重要,如果将细胞内的APE1敲除,细胞几乎无法存活[15],而靶向外泌体中的APE1或许并不会影响正常细胞的功能,因此选择外泌体APE1作为肿瘤治疗的靶点值得深入研究。
