不同抗性小鼠ECTV 感染前后重要模式识别受体的组织表达差异分析
2020-08-13何小兵成温玉贾怀杰陈国华房永祥刘翊中景志忠
何小兵,王 聪,成温玉,贾怀杰,陈国华,房永祥,刘翊中,景志忠,*
(1.中国农业科学院兰州兽医研究所 家畜疫病病原生物学重点实验室 农业部兽医公共卫生重点实验室,兰州 730046; 2.西北民族大学生命科学与工程学院,兰州 730030)
病毒感染细胞后,会释放出自身的核酸DNA 或RNA,其中DNA 可被胞内的DNA 模式识别受体识别,引起转录因子IRFs 和NF-κB 的活化,进而激活I型IFNs 和炎症因子以及抗病毒基因的表达,启动早期的抗感染天然免疫反应。 因此天然免疫DNA 识别受体是宿主细胞模式识别受体(PRRs)的重要组成部分,在抵御DNA 病毒以及其他病原感染中具有关键作用[1]。 其中TLR9 是第一个被发现的DNA 识别受体,位于pDC 和B 细胞的内涵体上,主要识别DNA病毒基因组中非甲基化的CpG-DNA,通过MyD88-IRF7 信号轴诱导I 型IFNs 的产生[2]。 近年来,一系列胞质DNA 识别受体被陆续报道,大部分胞质DNA识别受体主要通过STING 诱导I 型IFNs 及IL-1β 和IL-18 的表达,发挥抗病毒天然免疫作用[3-4]。 目前,DNA 识别受体主要包括Toll 样受体家族中的TLR9、OAS 样受体家族中的cGAS 及DAI 和RNA 聚合酶III(RNA pol III)等[1,5-7]。
鼠痘(Mousepox) 是由鼠痘病毒(Ectromelia virus, ECTV)感染啮齿动物鼠类引起的一种高度接触性传染病[8]。 ECTV 是正痘病毒属的成员,不仅是研究人兽共患痘病毒跨种感染与传播的模式病原,也是研究痘病毒与宿主天然免疫系统相互作用的良好模型[9]。 研究发现,不同品系小鼠对ECTV感染具有易感性与抗性,其中BALB/c 小鼠对鼠痘易感而C57BL/6 小鼠对其具有抗性[10-13],但人们对其易感/抗性分子机制,特别是模式识别天然免疫分子机制与其相关性研究几乎为空白,为揭示小鼠抵抗ECTV 感染的模式识别与天然免疫应答机制,首先建立实时荧光定量PCR 技术方法(qPCR)[14],对不同抗性品系小鼠在正常状态和感染ECTV 后其DNA 识别受体的组织差异表达进行分析比较,探讨鼠痘病毒抗性/易感小鼠DNA 模式识别天然免疫信号途径关键分子的组织表达差异与抗病性的关系。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
6~8 周龄SPF 级BALB/c 品系小鼠(雌雄各半)40 只,体重20~22 g,购自中国农业科学院兰州兽医研究所实验动物中心[SCXK(甘)2015-001];6~8 周龄SPF 级C57BL/6 品系小鼠(雌雄各半)40只,购自兰州大学实验动物中心[SCXK(甘)2015-002]。 为保证小鼠的活动空间,每只鼠笼饲养5 只小鼠,自由采食、饮水,实验在中国农业科学院兰州兽医研究所生物安全三级(P3) 实验室中进行[SYXK(甘)2015-003],由中国农业科学院兰州兽医研究所实验动物福利与伦理管理委员会审核遵循3R 原则(LVRIAEC2016-005)。
1.1.2 实验细胞及毒株
Vero 细胞购自中国科学院上海生命科学研究院细胞资源中心;ECTV 毒株由本实验室分离鉴定并保存。
1.2 主要试剂
DMEM 培养基、胎牛血清(fetal calf serum,FBS)购自美国Gibco 公司;TRIzol Reagent 购自美国Invitrogen 公司;淋巴细胞分离液购自美国Sigma 公司;PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒,SYBR©Premix ExTaqTMII 试剂盒,DL2000 DNA marker 购自大连宝生物生物工程有限公司等;其他试剂均为化学纯。
1.3 实验方法
1.3.1 传代细胞的复苏与培养
从液氮中取出装有Vero 细胞的冻存管,用少量含有10%胎牛血清的DMEM 培养基轻轻将细胞重悬,然后将细胞悬液转入到细胞培养瓶中,37℃、5%CO2恒温复苏培养。
当Vero 细胞形态良好,且汇合80%~90%时可进行传代培养。 根据细胞生长情况进行1 ∶3传代,传代后的细胞仍于37℃、5% CO2培养箱中进行培养。
1.3.2 ECTV 的TCID50测定
传代培养的Vero 细胞用于病毒滴度测定,每天观察细胞病变效应(cytopathic effect, CPE)并记录结果,一般观察7~10 d。 按照Reed-Muench 法进行计算:lgTCID50=细胞病变高于50%的病毒稀释度的对数+距离比例×稀释系数的对数。 其中,距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)。
1.3.3 小鼠感染与采样
将40 只BALB/c 和40 只C57BL/6 小鼠按照参考文献[3]介绍的方法分别随机分为8 组(5 只/组),其中1 组作为空白对照,不进行感染;1 组作为感染对照,进行感染;其余6 组均为实验组,感染对照组和实验组分别按103.5TCID50每只小鼠皮下注射0.1 mL ECTV 液,攻毒后采集感染前后的小鼠组织样品,其中设定感染前的样品为0 hpi(hour post inoculation, hpi)。 实验组小鼠分别在感染ECTV 后6 h、12 h、24 h、48 h、96 h、144 h 六个时间点,采集小鼠血液、心脏、脾、肝、肺、肾、小肠和肌肉组织。
1.3.4 样品处理
血液样品采用淋巴细胞分离液,分离外周血单个核细胞(PBMCs);组织样品用灭菌PBS 溶液冲洗,剪碎,将5 只小鼠的组织样品混合,称重后分装至无RNA 酶的1.5 mL EP 管中,按每50 ~150 mg组织样品加入1 mL TRIzol,充分研磨呈匀浆后,-80℃保存备用。
1.3.5 总RNA 的提取及检测
取-80℃保存的小鼠PBMC、心脏、肝、脾、肺、肾、肌肉、小肠组织各一管,按TRIzol Reagent 法提取各组织总RNA。 用1%琼脂糖凝胶电泳检测其质量,用核酸浓度测定仪检测提取的RNA 纯度,当OD260与OD280的比值在1.8 ~2.1 范围内时,表明提取RNA 样品的质量比较好。 提取RNA 时依据0 hpi、6 hpi、12 hpi、24 hpi、48 hpi、96 hpi、144 hpi 七个不同时间点分批提取,避免单次提取样品数量过多造成的RNA 降解或污染等问题。
1.3.6 cDNA 的合成
参照PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒说明进行两步法反转录合成小鼠七个时间点的8 种组织的cDNA 模板。 反应总体系为20 μL,反应步骤及程序如下:
(1)根据核酸浓度测定仪检测的各RNA 样品的浓度,计算反应体系中需加入1.0 μg RNA 样品时其所需加入的体积,每个无RNA 酶的PCR 管中应加入的组分如下:
RNA 模板(RNA template)<1.0 μg,基因组DNA消除剂(gDNA Eraser)1.0 μL,5×DNA 消除剂缓冲液(5×DNA Eraser Buffer)2.0 μL,无RNA 酶水(RNA free water)X μL,总体积补足到10.0 μL。
(2)将上述反应液充分混合,短暂离心后置于42℃金属浴反应2 min。 反应结束后,将其取出置于冰中。
(3)然后向上述各PCR 反应管中再加入以下各反应组分:
反转录酶混合物(PrimeScript RT Enzyme Mix)1.0 μg,反转录引物混合物(RT primer Mix)1.0 μL,5×反转录缓冲液(5×Primerscript Buffer)4.0 μL,无RNA 酶水(RNA free water)4.0 μL,总体积补足到10.0 μL。
(4)轻轻混匀后,于PCR 仪中37℃孵育反转录15 min,85℃变性5 s,反应终止即得反转录产物cDNA 模板,于-20℃保存备用。
1.3.7 引物设计
选择在组织内广泛表达,并高度保守的基因为内参基因,以其扩增的产物作为参照物。 经分析确定β-actin 为本实验的最佳内参基因,它在感染前后小鼠的不同组织中表达高度稳定。 根据NCBI/GenBank 中公布的基因序列,应用Primer 3 Input 设计目的基因与内参基因的实时荧光定量PCR 引物,并采用PrimerBank 对上下游引物进行验证,所有引物均由上海英骏生物工程有限公司合成,引物的基本信息见表1。
1.3.8 实时荧光定量PCR
以上述反应体系、反应程序和引物对目的基因进行实时荧光定量PCR(qPCR)扩增对引物特异性验证,随后以β-actin 为内参基因对所有实验样品中6 个目的基因进行定量扩增,每个样品的目的基因与内参基因必需一一对照在96 孔板上,均各设三个技术重复及三次生物学重复,根据扩增后的融解曲线判断扩增的特异性。
1.4 统计学方法
采用2-△△Ct法计算相对表达量,实验数据以平均数+标准差()表示。 分析感染前目的基因在小鼠PBMC、心脏(heart)、肝(liver)、脾(spleen)、肺(lung)、肾(kidney)、小肠(small intestine)、肌肉(muscle) 组织中的表达差异,以及小鼠在感染ECTV 前(0 hpi)、感染后(6 hpi、12 hpi、24 hpi、48 hpi、96 hpi、144 hpi)七个时间点的目的基因表达量的变化。

表1 小鼠重要DNA 识别受体qRT-PCR 引物Table 1 Primers of DNA sensors used for the qRT-PCR assay
2 结果
2.1 易感/抗性品系小鼠感染模型的建立
按照103.5TCID50接种剂量经腹部皮下分别感染BALB/c 和C57BL/6 小鼠,经实验观察发现,BALB/c 品系小鼠在感染后第7 天,2 只感染鼠出现一定的感染症状,表现为食欲衰退,被毛粗乱,嗜睡,精神不振。 感染后第10 天,5 只BALB/c 小鼠均出现感染症状,并有1 只死亡。 而在整个观察过程中,感染对照C57BL/6 小鼠均未出现临床症状,但提取感染3 d 的C57BL/6 小鼠脾的基因组DNA,普通PCR 扩增检测到ECTV 基因的存在。 这说明BALB/c 和C57BL/6 小鼠对ECTV 存在易感性的差异,本实验成功地建立了ECTV 的易感/抗性品系小鼠感染模型。
2.2 目的基因qPCR 扩增方法的建立
普通PCR 扩增产物经1%琼脂糖凝胶电泳检测,如图1 所示可见各目的基因条带单一,且大小与预期一致,表明扩增特异性及稳定性较好,引物可用于后续qPCR 扩增。
从各目的基因的熔解曲线(图2)可以看出,所设计实时荧光定量PCR 引物扩增产物特异性好,无引物二聚体或其他非特异性扩增产物等引起的杂峰出现,可用于相应目的基因的表达差异检测。
2.3 TLR9 在不同品系小鼠组织中的表达差异分析
2.3.1 TLR9 在正常小鼠组织中的表达差异

图1 小鼠重要DNA 识别受体基因的PCR 扩增Note.M, DNA marker.1, TLR9.2, DAI.3,cGAS.4, STING.5, RNA Pol III.6, RIG-IFigure 1 Amplification of key DNA sensors genes by PCR
在BALB/c 和C57BL/6 小鼠的PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中均能检测到TLR9的转录表达。 以BALB/c 小鼠的脾平均相对表达量为对照,结果表明:TLR9 在BALB/c 小鼠的小肠组织中表达量最高,其次为脾和肌肉组织,在PBMC、心脏、肝、肺、肾组织中表达量极低;TLR9 在C57BL/6 小鼠的脾组织中表达量最高,其次为心脏组织,在PBMC、肝、肺、肾、小肠、肌肉组织中表达量极低;比较两种品系小鼠间TLR9 的表达差异发现,其在C57BL/6 小鼠的脾和心脏组织中的表达量明显高于BALB/c 小鼠,而在小肠组织中表达量明显低于BALB/c 小鼠(图3)。
2.3.2 TLR9 在感染小鼠组织中的表达差异
以0 h 正常小鼠组织平均相对表达量为对照,结果表明:在BALB/c 小鼠感染ECTV 后,TLR9 在PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中的表达量均上调,其在感染后第144 h 的PBMC 和肺组织中表达量最高,在感染后第24 h 的心脏、脾、肾组织中表达量最高,在感染后第96 h 肝、肌肉组织中表达量最高,在感染后第48 h 的小肠组织中表达量最高。
图2 小鼠重要DNA 识别受体基因的熔解曲线Note.A, TLR9.B, DAI.C, cGAS.D, STING.E, RNA Pol III.F, RIG-I.Figure 2 Dissociation curves of DNA sensor genes for the gene-specific primer
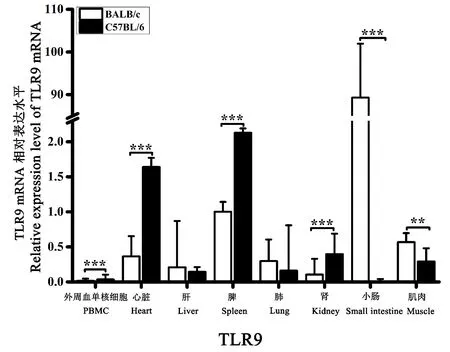
图3 TLR9 在正常小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of TLR9 mRNA.The X-axis shows the different organic tissues.Compared with the BALB/c group,**P<0.01,***P<0.001.Figure 3 Relative level of TLR9 mRNA expression in different tissues from control mice
在C57BL/6 小鼠 感染 ECTV 后, TLR9 在PBMC、肺、小肠等组织中表达量均上调,其中在PBMC 中表达最高,可达28 倍;在PBMC、肾、肌肉等组织的不同时间点均存在明显的表达上调现象,其在感染后第144 h 的PBMC、肝、脾、肺、肌肉组织中表达量达到最高,在感染后第6 h 的肾组织中表达量最高,在感染后第48 h 的小肠组织中表达量最高;但在脾和心脏组织中表达下调(图4)。
2.4 DAI 在不同品系小鼠组织中的表达差异分析
2.4.1 DAI 在正常小鼠组织中的表达差异
BALB/c 小鼠和C57BL/6 小鼠的PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中均能检测到DAI 的转录表达。 以BALB/c 小鼠的脾平均相对表达量为对照,结果表明:DAI 在BALB/c 小鼠的肝组织中表达量最高,其次分别为小肠、脾、心脏、肌肉、肾组织,在PBMC 和肺组织中表达量极低;DAI 在C57BL/6 小鼠的肌肉组织中表达量最高达30 倍,其次为小肠、肺、肝、心脏、脾、肾组织,在PBMC 中表达量最低;比较两种品系小鼠间DAI 的转录表达差异发现,其在C57BL/6 小鼠的任一组织中的表达量都高于BALB/c 小鼠(图5)。
2.4.2 DAI 在感染小鼠组织中的表达差异
以0 h 正常小鼠的组织平均相对表达量为对照,结果表明:在BALB/c 小鼠感染ECTV 后,DAI 在PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中表达量均上调,其在感染后第144 h 的PBMC 和肺脏组织中表达量最高,在感染后第24 h 的肝、脾、肺、肾、肌肉组织中表达量最高,在感染后第48 h 心脏、小肠组织中表达量最高。
在C57BL/6 小鼠感染ECTV 后,DAI 在PBMC中表达量上调,而在心脏、肝、脾、肺、肾、小肠组织中的表达量下调,直至第144 h 开始呈现上调趋势,其中在脾、心脏、肺和小肠组织上调最明显;而在肌肉组织中的表达量显著下调(图6)。

图4 TLR9 在感染小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of TLR9 mRNA.The X-axis shows the different time point(h) after infection.Compared with the BALB/c group,*P<0.05,**P<0.01,***P<0.001.Figure 4 Relative mRNA expression level of TLR9 in different tissues of mice after infected ECTV
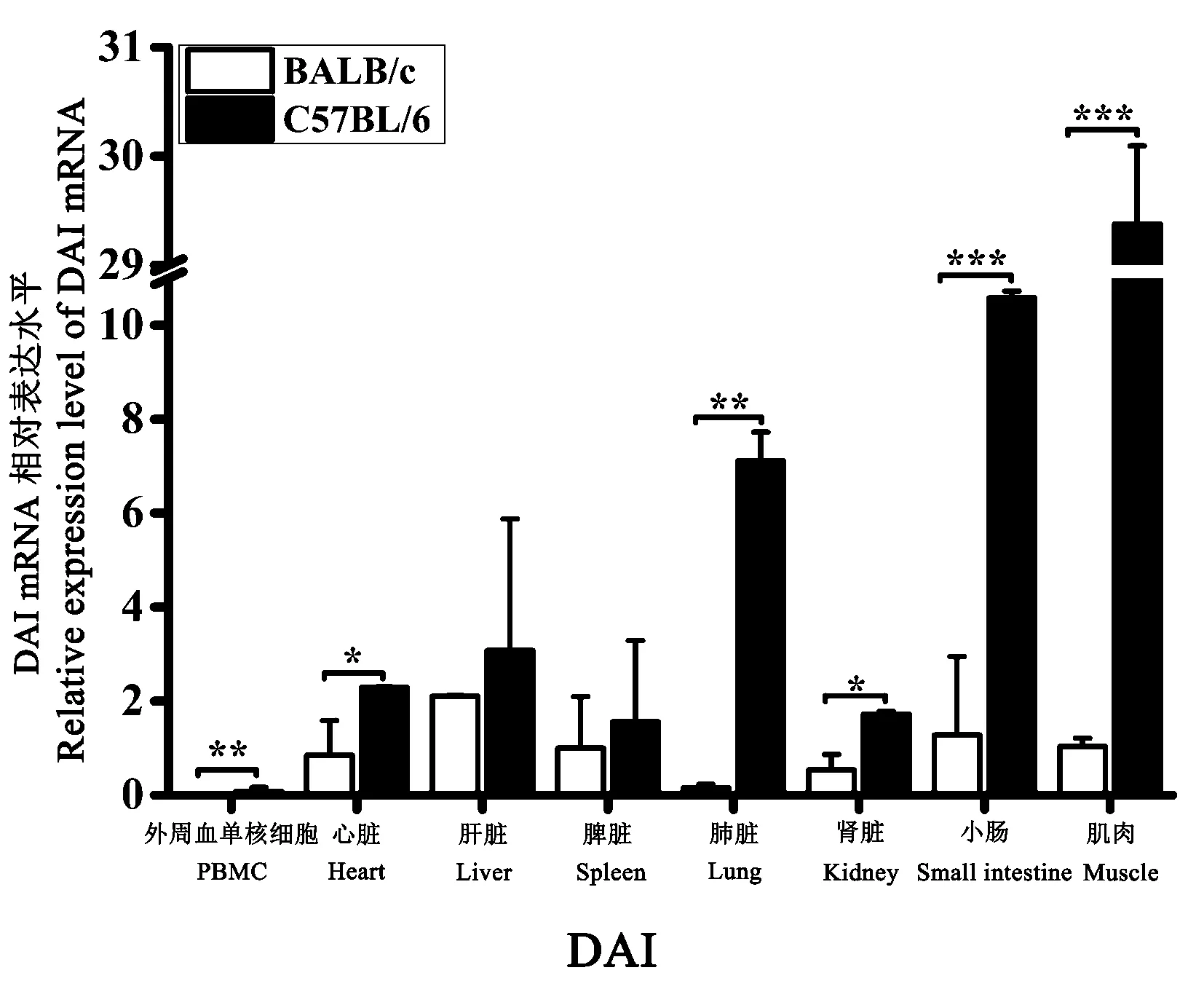
图5 DAI 在正常小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of DAI mRNA.The X-axis shows the different organic tissues.*P<0.05,**P<0.01,***P<0.001.Figure 5 Relative levels of DAI mRNA expression different tissues from control mice
2.5 cGAS 在不同品系小鼠组织中的表达差异分析
2.5.1 cGAS 在正常小鼠组织中的表达差异
BALB/c 和C57BL/6 小 鼠的PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中均能检测到cGAS 的转录表达。 以BALB/c 小鼠脾的平均相对表达量为对照,结果表明:cGAS 在BALB/c 小鼠的脾组织中表达量最高,其次分别为肺、心脏、肌肉、肾组织,在PBMC、肝、小肠组织中表达量极低;cGAS 在C57BL/6 小鼠的肌肉组织中表达量最高,其次分别为心脏、脾、肺、肝组织,在PBMC、肾、小肠组织中表达量极低;比较两种品系小鼠间cGAS 的表达差异发现,其在C57BL/6小鼠的PBMC、心、肝、肌肉组织中的表达量明显高于BALB/c 小鼠,在脾、肺、小肠和肾的表达量差别不大(图7)。
2.5.2 cGAS 在感染小鼠组织中的表达差异
以0 h 正常小鼠的组织平均相对表达量为对照,结果表明:在BALB/c 小鼠感染ECTV 后,cGAS在PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中表达量均上调,其中在感染后第144 h 的PBMC 中表达量最高,在感染后第96 h 的心脏、肝、脾组织中表达量最高,在感染后第48 h 肾、肌肉组织中表达量最高,在感染后第24 h 肺、小肠组织中表达量最高。
在C57BL/6 小 鼠 感 染 ECTV 后, cGAS 在PBMC、心脏、脾、肺、肾、小肠组织中表达量变化不大,但在感染后第144 h 的PBMC、心脏、脾、肺、小肠组织中表达上调且量最大,在感染后第6 h 的肾组织中表达量最高;而cGAS 在肝和肌肉组织中的表达均下调(图8)。

图6 DAI 在感染小鼠不同组织中的表达差异Note.The Y-axis shows relative expression level of DAI mRNA.The X-axis shows the different time point(h) after infection.Compared with the BALB/c group,*P<0.05,**P<0.01,***P<0.001.Figure 6 Relative mRNA expression level of DAI in different tissues of mice after infected ECTV
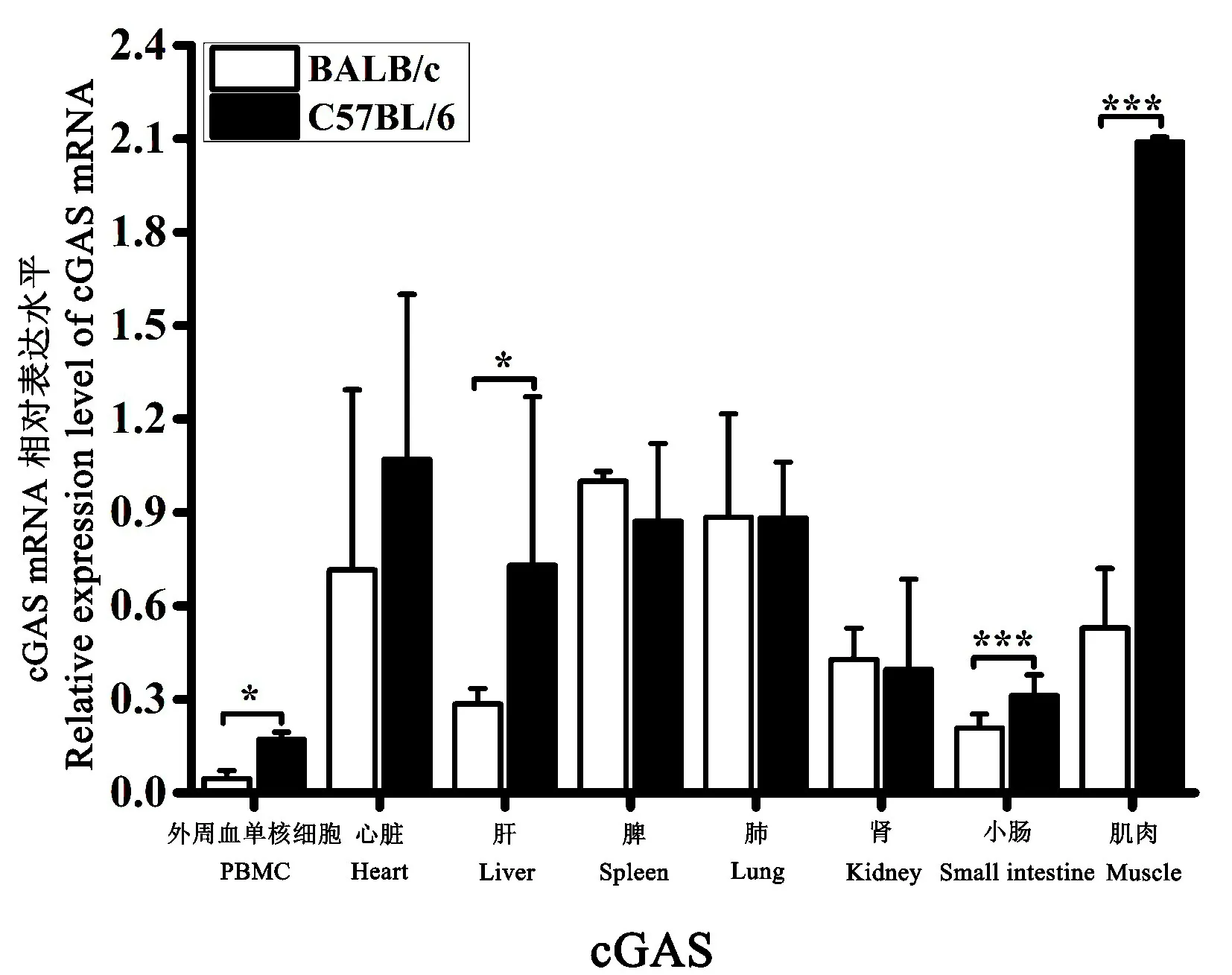
图7 cGAS 在正常小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of cGAS mRNA; The X-axis shows the different organic tissues.Compared with the BALB/c group,*P<0.05,***P<0.001.Figure 7 Relative level of cGAS mRNA expression in different tissues from control mice
2.6 RNA pol III 在不同品系小鼠组织中的表达差异分析
2.6.1 RNA pol III 在正常小鼠组织中的表达差异
BALB/c 和C57BL/6 小鼠的PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中均能检测到RNA pol III的转录表达。 以BALB/c 小鼠的脾平均相对表达量为对照,结果表明:RNA pol III 在BALB/c 小鼠的肌肉组织中表达量最高,其次分别为心脏、肝、肾、肺、脾、小肠组织,在PBMC 中表达量最低;RNA polIII在C57BL/6 小鼠的肌肉组织中表达量最高,其次分别为肾、肺、肝、心脏、脾、小肠组织,在PBMC 中表达量最低;比较两种品系小鼠间RNA pol III 的表达差异发现,其在C57BL/6 小鼠的肌肉组织中表达量显著高于BALB/c 小鼠,而在其余组织中的表达量无明显品系间差异(图9)。
2.6.2 RNA pol III 在感染小鼠组织中的表达差异
以0 h 正常小鼠的组织平均相对表达量为对照,结果表明:在BALB/c 小鼠感染ECTV 后,RNA pol III 在PBMC、心脏、肝、脾、肺、肾、小肠、肌肉组织中表达量均上调,其中在感染后第12 h 的PBMC、心脏、肌肉组织中表达量最高,在感染后第24 h 的肾、小肠组织中表达量最高,在感染后第96 h的肝、脾组织中表达量最高,在感染后第144 h 的肺组织中表达量最高。
在C57BL/6 小鼠感染ECTV 后,RNA pol III 在PBMC、心脏、肝、脾、肺、小肠、肌肉组织中表达量均上调,其中在感染后第12 h 的PBMC 中表达量最高,在感染后第48 h 的心脏、肝组织中表达量最高,在感染后第144 h 的脾、肺、小肠组织中表达量最高;而RNA pol III 在肾、肌肉组织中的表达均呈下调(图10)。
2.7 RIG-I 在不同品系小鼠组织中的表达差异分析
2.7.1 RIG-I 在正常小鼠组织中的表达差异

图8 cGAS 在感染小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of cGAS mRNA.The X-axis shows the different time point (h) after infection.Compared with the BALB/c group, *P<0.05, **P<0.01, ***P<0.001.Figure 8 Relative mRNA expression level of cGAS in different tissues of mice after infected ECTV
BALB/c 和C57BL/6 小鼠的PBMC、心脏、肝、脾、肺、肾、小肠组织中均能检测到RIG-I 的转录表达。 以BALB/c 小鼠脾的平均相对表达量为对照,结果表明:RIG-I 在BALB/c 小鼠的肝和肺组织中表达量较高,其次分别为肾、脾、心脏、小肠组织,在PBMC 中表达量最低;RIG-I 在C57BL/6 小鼠的肝组织中表达量最高,其次分别为肾、心脏、脾、肺、小肠组织,在PBMC 中表达量最低;比较两种品系小鼠间RIG-I 的表达差异发现,其在C57BL/6 小鼠的肝、肾、心脏和脾等组织中的表达量都显著高于BALB/c 小鼠(图11)。
2.7.2 RIG-I 在感染小鼠组织中的表达差异
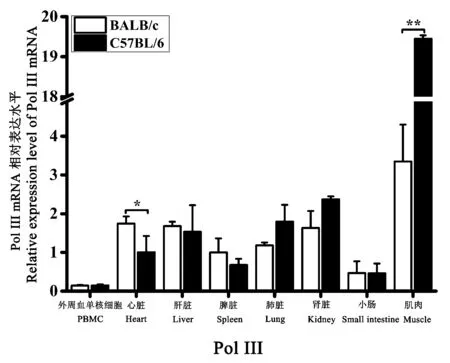
图9 RNA pol III 在正常小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of RNA pol ⅢmRNA.The X-axis shows the different organic tissues.Compared with the BALB/c group,*P<0.05,**P<0.01.Figure 9 Relative level of RNA pol III mRNA expression in different tissues from control mice
以0 h 正常小鼠的组织平均相对表达量为对照,结果表明:在BALB/c 小鼠感染ECTV 后,RIG-I在PBMC、小肠、心脏、肾、肝、脾、肺组织中表达量均上调,其中在感染后第144 h 的PBMC 中表达量最高,在感染后第24 h 的心脏、肝、PBMC、脾、肺、肾组织中表达量最高,在感染后第48 h 的小肠组织中表达量最高。
在C57BL/6 小 鼠 感 染 ECTV 后, RIG-I 在PBMC、心脏、肝、脾、肺、肾、小肠组织中表达量均上调,其中在感染后第144 h 的PBMC、心脏、脾、肺、肾组织中表达量最高,在感染后第12 h 的肝脏组织中表达量最高,在感染后第6 h 的小肠组织中表达量最高(图12)。
3 讨论
TLR9 是第一个被发现的DNA 识别受体,能够识别微生物基因组中的CpG DNA 序列,激活MyD88 依赖的信号通路,从而促进I 型干扰素和促炎症细胞因子的表达[2]。 DAI 能识别胞质中dsDNA,DAI 与DNA 结合后,一方面介导I 型干扰素的产生,另一方面激活NF-κB 通路产生多种细胞因子[7]。 cGAS 与胞质中DNA 结合生成cGAMP,进而激活STING 并磷酸化TBK1,启动天然免疫反应[3]。RNA pol III 能够识别胞质中的poly (dA ∶dT)即DNA 成分,并转录成dsRNA,进而被RIG-I 识别,激活VISA 并诱导I 型干扰素表达[1,5]。 本研究旨在探讨这些DNA 识别受体表达差异与小鼠抗病力之间的关系,进而为抗ECTV 感染的天然免疫机制研究奠定基础。 因此,本实验选择对ECTV 感染易感的BALB/c 小鼠和抗性的C57BL/6 小鼠进行研究,通过对其PBMC、心脏、肝、脾、肺、肾、小肠、肌肉等8个组织的TLR9、DAI、cGAS、RNA pol III、RIG-I 基因在ECTV 感染前后转录表达的实时定量检测,发现这些重要受体在不同抗性小鼠中的差异表达特征和规律,探讨其与抗病性间的关系。
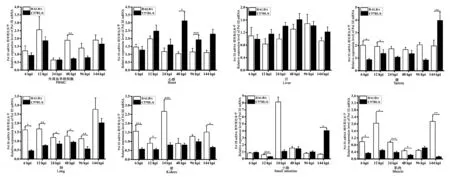
图10 RNA pol III 在感染小鼠不同组织中的表达差异Note.The Y-axis shows relative expression level of RNA pol ⅢmRNA.The X-axis is the different time point(h) after infection.Compared with the BALB/c group, *P<0.05, **P<0.01, ***P<0.001.Figure 10 Relative mRNA expression level of RNA pol III in different tissues of mice after infected ECTV

图11 RIG-I 在正常小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of RIG-I mRNA.The X-axis shows the different organic tissues.Compared with the BALB/c group,*P<0.05,***P<0.001.Figure 11 Relative level of RIG-I mRNA expression in different tissues from control mice

图12 RIG-I 在感染小鼠不同组织中的表达差异Note.The Y-axis shows the relative expression level of mRNA.The Xaxis shows the different time point(h) after infection.Compared with the BALB/c group,*P<0.05,**P<0.01,***P<0.001.Figure 12 Relative mRNA expression level of RIG-I in different tissues of mice after infected ECTV
在小鼠感染前实验研究发现,TLR9 在BALB/c小鼠的小肠和脾组织中表达量较高,在C57BL/6 小鼠的脾组织中表达量较高,而在其余组织中均为低水平表达,说明TLR9 可能主要在免疫器官中发挥重要作用,这与TLR9 在人富含免疫细胞的组织如脾、淋巴结、骨髓和外周血中高度表达的结论一致[15]。
DAI 分别在BALB/c 小鼠和C57BL/6 小鼠的肝和肌肉组织中表达量最高,在PBMC 中表达量最低。 但在不同抗性小鼠间比较发现,其在C57BL/6小鼠的任一组织中的表达量都高于BALB/c 小鼠。有研究表明,DAI 基因在人的小肠、脾、淋巴结、扁桃体、骨髓中表达量较高,而在胸腺、肺、肝、胰腺中表达量较低[16]。 这说明DAI 在不同组织中的表达具有明显的种属、品系差异性。
cGAS 在BALB/c 小鼠的脾组织中表达量最高,其次分别为肺、心脏、肌肉、肾组织,在PBMC、肝、小肠组织中表达量极低;cGAS 除在C57BL/6 小鼠的肌肉组织中表达量最高外,在其他组织中的表达趋势二者基本一致,但cGAS 在C57BL/6 小鼠的PBMC、心脏、肝、肌肉组织中的表达量明显高于BALB/c小鼠。
RNA pol III 在BALB/c 小鼠和C57BL/6 小鼠的肌肉组织中表达量最高,在PBMC 中表达量最低;比较两品系小鼠间RNA pol III 的表达差异发现,其在C57BL/6 小鼠的肌肉组织中表达量显著高于BALB/c 小鼠,而在其余组织中的表达量无明显品系间差异。 RIG-I 在BALB/c 小鼠和C57BL/6 小鼠的肝组织中表达量最高,在PBMC 中表达量最低;比较两品系小鼠间RIG-I 的表达差异发现,其在C57BL/6 小鼠的肝、肾、心脏和脾等组织中的表达量都显著高于BALB/c 小鼠。 尽管本实验发现这两个基因在组织中的表达模式有所不同,但有研究表明,腺病毒和EB 病毒的DNA 在RNA pol III 的作用下转变成5’-ppp-dsRNA,然后被RIG-I 识别,诱导IFNα/β 的表达,这说明RNA pol III 与RIG-I 在识别和应答DNA 上具有功能相关性,且共同发挥了间接识别和应答DNA 的天然免疫[6]。
当ECTV 感染BALB/c 小鼠和C57BL/6 小鼠后,检测上述5 个基因在两种品系小鼠的八个组织中表达量的变化,发现这5 个基因在BALB/c 小鼠的各个组织中表达均上调,但其表达峰值出现的时间点在每种组织中有所不同,大多是在感染后第24 h 表达量达到最高。 在C57BL/6 小鼠感染ECTV后,除RIG-I 基因整体表达上调外,其余4 个基因仅在免疫相关组织的一些感染时间点特别是144 h 明显呈峰值上调表达,在非免疫组织的大多数感染时间点均呈下调表达,其中TLR9 和DAI 分别在心脏和肌肉组织中表达下调,cGAS 在肝组织中的表达下调,RNA pol III 在肾和肌肉组织中均表达下调。
总之,TLR9、DAI、cGAS、RNA pol III 和RIG-I 这5 个与DNA 直接或间接识别相关的受体在不同抗性小鼠组织中均呈广泛性表达,但在非感染时C57BL/6 小鼠的表达明显高于BALB/c 小鼠,在ECTV 感染后BALB/c 小鼠的这些基因表达明显上调,而C57BL/6 小鼠变化不大甚至下调,这种差异表达现象说明这些基因可能与小鼠的抗病力有关,但具体关系与机制需进一步深入研究。
