α2 肾上腺素能受体激动剂对缺血再灌注大鼠脑组织NF-κB 及炎症因子表达的影响
2020-08-13邱永升宗小川陈夜茜姚东东贾英萍
邱永升,魏 巍,宗小川,周 锐,陈夜茜,王 帅,姚东东,贾英萍*
(1.郑州大学附属儿童医院 河南省儿童医院 郑州儿童医院麻醉科 河南省儿童神经发育工程研究中心,郑州450018; 2.哈佛大学医学院附属布列根和妇女医院, 美国 马萨诸塞 波士顿02101)
脑缺血再灌注引起一系列的病理生理变化导致继发性脑组织损伤,包括很多环节,如炎症反应兴奋性氨基酸的释放增加、能量障碍、自由基的生成、凋亡基因的激活、细胞内钙的失稳态等。 这些环节互为因果,相互联系,形成恶性循环,从而导致细胞的凋亡或坏死[1-4]。 其中炎症反应的发生发展起到重要作用,核因子-κB (nuclear factor kappa B,NF-κB)在机体炎症反应中有着关键的作用,激活后会加重创伤性脑实质损害,与其密切相关的炎性介质主要有肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukiN-1β,IL-1β)以及白细胞介素-6(interleukiN-6,IL-6)等[5-8]。 脑缺血再灌注可引起NF-κB 的活化,从而可调控上述介质基因的诱导表达。 α2肾上腺素能受体(α2adrenergic receptor,α2-AR)激动剂右美托咪定对脑缺血损伤具有保护作用[9-11]。 本研究拟评价α2-AR激动剂在大鼠局灶性脑缺血再灌注过程中对NF-κB表达的影响,探讨α2-AR 激动剂脑保护的机制。
1 材料和方法
1.1 实验动物
健康7 周龄雄性SPF 级SD 大鼠90 只,体重(226±27)g,购于河南省实验动物中心[SCXK(豫)2017-0001],所有动物在河南省实验动物中心实验室独立动物房饲养[SYXK(豫)2011-0001],室温(22±1)℃,12 h 光照/12 h 黑暗循环,自由获取食物和水。 动物的使用及操作按照本院动物管理委员会(IACUC2017002)的规定执行,使用实验动物时严格按照,3R 原则给予人道关怀。
1.2 主要试剂与仪器
α2-AR 激动剂右美托咪定由江苏恒瑞医药股份有限公司提供;TNF-α 和IL-1β ELISA 检测试剂盒由美国Sigma 公司生产;核蛋白提取试剂盒为美国Active Motif 公司产品;电转印装置为Pharmcia Nova Blot 产品。
1.3 实验方法
1.3.1 实验分组
90 只SD 雄性大鼠,采用数字表法随机分为3组,分别为假手术组(S 组)、缺血再灌注对照组(C组)和α2-AR 激动剂右美托咪定干预组(D 组),每组30 只,每个亚组为6 只,即根据大鼠缺血再灌注的时间,随机平均分为5 个亚组(术后2、6、12、24 、48 h) 。
1.3.2 动物模型建立
采用改良Longa 大脑中动脉线栓法制造大鼠脑损伤模型[7]。 大鼠称重俯卧位固定腹腔注射3%戊巴比妥钠30 mg/kg,消毒后分离暴露左侧颈总及颈内、外动脉,采用长度为40 mm、直径为0.25 ~0.28 mm 的尼龙鱼线作栓线,从颈外动脉向颈内动脉方向插入大脑中动脉,如遇阻即停(进线长度为18 ~20 mm),S 组线栓深度为10 mm。 大鼠栓塞成功后,在缺血后2 h 将线拔到颈外动脉残端内,再进行灌注。 D 组于缺血前30 min 经腹腔注射α2-AR 激动剂右美托咪定100 μg/kg(4 μg/mL)。 C 组给予等体积的0.9%生理盐水。 按照亚组分组再灌注的时间,断头取脑,将标本置于液氮保存备用。
1.3.3 检测指标
各组大鼠分别在伤后2、6、12、24 及48 h 5 个时相点断头取术侧脑组织加等渗盐水制备匀浆,离心之后,取上清液1 mL,-80℃保存备用,酶联免疫法(enzyme-linked immuno sorbent assay ,ELISA)测定TNF-α 和IL-1β 的含量。 简述如下:ELISA 微孔板中加入稀释的标准品以及待测样品每孔100 μL,设空白对照,37℃水浴1 h, PBST(phosphate buffered solution tween, PBST)洗板5 次,严格 参照说明书操作知悉,酶标仪450 nm 处测量吸光度A 值,根据标准品绘制标准曲线,通过样本的A 值计算对应TNFα、IL-1β 水平。
1.3.4 免疫印迹分析
各样本取100 μg 大鼠脑组织标本置于12.5%聚丙烯酰胺凝胶进行电泳,分离的蛋白随后经电转印装置转印到聚偏二氟乙烯膜,于室温在封闭液中作用3 h 加入NF-κB p65 抗体,置于4℃孵育过夜,用TTBS (tween tris base buffer solution, TTBS)缓冲液冲洗4 次(15 分/次),再加入二抗羊抗兔IgG,室温摇动孵育1 h,采用TTBS 缓冲液冲洗后行增强化学发光反应,把聚偏二氟乙烯膜上显影的条带扫描入电脑中,经图像分析系统处理得出对应的灰度值,结果以目的蛋白与内参蛋白灰度值之比来表示。
1.3.5 水迷宫实验测定
在模型制备之后的24 以及48 h 时,分别取6只大鼠,将其随机放到一个象限内,测定大鼠的逃避潜伏期,即使大鼠都面向池壁,记录它们在60 s之内找到平台的时间,如果90 s 内大鼠未还未找到平台,则认定该大鼠逃避潜伏期为90 s,每只大鼠测定5 次,并取平均值。
1.3.6 神经功能缺陷评分
在模型制备之后的24 以及48 h,将神经功能缺陷评分总分设定为10 分,分别取6 只实验大鼠行神经功能缺陷测试,包括反应、协调运动能力和警觉性。
1.4 统计学方法
采用SPSS 17.0 软件分析,正态分布的计量资料以平均数±标准差即()表示,多个样本均数的比较采用方差分析,进一步两两比较采用LSD法,前后时间点的比较采用配对t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 α2-AR 激动剂对大鼠脑组织NF-κB 表达的影响
S 组、C 组、D 组NF-κB 目的蛋白与内参蛋白灰度值之比分别为(0.17±0.012)、(0.54±0.015)、(0.34±0.017),C 组与S 组比较表达高,差异有统计学意义(P<0.05);D 组目的蛋白与内参蛋白灰度值之比低于C 组,差异有统计学意义(P<0.05),详见图1。
2.2 脑组织TNF-α 含量
S 组2、6、12、24 和48 h 5 个时相点脑组织TNFα 含量分别为(2.03±0.06)pg/mg、(2.09±0.05)pg/mg、(2.10±0.02)pg/mg、(2.08±0.06)pg/mg、(2.07±0.03)pg/mg,差异无统计学意义;C 组脑组织TNFα 含量在伤后2、6、12、24 及48 h 含量分别为(6.01±0.25)pg/mg、(6.47±0.46)pg/mg、(6.72±0.37)pg/mg、(6.85±0.51)pg/mg、(6.99±0.32)pg/mg,比S 组高(P<0.05);D 组脑组织TNF-α 含量在伤后2、6、12、24、48 h 含量分别为(4.17±0.27)pg/mg、(4.25±0.23)pg/mg、(4.11±0.45)pg/mg、(4.09±0.53)pg/mg、(3.87±0.54)pg/mg,比S 组高(P <0.05),比C 组低(P<0.05),见图2。
2.3 脑组织IL-1β 含量
S 组2、6、12、24、48 h 5 个时相点脑组织IL-1β 含量含量分别为(4.12±0.05)pg/mg、(4.27±0.07)pg/mg、(4.61±0.06)pg/mg、(4.24±0.05)pg/mg、(4.38±0.08)pg/mg,差异无统计学意义;C 组脑组织IL-1β水平在伤后2、6、12、24、48 h 含量分别为(8.35±0.80)pg/mg、(8.26±0.71)pg/mg、(8.53±0.12)pg/mg、(8.62±0.24)pg/mg、(8.79±0.21)pg/mg,比S 组高(P<0.05);D 组脑组织IL-1β 水平在伤后2、6、12、24、48 h 含量分别为(5.67±0.62)pg/mg、(5.74±0.90)pg/mg、(5.82±0.53)pg/mg、(5.91±0.19)pg/mg、(5.56±0.27)pg/mg,比S 组高(P<0.05),比C 组低(P<0.05)。 见图3。
2.4 神经功能缺陷评分和逃避潜伏期
模型制备后24 h S 组、C 组和D 组神经功能缺陷评分分别为(0.35±0.05)分、(5.43±0.29)分、(2.25±0.25)分,模型制备后48 h 神经功能缺陷评分分别为(0.30±0.06)分、(4.64±0.60)分、(1.46±0.31)分,与S 组相比,C 组和D 组神经功能缺陷评分高(P<0.05),模型制备后24 h S 组、C 组和D 组逃避潜伏期分别为(18.7±4.4)s、(60.2±6.2)s、(52.2±3.5)s,模型制备后48 h 逃避潜伏期分别为(16.4±5.3)s、(56.4±4.3)s、(44.5±6.7)s,与S 组相比,C 组和D 组逃避潜伏期延长(P<0.05),D 组高于C 组(P<0.05)。 见图4、图5。
3 讨论
本研究参照文献[12]采用改良Longa 大脑中动脉线栓法制造大鼠脑损伤模型,研究结果显示,实验组和干预组在脑损伤后各时间点2、6、12、24、48 h NF-κB、TNF-α 和IL-1β 均 较 对 照 组 显 著 升 高(P<0.05),说明大鼠脑损伤模型制备成功。 NF-κB是一种可诱导的、具有基因转录调节作用的蛋白质因子,能够启动编码IL-1β、IL-6 以及TNF-α 等全身性炎症反应综合症的细胞因子的基因转录,而NF-κB 的过度活化,能够引起多种炎症反应的相关基因表达上调,从而导致产生大量细胞因子和炎症递质[13-14]。 研究表明脑缺血再灌注损伤可激活NF-κB,还可引起大鼠脑神经细胞凋亡,使其与IKB 解体进入细胞核内,在转录水平上调控着炎症的表达,改变基因外炎性刺激的应答性和炎症细胞的反应性,也是合成炎性介质、启动其瀑布式级联反应的传导通路中心环节。 阻断NF-κB 的表达,能够使缺血再灌注大鼠模型心脏的梗死灶有明显的缩小,这也提示它能够控制缺血再灌大鼠的细胞死亡,通过激活NF-κB 从而引起大量炎性递质的释放,因此对于缺血再灌注损伤所引起的脑血管事件来说,可以通过阻断NF-κB 信号通路,从而改善结局。 研究发现α2-AR 激动剂右美托咪定具有神经保护的作用[15]。 本研究结果显示在各时间点假手术组的各项检测指标均无明显的变化,而脑外伤组在伤之后的5 个时间点检测指标NF-κB、TNF-α 及IL-1β 均明显高于相对应时间点假手术组的数据(P<0.05),并且呈现一个上升的趋势,而在干预组,检测指标NF-κB、TNF-α 及IL-1β 均比脑外伤组要低(P<0.05),这也说明α2-AR 激动剂能够降低脑损伤时NF-κB 的表达,并且抑制了炎性因子TNF-α 以及IL-1β 的释放,从而减少了神经元的损伤,也减轻了继发性的脑损伤的结局,通过大鼠的逃避潜伏期及大鼠神经功能缺陷评分结果,也可推测α2-AR 激动剂具有脑保护的作用。 有研究认为α2-AR 激动剂右美托咪定主要通过结合α2肾上腺素受体的亚型,从而起到神经保护的作用[16],其机制可能与其具有抗炎作用有关,即药物激动神经元突触前上的α2肾上腺素能受体,通过介导G 蛋白,从而抑制磷脂酶C 的活性以及钙离子的内流,以降低血浆儿茶酚胺的浓度,增强了副交感神经效应,抑制机体的炎性反应,进而发挥其抗凋亡作用,并改善血脑屏障的通透性,减少细胞内Ca2+内流,从而抗缺血再灌注损伤。 本研究中α2肾上腺素受体激动剂调低了NFκB 信号通路上的分子蛋白表达,减少了炎性因子TNF-α 和IL-1β 的释放,抑制炎性反应,减轻了神经功能的损伤状态,起到了神经保护作用,大鼠神经功能行为学结果也与之相吻合。
综上所述,α2-AR 激动剂能够调低大鼠缺血再灌注损伤之后NF-κB 的表达,抑制了机体炎性因子释放,具有脑保护作用。
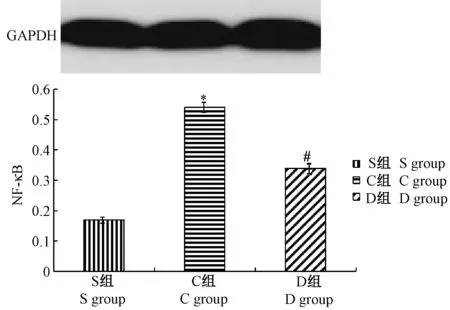
图1 大鼠脑组织NF-κB 目的蛋白与内参蛋白灰度值之比的结果比较Note.GAPDH, glyceraldehydes-phosphate dehydrogenase.Group S, Sham operation group.Group C, Ischemia-reperfusion control group.Group D, α2 adrenergic receptor agonist intervention group.Compared with group S,* P<0.05.Compared with group C,# P<0.05.Figure 1 Ratio of NF-κB expression to expression of an internal reference protein in rat brain tissue

图2 3 组大鼠各时点脑组织TNF-α 含量的比较Note.Group S, Sham operation group.Group C, Ischemiareperfusion control group.Group D, α2 adrenergic receptor agonist intervention group.Compared with group S,* P <0.05.Compared with group C,# P<0.05.The same as below.Figure 2 Comparison of TNF-α in brain tissue at each time point among three groups

图3 3 组大鼠各时点脑组织IL-1β 含量的比较(,pg/mg)Figure 3 Comparison of IL-1β expression in brain tissue at each time point among the three groups
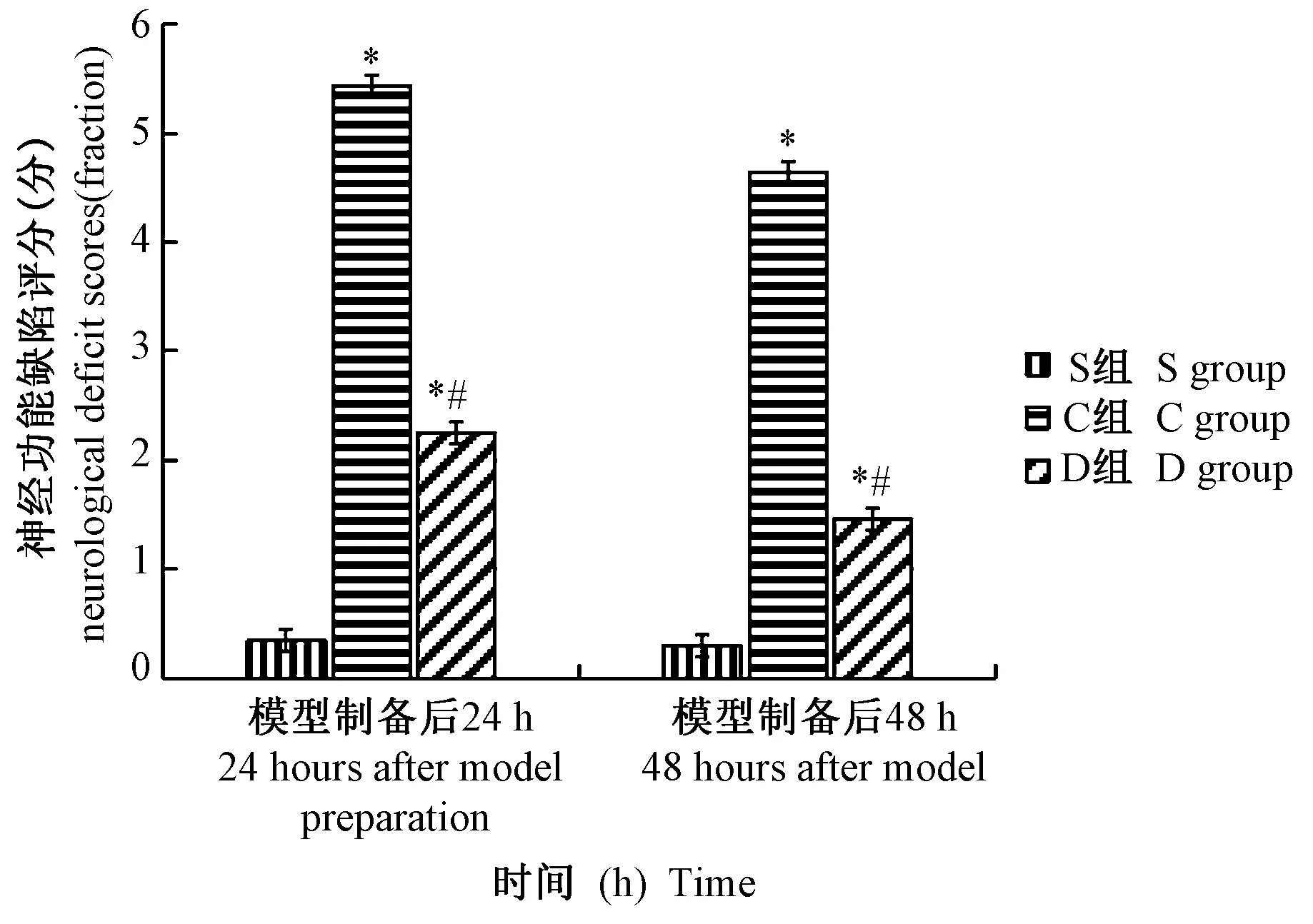
图4 3 组大鼠模型神经功能缺陷评分比较(,n=6)Figure 4 Comparison of neurological deficit scores among the three groups

图5 3 组大鼠模型逃避潜伏期比较( ,n=6)Figure 5 Comparison of escape latency among the three groups
