sCXCL16在成人原发免疫性血小板减少症中的表达水平及临床意义*
2020-08-13阳梅罗玉勤何川
阳梅 罗玉勤 何川
原发性免疫性血小板减少症(Primary immune thrombocytopenia,ITP)是一种自身免疫性疾病,其主要是由于机体自身反应性B细胞产生针对ITP膜糖蛋白的自身抗体,造成血小板的破坏和减少[1]。ITP的发病机制目前仍不完全清楚, B细胞分泌的免疫球蛋白G (IgG)抗血小板抗体被认为是ITP的初始机制[2],而细胞免疫功能障碍也在其中扮演着角色[3]。T细胞免疫的异常应答在ITP机制中也起着重要作用,包括血小板自身抗原反应性CTL的过度活化和增殖、调节T细胞数量和功能的异常、辅助性T细胞数量的异常等[4,5]。研究显示[6],Th1/Th2失衡在ITP患者中普遍存在,且其也是正常的免疫中重要组成部分。CXCL16是一种新发现的趋化因子,属于CXC超家族,其主要以跨模型(TM-CXCL16)和可溶性(sCXCL16)两种形式存在[7]。CXCL16唯一受体是CXCR6,主要存在于T淋巴细胞亚群、自然杀伤细胞、NK细胞和浆细胞。研究证实[8-10],sCXCL16在一些自身免疫性疾病中表现为升高,其可以转移并激活Th1,而T细胞毒性1型(Tc1)和NK细胞能够表达CXCR6。CXCL16作为一种新的免疫系统分子,可能在效应T细胞的迁移、APC和CD8 T细胞的相互作用、细胞免疫应答和炎症反应以及胸腺细胞的发育中发挥十分重要的作用。目前,有关CXCL16与ITP相关研究的报道相对较少,其在ITP患者中可能扮演的角色仍不完全清楚,本研究比较分析缓解期与活跃期ITP患者sCXCL16表达差异,旨在探讨sCXCL16的临床意义及其在ITP发病机制中的角色。
资料与方法
1 一般资料 选取2016年12月~2018年12月在我院门诊就诊的ITP患者,包括活跃期ITP患者46例,缓解期ITP患者42例,同时选取同期我院体检的正常人群40例作为正常对照组。活跃期ITP组:男24例,女22例,年龄18~65岁,平均年龄(37.33±2.09)岁,体质指数(BMI)(25.12±3.41)kg/m2,病程(5.24±1.02)年;缓解期ITP组:男22例,女20例,年龄20~63岁,平均年龄(37.55±2.31)岁,体质指数(24.83±3.52)kg/m2,病程(4.63±1.78)年;正常对照组:男20例,女20例,年龄18~65岁,平均年龄(38.12±3.07)岁,体质指数(24.54±3.20)kg/m2。ITP符合最近报道的诊断标准[11],将血小板计数<100×109/L伴有或不伴有出血表现的患者定义为活跃期ITP,最近没有出血表现的血小板计数> 100×109/L被定义为缓解期ITP。每位参与者签署知情同意书,并得到我院伦理委员会批准。三组受试者平均年龄、性别比、体质指数等一般临床资料未见明显差异(P>0.05),活跃期ITP组与缓解期ITP组病程未见明显差异(P>0.05),具有可比性,详见表1。
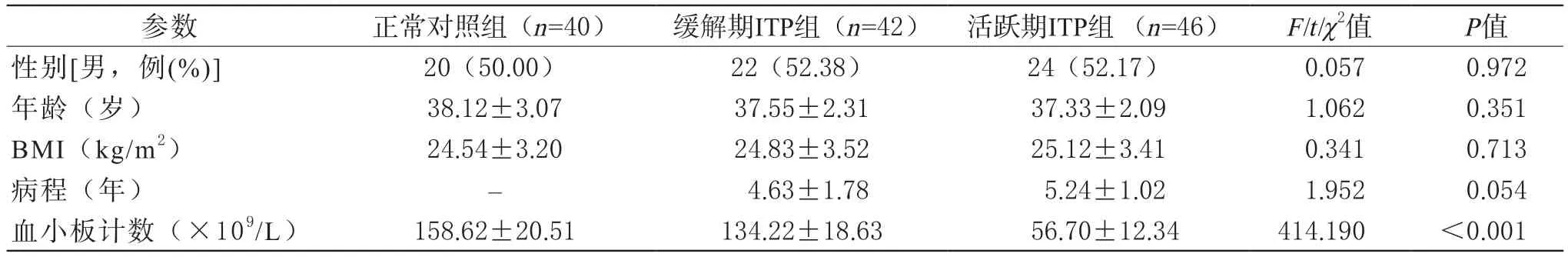
表1 ITP患者和正常对照的临床特点比较 [例(%), ±s]
2 仪器与试剂 人CXCL16酶联免疫检测试剂盒(型号:YB-E10054,R&D公司生产),酶标仪(Rain-bow型,瑞士Tecan公司生产),荧光实时定量PCR(RT-PCR)(型号:ABI-7500,Applied Biosystems公司生产)。
3 方法
3.1 血浆和外周血单个核细胞的收集:用EDTA抗凝血剂离心收集真空采血管中的外周血并收集血浆,然后将它们储存在-80℃下等待下一步的检测。按Ficoll(1.077 g /mL)密度梯度离心法分离外周血单个核细胞。
3.2 趋化因子受体CXCR6检测:采用流式细胞术,4℃避光抗体染色分离的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)15分钟,随后通过磷酸盐缓冲溶液(pH7.4,包括1%牛血清白蛋白)清洗额外的抗体,并使用300uL PBS重悬细胞沉淀,通过APC结合的抗CD8、FITC结合的抗CD4、PE结合的抗CXCR6和同种型对照检测淋巴细胞亚群CXCR6的比例。
3.3 血浆细胞因子sCXCL16检测:用酶联免疫吸附试验(ELISA)试剂盒检测血浆sCXCL16,可检测限为4 pg/mL。用洗液清洗酶标板孔,彻底去除每孔剩余的液体,充分洗涤孔2次。空白孔内加入100 µL样本稀释液,样品孔内加入20 µL样品血浆,再加80 µL样品稀释液;所有的孔内加入50 µL已稀释的生物素结合液,用封膜封孔,25℃的温箱孵育3小时;撕去封膜,甩掉孔内液体,每孔加400 µL洗液,洗板4次;每孔加入100 µL己稀释的链霉亲和素-辣根过氧化酶溶液,再次用膜封板,在400 r/min的微型版震荡器上进行25℃孵育1小时;重复上次洗板过程;所有孔内均加入100 µlTMB显色液,25℃避光孵育10分钟;每孔快速加入100 µL终止液,混匀,迅速用酶标仪测定450 nm波长处的OD值。
3.4 CXCL16及CXCR6 mRNA水平检测:TRizol试剂盒提取淋巴细胞亚群的RNA,再用PrimeScript TM RT-PCR试剂盒(日本Takara公司)将其转化成cDNA,使用ABI-7500荧光实时定量PCR仪进行PCR扩增及检测CXCL16 mRNA水平。根据GenBank序列设计引物:CXCL16正向(5'-3'):GCGTCACTGGAAGTTGTTAT;反向(3'-5'):GCTCATCAATTCCTGAACCC;CXCR6正向(5'-3'):GAAGTTCATCCGCAGCAC;反向(3'-5'):GGCATAGAGCACAGGGTT;β-肌动蛋白正向(5'-3'):CGTGGGCCGCCCTAGGCACC;反向(3'-5'):TTGGCCTTAGGGTTCAGGGGGG。CXCL16、CXCR6及内参β-actin的扩增产物长度分别为112 bp、106 bp和115 bp。RT-PCR反应体系:95℃预变性10分钟,95℃变性15秒,60℃退火30秒,最后72℃延伸30秒,循环40次。
4 统计学处理 采用SPSS18.0统计软件进行数据处理,定量资料符合正态分布的采用( ±s)表示,多组间比较采用单因素方差分析,多重比较采用SNK-q检验;计数资料采用“例(%)”表示,行卡方检验;血浆sCXCL16与病程、血小板(PLT)之间的相关性采用Pearson相关分析,血浆sCXCL16与有无出血之间的相关性应用点二列相关(Pearson相关算法);P<0.05为差异具有统计学意义。
结 果
1 各组血浆sCXCL16和血液PLT的含量水平 活跃期ITP患者血浆sCXCL16含量明显高于正常对照组(q=15.542,P<0.01)和缓解期ITP患者(q=15.234,P<0.01),而缓解期ITP患者血浆sCXCL16含量与正常对照组比较,无统计学差异(P>0.05);活跃期ITP患者血液PLT含量明显低于正常对照组(q=22.729,P<0.01)和缓解期ITP患者(q=31.425,P<0.01),而缓解期ITP患者血液PLT含量水平与正常对照组比较,无统计学差异(P>0.05)。见表2。

表2 不同组别血浆sCXCL16和血液PLT含量比较
2 各组淋巴细胞亚群中CXCR6的比例 与正常对照组、缓解期ITP患者相比,活跃期ITP患者CXCR6在CD4+、CD8+T细胞及B细胞中的比例均明显增加(P均<0.01),而正常对照组CXCR6在CD4+T细胞、CD8+T细胞、B细胞的比例与缓解期ITP患者相比,无统计学差异(P>0.05)。见表3。
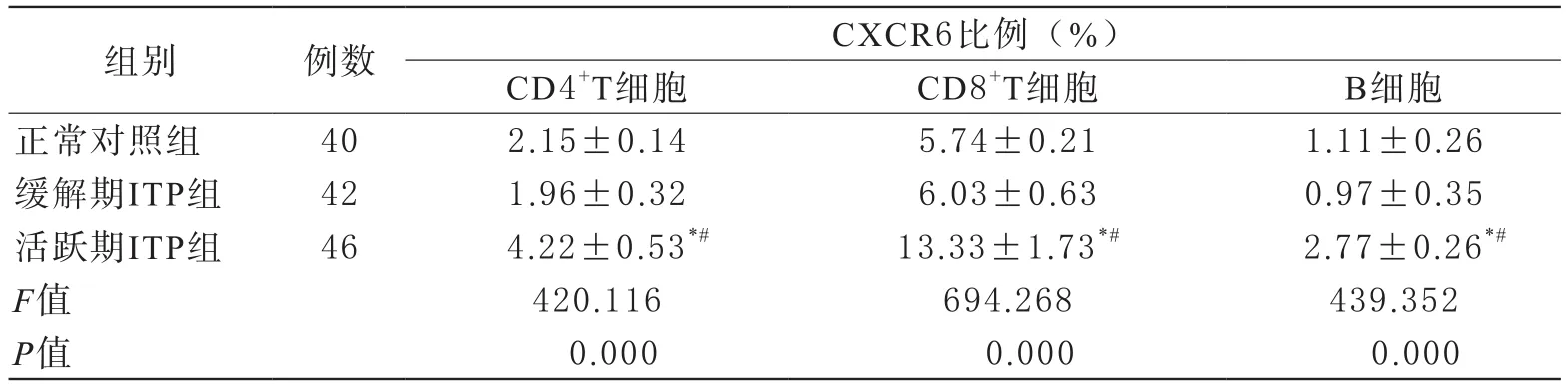
表3 不同组别CXCR6在淋巴细胞亚群中的比例比较
3 外周血单个核细胞CXCL16和CXCR6的mRNA表达水平 相较于正常对照组、缓解期ITP组,活跃期ITP患者外周血单个核细胞CXCL16 mRNA表达较高(q=20.431、28.562,P均<0.01),活跃期ITP患者外周血单个核细胞CXCR6 mRNA表达也明显升高(q=12.342、10.842,P均<0.01)。而正常对照组外周血单个核细胞CXCL16 mRNA、CXCR6 mRNA表达水平与缓解期ITP患者相比,无统计学差异(P>0.05)。见表4。
4 各组血浆sCXCL16与病程、有无出血及PLT之间的相关性 活跃期ITP患者血浆sCXCL16与病程之间无相关性(r=-0.032,P=0.894),与PLT含量之间也无相关性(r=0.034,P=0.883),而活跃期ITP患者血浆sCXCL16与有无出血之间存在正相关(r=0.532,P=0.025);缓解期ITP患者及正常对照组血浆sCXCL16与病程、有无出血及PLT无相关性(P>0.05)。见表5。

表4 不同组别CXCL16和CXCR6的mRNA表达水平比较
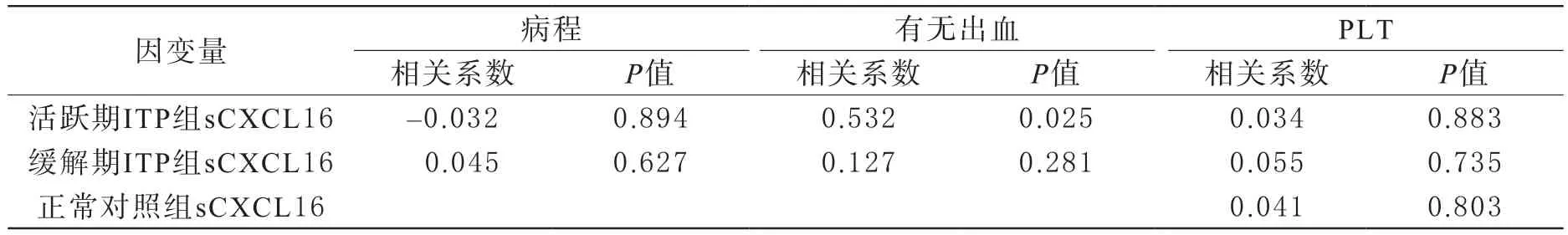
表5 血浆sCXCL16与病程、有无出血、PLT间的相关分析
讨 论
ITP是一种自身免疫性疾病,主要由自身抗体介导引起血小板被破坏和血小板的生成被抑制,从而引起血小板的数量减少[12]。ITP的发病机制尚不完全明确,包括自身反应性B淋巴细胞分泌抗血小板自身抗体和细胞免疫紊乱[13],例如Th1/Th2的极化、T细胞介导的细胞毒作用及调节性T细胞的功能受损。对血小板在ITP自身免疫机制方面的进一步研究将有助于进一步明确其作用机制和角色。CXCL16可以吸引和激活炎症组织中的Th1细胞和Tc1细胞,并受Th1极化细胞因子的影响[14]。sCXCL16被更多的Th1细胞因子刺激后上调,而sCXCL16可能吸引更多的Th1细胞。研究表明[15],当环状血管细胞暴露于IL-1β时,CXCL16表达上调。此外,使用英夫利昔抗TNF-α抗体治疗后,类风湿性关节炎患者的血浆CXCL16水平降低。研究报道[16],IFN-γ/IL-4的血浆比率反映了ITP中Th1/Th2免疫失衡,我们进一步评估了这两种细胞因子,发现活动性ITP患者血浆中循环IFN-γ增加和循环IL-4减少,这与之前的研究一致。
本研究显示,血浆sCXCL16浓度在活跃期ITP患者中显著高于正常对照组,同时血浆sCXCL16表达水平与血小板计数呈负相关,因此,我们推测血浆sCXCL16可能参与了ITP的致病机制并反映ITP的疾病活动。据报道,CXCL16与CXCR6通过相互作用参与癌症的转移、进展以及自身免疫性疾病[17]。sCXCL16能将CXCR6阳性反应者或记忆T细胞募集到炎症位点,考虑到CXCR6辅助sCXCL16的必要性,我们想了解sCXCL16升高后受体是否增强。我们首先检测到淋巴细胞亚群上CXCR6的比例,发现CD4+T细胞、CD8+T细胞和B细胞中CXCR6在活跃期ITP患者中比例更高。然后我们在mRNA水平上测定CXCL16和CXCR6的表达。同样发现CXCL16和CXCR6 mRNA水平增加,同时sCXCL16与CXCR6 mRNA水平呈正相关。上述结果表明CXCL16 mRNA和血浆转运蛋白显著增加可能导致淋巴细胞表达更高并募集更多的CXCR6,我们推测CXCL16-CXCR6通路在ITP中可能有一定的作用。
本研究显示,活跃期血浆sCXCL16浓度与有无出血之间存在较强的正相关关系,这进一步佐证了之前的研究结论,即血浆sCXCL16含量水平能反映疾病的活动性,也为监测ITP疾病活动性的指标提供了证据。研究证实[18],CXCL16主要激活ERK-MAP激酶信号通路,此外,PI3K-Akt信号通路同样被CXCL16激活。此外,一项研究表明CXCL16可以促进ERK,p38和Akt的磷酸化,这可能导致血管生成[19]。在慢性胃肠炎患者中,p38肌腺苷磷酸激酶活性增强并调节TNF-α的分泌与活化,同时抑制活化的p38并诱导炎症改善。此外,sCXCL16对CXCR6阳性T细胞表现出运动性趋化,而抗CXCL16则干扰了这种相互关系并抑制了慢性胃肠炎中T细胞的活化。然而,尚不清楚sCXCL16信号通路如何工作,以及sCXCL16在ITP中的特殊功能。
ITP的病程长短不一,且病程的长短与疾病的预后有着一定的关系[20],但本研究中血浆sCXCL16与病程并无相关关系,可能是因为活动期ITP患者的病程本来相对较短。血浆sCXCL16浓度与PLT之间无相关关系,据此我们认为血小板的数量可能不能完全反映出血的严重程度,而出血的有无更能直接反映疾病的严重性。
综上,我们发现血浆sCXCL16水平与活跃期ITP患者有无出血呈正相关,此外,sCXCL16与Th1细胞因子分布相关,而有效治疗可下调sCXCL16水平和CXCR6表达水平,提示血浆sCXCL16可能通过调控CXCR6在淋巴细胞亚群中的比例,从而参与ITP的发病机制。
利益冲突所有作者均声明不存在利益冲突
