灭幽汤对幽门螺杆菌相关性胃炎脾胃湿热证模型小鼠FoxO3a、Bim和FasL的影响
2020-08-12徐寅张彧陈末周义方曾蓉郭璇喻斌王小娟
徐寅 张彧 陈末 周义方 曾蓉 郭璇 喻斌 王小娟


〔摘要〕 目的 觀察灭幽汤对幽门螺杆菌相关性胃炎(Hp associated gastritis, HAG)脾胃湿热证模型小鼠FoxO3a、Bim和FasL的影响,探讨其对HAG脾胃湿热证的治疗机制。方法 将60只SPF级BALB/c小鼠随机分为模型组、胃四联组、低剂量灭幽汤组(灭幽低组)、中剂量灭幽汤组(灭幽中组)、高剂量灭幽汤组(灭幽高组)、正常组,共6组,每组10只。除正常组外其余5组均采用复合病因(肥甘食物+幽门螺杆菌+湿热环境)造模法建立HAG脾胃湿热证小鼠模型,造模成功后,各组予以相应干预,正常组及模型组予以蒸馏水灌胃,连续14 d。TUNEL法检测胃黏膜细胞凋亡情况,Western blot、RT-PCR分别检测胃黏膜组织FoxO3a、FasL和Bim蛋白表达及基因含量。结果 TUNEL法检测胃黏膜细胞凋亡情况:模型组较正常组细胞凋亡情况明显增多,除灭幽低组外其余治疗组细胞凋亡情况较模型组明显减少。与正常组比较,模型组FoxO3a、FasL、Bim蛋白及mRNA表达升高,差异有显著统计学意义(P<0.01);与模型组比较,灭幽高组、灭幽中组、胃四联组FoxO3a、FasL、Bim蛋白及mRNA表达降低,差异有显著统计学意义(P<0.01)。结论 中、高剂量灭幽汤能有效治疗HAG脾胃湿热证,其机制可能是灭幽汤通过调控FoxO3a表达,下调凋亡因子FasL和Bim含量来抑制胃上皮细胞凋亡而实现。
〔关键词〕 幽门螺杆菌相关性胃炎;灭幽汤;脾胃湿热证;细胞凋亡;FoxO3a;FasL;Bim
〔中图分类号〕R256.3 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.07.010
〔Abstract〕 Objective To observe the effects of Mieyou Decoction on FoxO3a, Bim and FasL in mice with helicobacter pylori (HP)-associated gastritis (HAG) of spleen-stomach damp-heat syndrome, and to explore its therapeutic mechanism on HAG of spleen-stomach damp-heat syndrome. Methods A total of 60 SPF-level BALB/c mice were randomly divided into a model group, a stomach quadruple group, a high-dose Mieyou Decoction group (Mieyou high group), and a low-dose Mieyou Decoction group (Mieyou low group), a middle-dose Mieyou Decoction group (Mieyou middle group), and a normal group, a total of 6 groups, with 10 mice in each group. The mouse model of HAG of spleen-stomach damp-heat syndrome was established by the composite cause (fat food + helicobacter pylori + damp heat environment) for the other 5 groups except the normal group. After successful modeling, the mice were given the corresponding intervention. The normal group and the model group were given distilled water by gavage, for consecutive 14 days. The apoptosis of gastric mucosa was detected by TUNEL method. The expressions and gene content of FoxO3a, FasL and Bim proteins in gastric mucosa were detected by Western blot and RT-PCR. Results The apoptosis rate of gastric mucosa was detected by TUNEL method. The apoptotic cells in the model group were significantly increased compared with the normal group. The apoptotic cells in the other treatment groups were significantly reduced compared with the model group, except the Mieyou low group. The expression of FoxO3a, FasL and Bim protein and mRNA in the model group was significantly increased than that in the normal group (P<0.01). Compared with the model group, the expression of FoxO3a, FasL and Bim protein and mRNA in the Mieyou high group, the Mieyou middle group and the stomach quadruple group were decreased when compared with the model group, and the difference was statistically significant (P<0.01). Conclusion The middle and high dose Mieyou Decoction can effectively treat HAG of spleen-stomach damp-heat syndrome. The mechanism may be that Mieyou Decoction can inhibit the apoptosis of gastric epithelial cells by regulating the expression of FoxO3a and down-regulating the content of apoptosis factors FasL and Bim.
〔Keywords〕 HP associated gastritis; Mieyou Decoction; spleen-stomach damp-heat syndrome; apoptosis; FoxO3a; FasL; Bim
幽门螺杆菌(Helicobacter pylori, Hp)是定植于胃黏膜黏液层的一种慢性致病菌,我国的感染率约为63.4%[1],Hp产生的毒素及部分酶能破坏胃黏膜屏障,从而影响多种微量元素及营养素的吸收,长期感染Hp后,胃黏膜可进一步萎缩和化生,发展为胃黏膜不典型增生(上皮内瘤变),甚则转化为胃癌。感染Hp后发生的胃黏膜炎性改变称为幽门螺杆菌相关性胃炎(Hp associated gastritis, HAG),从Hp感染引起非萎缩性/萎缩性胃炎、肠腺化生/异型增生(上皮内瘤变)至胃癌的发病多阶段过程已被普遍认可。本课题组发现HAG脾胃湿热证与细胞凋亡有密切关联[2],在细胞周期调控中起重要作用的Fox转录因子的O亚家族(forkhead transcription factorsofthe O class, FoxOs)可激活或抑制多种靶基因[3],如介导细胞凋亡的Bim[4]和FasL基因[5]。本课题组前期研究已证实,灭幽汤可通过调控TLR/NF-κB 炎症信号通路抑制HAG 脾胃湿热证模型小鼠胃黏膜炎症反应[6-8],本实验拟通过研究FoxO3a、Bim、FasL的变化,进一步探讨灭幽汤治疗HAG脾胃湿热证的作用机制,以期为临床治疗HAG脾胃湿热证提供实验依据。
1 材料
1.1 动物与饲料
60只SPF级BALB/c小鼠,雌雄各半,体质量(17±1) g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002,动物质量合格证号:43004700043028。普通饲料购自湖南斯莱克景达实验动物有限公司。高脂饲料由普通饲料按等比例加入蜂蜜和猪油制得。
1.2 Hp菌株
幽门螺杆菌:悉尼标准菌株(Sydney strain I, SSI),其中含有CagA+和VacA+,浓度为1×109 CFU/mL,由湖南中医药大学基础医学院病原免疫学教研室提供。
1.3 试药
灭幽汤:黄芩15 g,蒲公英20 g,三七6 g,白及10 g,青皮10 g,陈皮10 g,乌贼骨15 g,饮片购自湖南中医药大学第一附属医院门诊中药房。以上药物用500 mL蒸馏水泡30 min后,武火熬至沸腾后改文火,继续熬20 min,取汁另置,煎煮3次,合并煎液调整浓度至0.62 g/mL、1.24 g/mL和2.48 g/mL为灭幽汤低、中、高剂量。
胃四联:丽珠维三联(枸橼酸铋钾片110 mg/片;克拉霉素片0.25 g/片;替硝唑片0.5 g/片,丽珠集团丽珠制药厂,货号:170701);泮托拉唑肠溶胶囊40 mg/粒,杭州中美华东制药有限公司,货号:170950B。
1.4 主要实验试剂
兔抗FoxO3a抗体(货号10849-1-AP)购自Prote?鄄intech Group公司;兔抗Fasl抗体(货号ab15285)、Bim抗体(货号ab7888)购自abcam公司;逆转录试剂盒、DNA Marke购自北京康为世纪公司;EDTA、Tris、DEPC、APS、SDS、Tween-20、TEMED购自Sigma-Aldrich公司;Trizol购自Invitrogen公司;UltraSYBR Mixture购自北京康为世纪公司;引物购自上海生工公司;快速尿素酶检测试剂盒购自上海国药生物公司;TUNEL试剂盒购自江苏凯基生物公司。在NCB上搜索目的基因的序列,FOXO3a的引物序列是F:CCGCCAGCCAGTCTATGCAA,R:AACCCGTCAGCATCCATGAGT,引物长度190 bp。FasL引物序列为F:CTAATGTTTTCTGAGCCGACC,R:ACAGACATCATTGCACTGG,引物長度109 bp。Bim引物序列为F:TCCCTACAGACAGAACCGCAAG,R:ATCAGTTGTACCAGGCATCACC,引物长度175 bp。
1.5 主要仪器
TS-92水浴摇床(江苏其林贝尔公司);PIKO REAL 96荧光定量RCP仪、SPL0960荧光PCR板(美国Thermo Fisher Scientific公司);164-5050电泳仪(美国Bio-rad公司);BA210T显微镜(厦门Motic公司);YD-315切片机(浙江益迪试验器材);TGL-18R台式冷冻离心机(德国eppendorf公司)。
2 方法
2.1 造模
小鼠适应性喂养7 d后,按随机数字表法分为正常组10只与造模组50只。造模组按参考文献[9]复合病因(肥甘食物+湿热环境+Hp菌液)方法建立HAG脾胃湿热证小鼠模型。从分组后第1天开始,造模组给予高脂饲料自由饮食,第13天开始放入湿热箱中,温度:(32±2) ℃,相对湿度:95%,每天放入6 h,第18天开始感染Hp菌液(每只1×109 CFU/mL浓度,0.2 mL/d),隔日感染1次,共5次,感染后定植2周,感染及定植Hp期间继续给予高脂饲料及湿热箱饲养。Hp感染方法如下:在用Hp菌液灌胃前,所有BALB/c小鼠先禁食24 h,模型组小鼠灌注1×109 CFU/mL浓度的Hp菌液0.2 mL/只,灌胃后4 h给予食物和水。期间正常组同步给予普通饮食,灌胃等体积生理盐水,注意正常组与造模组食水分开。第37天正常组及造模组随机选取小鼠各2只、8只,处死后取胃组织采用快速尿素酶试验及HE染色检测模型。
造模过程中,观察动物症状(精神状态、饮食情况,大便性状)、饮水、食量、体质量、肛温、毛色及毛的顺滑等情况。
模型成功的标准:小鼠精神不振,反应迟钝,毛发无光泽,喜聚集而少动,体质量减轻,肛温升高,小便黄,大便稀软;快速尿素酶试验检测胃窦黏膜Hp种植情况,结果阳性提示造模成功。HE染色观察胃黏膜组织病理学改变及炎症程度。
2.2 分组及干预
造模成功后,造模组按随机数字表法分为5组,每组8只。即模型组、高剂量灭幽汤组(灭幽高组)、中剂量灭幽汤组(灭幽中组)、低剂量灭幽汤组(灭幽低组)、胃四联组。第38天开始灌胃给药。给药剂量参考成人平均体质量60 kg,根据临床用药剂量与动物用量的比例换算动物实验的中药剂量,灭幽汤干预低、中、高剂量分别为6.2、12.4、24.8 g/kg),每日灌胃1次。胃四联组予以丽珠维三联(成人每日剂量为枸橼酸铋钾片0.3 g/片×4片+替硝唑片0.5 g/片×2片+克拉霉素片0.25 g/片×2片)+泮托拉唑钠肠溶胶囊(成人每日剂量为80 mg)。将各药物研碎混合溶于蒸馏水中,给药剂量为280.6 mg/kg,每只给予药液量0.1 mL/10 g,每日灌胃1次。正常组和模型组小鼠予以等容量蒸馏水。干预14 d。
2.3 取材
脱颈处死小鼠,剖腹取全胃,沿胃大弯剪开,4 ℃预冷生理盐水冲洗干净后摘取胃窦、胃体的组织置于4%多聚甲醛保存,行HE染色;另将剩余胃组织一分为二,一分行Western blot,另一分行RT-PCR,保存于-20 ℃冰箱中。
2.4 指标检测
2.4.1 小鼠的症状及一般生理情况 观察造模、给药后小鼠毛色、活动度、饮食、饮水、体质量、肛温的变化情况。
2.4.2 快速尿素酶试验检测Hp感染 将新鲜小鼠胃黏膜组织放入快速尿素酶检测反应孔,15~30 min内观察反应孔颜色变化,试劑由黄变红为阳性,提示小鼠胃黏膜组织存在Hp感染。
2.4.3 小鼠胃黏膜组织病理学观察 将小鼠胃窦、胃体组织行HE染色后光镜下观察。60 ℃烤片12 h;切片脱蜡:将切片置于二甲苯中1 h。然后依次在100%、95%、85%、75%乙醇,每次放置5 min。浸洗后改用苏木素染色,冲洗,PBS处理;伊红染1 min,冲洗;梯度酒精脱水,直接把片子烤干。置于二甲苯中20 min,最后封片,光镜下观察。
2.4.4 TUNEL法检测胃黏膜细胞凋亡情况 切片常规脱蜡,60 ℃烤1 h后置于二甲苯中脱蜡2次,乙醇水合后在封闭前后漂洗;放入缓冲液中进行加热至沸腾,再冷却至室温。冷却后PBS洗涤,生物素封闭A液孵育20 min。切片浸入PBS漂洗,再加入封闭B液孵育20 min。切片浸入PBS漂洗,进行荧光标记:配制TdT酶反应液加入样本中放入温盒,将配制好的Streptavidin-HRP标记液加入再次漂洗结束的样本后,再次反应漂洗后进行显色及复染,染色后分化5 s,冲洗干净。无水乙醇及二甲苯浸洗后晾干封片,光镜观察,细胞核染成棕(黄)色或褐色染色为阳性细胞。
2.4.5 Western blot检测FoxO3a、FasL和Bim的蛋白表达 分别提取各组小鼠肺组织总蛋白。将10%~12%分离胶加入TEMED,晃均封胶。凝胶后倒去异丙醇,吸干后进行电泳及转膜。完成后,用1×TBST冲洗膜5 min,再用丽春红染色,检测蛋白转膜率。再将膜浸入用脱脂奶粉中室温封存1.5 h再分别与FoxO3a、FasL和Bim的一抗(兔抗)结合。结束后洗膜再与二抗结合90 min,漂洗。ECL法检测NC膜进行图像分析,用Image-Pro Plus 6.0测量各蛋白条带的灰度值,以与内参蛋白(β-actin)灰度值的百分比表示结果。
2.4.6 RT-PCR法检测FoxO3a、FasL和Bim基因相对表达量 提取小鼠胃组织的RNA,在定量PCR仪中进行扩增。每个样本每个指标3个孔,共30 ?滋L体系,每孔10 ?滋L。定量PCR扩增程序:依次95 ℃10 min,95 ℃ 5 s,60 ℃ 50 s,共40个循环。采用参照基因2-△△Ct法计算目的基因mRNA表达水平的相对量,各基因的表达水平使用相对定量法计算。
2.5 统计学处理
采用SPSS 25.0统计软件进行分析,实验数据以“x±s”表示,首先对各组数据进行正态性及方差齐性检验,若数据满足正态分布、方差齐性,采用单因素方差分析,同时用LSD检验进行组间比较。若数据不满足正态分布,则用Kruskal-Wallis H检验。P<0.05表示差异具有统计学意义,P<0.01表示差异具有显著统计学意义。
3 结果
3.1 小鼠一般状态观察
正常组小鼠食欲、饮水正常,精神状态良好,皮毛光泽顺滑,二便正常,肛温保持恒定,体质量渐增;造模组小鼠在模型建立过程中逐渐出现懒动,食欲下降,饮水减少,皮毛松弛无光泽,小便黄,大便稀软等表现。依据《脾胃湿热证中医诊疗专家共识意见(2017)》[7]中脾胃湿热证的辨证依据,出现食少纳呆、少饮、大便溏、肢体困重等均为脾胃湿热证的表现。造模结束后发现,造模组小鼠均符合脾胃湿热证的上述行为学变化。
3.2 Hp种植情况
快速尿素酶试验结果显示:正常组为阴性,造模组小鼠试剂由黄色变为红色,试验结果都为阳性,提示Hp感染成功。
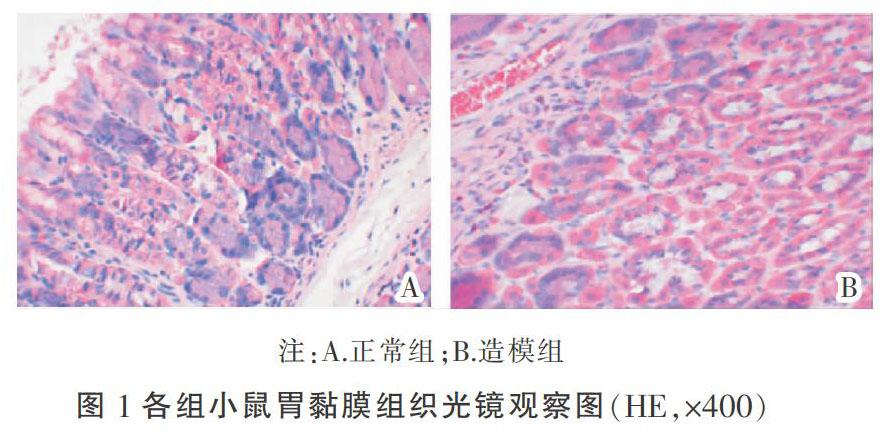
HE染色结果显示:正常组小鼠胃黏膜组织光滑,腺体排列较整齐,无明显充血肿胀。造模组小鼠胃黏膜组织可见嗜酸性、中性粒、淋巴细胞浸润,腺体杂乱,充血,且固有层内亦可见淋巴滤泡、嗜酸性粒、中性粒细胞浸润,符合慢性非萎缩性胃炎的表现。见图1。
根据模型小鼠一般状态观察、快速尿素酶试验及HE染色结果,可判定HAG脾胃湿热证小鼠模型建立成功。
3.3 TUNEL法检测各组小鼠胃黏膜细胞凋亡的情况
光镜下细胞核染成棕(黄)色或褐色为TUNEL阳性染色。由图2可知,正常组处于凋亡期的细胞较少,细胞凋亡情况最低;模型组细胞凋亡情况最严重;灭幽低组凋亡情况较模型组无明显变化;灭幽中组、灭幽高组、胃四联组细胞凋亡情况高于正常组,低于模型组。见图2。
3.4 各组小鼠胃黏膜组织FoxO3a、FasL和Bim蛋白表达的变化比较
模型组FoxO3a、FasL和Bim蛋白表达升高,与正常组比较差异有显著统计学意义(P<0.01);与模型组比较,灭幽高组、灭幽中组、胃四联组FoxO3a、FasL和Bim蛋白表达降低,差异有显著统计学意义(P<0.01),灭幽低组FoxO3a、FasL和Bim蛋白表达与模型组比较有下降趋势,但两组比较差异无统计学意义(P>0.05)。与胃四联组比较,灭幽高组、灭幽中组FoxO3a、FasL和Bim蛋白表达升高,差异有显著统计学意义(P<0.01);灭幽高组FoxO3a、FasL和Bim蛋白表达降低,与灭幽中组比较差异无统计学意义(P>0.05),与灭幽低组比较差异有显著性差异(P<0.01)。见图3-4。
3.5 各组小鼠胃黏膜组织FoxO3a、FasL和Bim mRNA相对表达量的比较
模型组FoxO3a、FasL和Bim mRNA相对表达量增加,与正常组比较差异有显著统计学意义(P<0.01);与模型组比较,灭幽高组、灭幽中组、胃四联组FoxO3a、FasL和Bim mRNA相对表达量降低,差异有显著统计学意义(P<0.01),而灭幽低组FoxO3a、FasL和Bim mRNA相对表达量与模型组比较有下降趋势,但两组比较差异无统计学意义(P>0.05)。与胃四联组比较,灭幽高组、灭幽中组FoxO3a、FasL和Bim mRNA相对表达量增加,差异有显著统計学意义(P<0.01);与灭幽低组比较,灭幽高组FoxO3a、FasL和Bim mRNA相对表达量降低,差异有显著统计学意义(P<0.01)。见表1。
4 讨论
Hp感染直接触发细胞凋亡并通过炎症损伤诱导胃黏膜细胞凋亡被认为是HAG胃黏膜损伤的发病机制。FoxOs在机体不同状态的细胞凋亡过程中都发挥了调控作用。FoxOs既可能发挥促进细胞凋亡的作用,又可能抑制细胞凋亡的发生,这种看似矛盾的调控作用与机体功能状态、细胞种类和FoxOs的激活方式等都密切相关。Bim能与抗凋亡因子Bcl-2、Bcl-xL及Mcl-2等共同作用从而诱导细胞凋亡。FoxO3a调节细胞凋亡通过直接诱导前凋亡基因Bim的表达和转录[10-11]。有学者研究BaF3/BcrR-ABL细胞系及乳腺癌细胞MCF-7,发现FoxO3a可在转录水平上直接对Bim的表达进行调控,且证实了在Bim启动子上有FoxO3a、Mab及RUNX3的结合位点,进而启动转录,促进细胞的凋亡[12]。在胃癌的研究中,科学家已经证实FoxO3a与RUNX3共同激活Bim基因,诱导胃癌细胞的凋亡[13]。FoxOs亦可以提高FasL和TRAIL基因的转录来调控细胞凋亡[14]。沉默FoxO3a可抑制gAcrp介导的Caspase-3/7及FasL的表达使细胞凋亡减少[15]。当FasL在胃炎组织淋巴细胞表面表达[16],Fas相关死亡结构域蛋白会使胞质中Caspase-8募集Fas,使其受体活化,从而启动细胞凋亡[17]。研究表明[18],Hp诱导的细胞凋亡与Fas受体相关,并发现IL-8可以通过上调Fas的表达来提高细胞凋亡。本实验模型组FoxO3a、FasL、Bim的蛋白表达及基因含量明显高于正常组,说明Hp可能诱导FoxO3a表达上调FasL、Bim的含量,从而诱导胃黏膜细胞凋亡。
《湿热病篇》有“太阴内伤,湿饮停聚,客邪再至,内外相引,邪正相争,故病湿热”“湿热病属阳明太阴经者居多”等论述,结合现代中医证候研究发现[19],在Hp感染患者证型中脾胃湿热证居多,所以本研究团队认为Hp可归属湿热之邪。清热祛湿法为治疗HAG之大法,加之“太阴内伤,湿饮停聚”,也只有行气和胃才能畅达其气机,恢复脾升胃降的生理功能,故HAG治法当首选清热祛湿、行气和胃为本。灭幽汤中黄芩清上、中二焦之湿热为君药,陈皮、蒲公英共奏清热健脾祛湿之效为臣药,青皮、三七、白及、乌贼骨共为佐药,发挥行气活血、制酸止痛之功。
本实验结果表明:灭幽中组、灭幽高组及胃四联组小鼠在给药治疗后,较模型组小鼠FoxO3a、FasL和Bim降低,趋向正常组,提示灭幽中、高组能通过FoxO3a调控凋亡因子FasL和Bim来抑制细胞凋亡,从而有效治疗HAG脾胃湿热证;灭幽低组与模型组比较,指标差异无统计学意义,灭幽中、高组组间比较无明显差异;灭幽汤低、中、高剂量采用动物等效量的0.5、1、2倍量,说明灭幽汤发挥治疗作用的前提是在一定浓度下,但亦不是浓度越高效果越好,与临床等效剂量即中剂量为最优选择。
参考文献
[1] 刘文忠.“幽门螺杆菌胃炎京都全球共识”解读[J].胃肠病学,2015,20(8):449-456.
[2] 王小娟,郭建生,李 倩,等.灭幽汤对湿热型胃炎伴幽门螺杆菌感染胃黏膜上皮细胞凋亡的影响[J].中国中西医结合消化杂志,2007,15(4):258-259.
[3] CHERDANTSEVA L A, POTAPOVA O V, SHARKOVA T V, et al. Association of Helicobacter pylori and iNOS production by macrophages and lymphocytes in the gastric mucosa in chronic gastritis[J]. Journal Immunology Research, 2014, 76(2): 5-14.
[4] WANG J, LIU S, YIN Y, et al. FoxO3-mediated up-regulation of Bim contributes to rhein-induced cancer cell apoptosis[J]. Apoptosis, 2015, 20(3): 399-409
[5] MARFE G, TAFANI M, FIORITO F, et al. Involvement of FOXO transcription factors, TRAIL-FasL/Fas, and sirtuin proteins family in canine coronavirus type II-induced apoptosis[J]. PLoS ONE, 2011, 6(11): e27313.
[6] 王小娟,尹 姣,郭建生,等.灭幽汤对幽门螺杆菌相关性胃炎小鼠胃黏膜组织TLR2、NF-κBp65的影响[J].湖南中医药大学学报,2014,34(7):18-22,65.
[7] 施花锦,王小娟,伍参荣,等.灭幽汤对幽门螺杆菌感染性胃炎小鼠胃组织IKKβ表达的影响[J].湖南中医药大学学报,2011,31(1):33-35.
[8] 王小娟,施花锦,郭建生,等.灭幽汤对小鼠幽门螺杆菌感染性胃炎NF-κB表达的影响[J].湖南中医药大学学报,2010,30(3):12-13,47.
[9] 陈 末,喻 斌,徐 寅,等.灭幽汤对幽门螺杆菌相关性胃炎脾胃湿热证模型小鼠NLRP3、caspase-1和mTOR蛋白的影响[J].河南中医,2019,39(3):354-358.
[10] LUO H, YANG Y, DUAN J, et al. PTEN-regulated AKT/FoxO3a/Bim signaling contributes to reactive oxygen species-mediated apoptosis in selenite-treated colorectal cancer cells[J]. Cell Death & Discase, 2013, 4(2): e481.
[11] LIUY, ZHANGW F, WUX L, et al. Foxo3a-dependent Bim transcription protects mice from a high fat diet via inhibition of activation of the NLRP3 inflammasome by facilitating autophagy flux in kupffer cells[J]. Oncotarget, 2017, 23, 8(21): 34258-34267.
[12] ZHOU Z Q, WANG T, PAN L M, et al. FoxO4 is the main forkhead transcriptional factor localized in the gastrointestinal tracts of pigs[J]. Journal of Zhejiang University-Science B, 2007, 8(1):39-44.
[13] YAMAMURA Y, LEE W L, INOUE K, et al. RUNX3 cooperates with FoxO3a to induce apoptosis in gastric cancer cells[J].The Journal of Biological Chemistry, 2006, 281(8): 5267-5276.
[14] CHEN Q H, GANAPATHY S, SINGH K P, et al. Resveratrol induces growth arrest and apoptosis through activation of FOXO transcription factors in prostate cancer cells[J]. PLoS One, 2010, 5(12): e15288.
[15] SHRESTHA A, NEPAL S, KIM M J, et al. Critical role of AMPK/FoxO3A axis in globular adiponectin-Induced cell cycle arrest and apoptosis in cancer cells[J]. Journal of Cellular Physiology, 2016, 231(2): 357-369.
[16] GRYKO M, GUZINSKA K, PRYCZNICZ A, et al. Correlation between fas and fasL proteins expression in normal gastric mucosa and gastric cancer[J]. Folia Histochem et Cytobiol, 2011, 49(1): 142-147.
[17] GOMES T S, OSHIMA C T, SEGRETO H R, et al. The extrinsic apoptotic signaling pathway in gastric adenocarcinomas assessed by tissue microarray[J]. Pathology Research and Practice, 2011, 207(10): 613-617.
[18] 郭 濤,钱家鸣,张建中,等.幽门螺杆菌及其相关细胞因子对胃上皮细胞凋亡的调控及相关机制[J].中华医学杂志,2006,86(38):2670-2673.
[19] 刘乐鑫,王静滨,马鹏莉,等.慢性非萎缩性胃炎中医证型与幽门螺杆菌感染、胃镜像及病理表现相关性分析[J].河北中医,2019,41(10):1505-1507,1511.
