高中生物“探究酵母菌种群数量的变化”实验方案改进
2020-08-12杜静吕乐
杜 静 吕 乐
([1]首都师范大学附属育新学校 北京 100096;[2]北京科技大学化学与生物工程学院 北京 100083)
酿酒酵母(Saccharomyces cerevisiae)作为一种微小的单细胞真菌,在食品发酵方面已有十分悠久的使用历史,其兼性厌氧特性和产酸产气能力被利用作为食品发酵剂。酿酒酵母作为酵母属中的重要组成部分,被广泛使用于果酒的发酵中。[1]酿酒酵母的生长能力强且具有益生作用,对人体无毒害,适合作为高中生物课程的实验材料。
1 酵母种群数量变化实验的改进措施
普通高中《生物学课程标准》选择性必修课程模块2《生物与环境》“探究培养液中某种酵母种群数量的动态变化”实验有助于学生达成概念2的理解,促进学生生物学科核心素养的提升,并能够运用数学模型表征种群数量变量的规律。[2]但课本中该实验采用血球计数板计数,血球计数板需要使用上下两个计数室,计数时间比较长且精确度较低,学生操作难度及误差较大。本实验改进为使用分光光度计测定菌液浓度,每次取样后均置于4℃冰箱,待实验结束后统一测定,每个样品测定3次取均值,便于学生操作且减小实验误差。为缩短实验时间采用豆芽汁低葡萄糖培养基,低葡萄糖浓度能够加快酵母生长曲线不同时期的转变,并且采用200rpm,30℃恒温培养条件,加快菌体生长速度,使实验在2天内基本完成以适应高中实验课进度。为使菌株的生长延迟期易于观察,采用万分之一的接种量以避免迅速进入对数期。通过设计并进行预实验确定合适的菌液接种时间,取样时间及间隔,锻炼学生的思考探究能力,通过观察预实验结果判断生长速度及取样方式,以减少实验失败几率。
本实验利用学生自制的传统发酵食品果酒中筛选得到的酵母菌菌株,并进行18S rDNA测序分析,丰富了实验过程与内容,锻炼了学生的实验操作能力及解决困难的能力,并使其对酵母的来源及生理特性有了较全面的认识与了解。在预实验的基础上,进行液体培养并测定菌体浓度的变化,绘制酵母菌的生长曲线。在学生理解理想条件下种群的“J型”生长模型的基础上,进一步讨论在有限制的现实条件下种群的生长情况,并对得到的生长曲线划分生长阶段,从而更好地理解“S型”生长曲线各阶段的特征及产生原因。[3]实验过程中涉及微生物的液体培养、基因组提取、PCR扩增、琼脂糖凝胶电泳、菌液的稀释及浓度测定、生长曲线的绘制及分析等内容,是涵盖多方面课程知识的综合实验,能够提升学生实验能力及分析探究能力,具有较高的可操作性和实践性。
2 实验的开展方法
2.1 实验材料与仪器
2.1.1 菌种
2.1.2 试剂与材料
自制果酒,黄豆芽,葡萄糖,去离子水,无水乙醇,琼脂粉等。
2.1.3 仪器设备
仪器:锥形瓶,比色皿,移液器,试管等;
设备:722型分光光度计,4℃冰箱,恒温培养摇床,电泳仪,基因扩增仪、高压灭菌锅,电子天平等。
2.2 研究方法
2.2.1 培养基的配制
配制豆芽汁葡萄糖培养基:在100mL去离子水加入10g黄豆芽煮沸30min,用纱布过滤,补足损失水量后制得10%豆芽汁。取10%豆芽汁100mL,加入3g葡萄糖,摇匀,分装到500mL锥形瓶中制得液体培养基,每组配制16瓶;另取液体培养基,再加入2g琼脂混匀制得固体培养基,每组配制4瓶。实验设置3组平行。将培养基,去离子水等实验物品在121℃下高压灭菌20min,冷却至室温。
作为中国农资流通第一股,安徽辉隆集团的展位上,重点展示了以高效功能化的水溶肥系列、中微量元素复合肥系列、作物专用复合肥系列为代表的绿色生态肥,产品的科技含量和肥料利用率均创新高。无独有偶,在参展产品中,“六国网”控失肥是六国化工与中国科学院合肥物质科学研究院合力打造的环保高效新型肥料,在提高肥料利用率、降低农业污染方面取得了突破性成果,并延伸出多种作物专用肥及“六国网+全程营养解决方案”,同样以科技含量高而吸引了众多参观者围观咨询。
2.2.2 菌株的分离与纯化
在超净工作台中取1mL果酒样品加入到9mL的无菌去离子水中,混合均匀,取1mL稀释液到9mL无菌去离子水中混合,重复此步骤,得到10-1到10-6的稀释液。选择10-4、10-5、10-6三个稀释梯度,分别吸取100uL稀释液加入无菌固体培养基表面,用无菌涂布棒在培养基表面涂布使菌液均匀铺开。在30℃培养箱静置培养至有明显菌落长出,依据酵母菌菌落形态特征初筛,挑取优势菌的单菌落至液体培养基中,在30℃,200rpm条件下振荡培养至菌液浑浊,再次在固体培养基平板上涂板,重复步骤直至平板上为单一菌落。
2.2.3 酵母菌基因组DNA的提取与鉴定
将纯化单菌挑至液体培养基中培养,获得菌液,按照酵母菌基因组提取试剂盒(上海生工B518257)说明进行基因组DNA提取,以提取物作为模板进行聚合酶链式反应(poLymerase chain reaction,PCR)扩增,引物为ITS1(5'-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5'-TCCTCCGCTTATTGATATGC-3’),循环参数为:94℃预变性反应4min;94℃变性反应30s,54℃退火反应30s,72℃延伸反应45s,循环30次;最后在72℃下延伸反应10min得到扩增后DNA样本,对扩增产物进行琼脂糖凝胶电泳并送到上海生工测序。在NCBI网站中将所测序列进行BLAST分析,获得菌株信息。
2.2.4 接种
在超净工作台中,向3组13个装有100mL的灭菌培养基中分别加入1mL酵母菌菌悬液,轻轻振荡混匀,并每组设置1个不加菌液的空白培养基作为对照。将锥形瓶编号并置于恒温培养箱,培养条件为30℃,200rpm振荡培养。
2.2.5 取样
在培养0、3、6、9、12、15、18、24、27、30、33、36、39、42、48h后分别取样,即每隔3小时各组均取出一瓶样品置于4℃冰箱中,做好标记。
2.2.6 OD值的测定
在取样结束后,取3组16支干净试管,将不同培养时长的菌液及空白对照组培养基摇匀并各取5mL到试管中,编写序号,将菌液进行适当稀释,使光密度处于0.1~0.65之间,以未接种的空白对照组液体培养基调零点,在680nm波长处,1cm比色皿中依次测定OD值。测定从浓度最低的菌悬液开始依次测定,测定两个样品间需要用去离子水多次冲洗比色皿。经稀释后的菌液OD值需要乘以稀释倍数以得到实际OD值。
2.2.7 生长曲线的绘制
记录测量得到的实际OD值数据,计算3组平行实验的平均值,制成曲线图并进行分析。
3 实验结果与讨论
菌株18S rDNA的测序结果为:AAACTCGGAAGGATCATTAAAGAAATTTAATAATTTTGAAAATGGATTTTTTTGTTTTGGCAAGAGCATGAGAGCTTTTACTGGGCAAGAAGACAAGAGATGGAGAGTCCAGCCGGGCCTGCGCTTAAGTGCGCGGTCTTGCTAGGCTTGTAAGTTTCTTTCTTGCTATTCCAAACGGTGAGAGATTTCTGTGCTTTTGTTATAGGACAATTAAAACCGTTTCAATACAACACACTGTGGAGTTTTCATATCTTTGCAACTTTTTCTTTGGGCATTCGAGCAATCGGGGCCCAGAGGTAACAAACACAAACAATTTTATCTATTCATTAAATTTTTGTCAAAAACAAGAATTTTCGTAACTGGAAATTTTAAAATATTAAAAACTTTCAACAACGGATCTCTTGGTTCTCGCATCGATGAAGAACGCAGCGAAATGCGATACGTAATGTGAATTGCAGAATTCCGTGAATCATCGAATCTTTGAACGCACATTGCGCCCCTTGGTATTCCAGGGGGCATGCCTGTTTGAGCGTCATTTCCTTCTCAAACATTCTGTTTGGTAGTGAGTGATACTCTTTGGAGTTAACTTGAAATTGCTGGCCTTTTCATTGGATGTTTTTTTTCCAAAGAGAGGTTTCTCTGCGTGCTTGAGGTATAATGCAAGTACGGTCGTTTTAGGTTTTACCAACTGCGGCTAATCTTTTTTTATACTGAGCGTATTGGAACGTTATCGATAAGAAGAGAGCGTCTAGGCGAACAATGTTCTTAAAGTTTGACCTCAAATCAGGTAGGAGTACCCGCTGAACTTAAGAAAAA…经过序列比对得到所筛菌株为酿酒酵母。
对3组平行实验菌液的OD值取平均值,绘制得到如图1所示的生长曲线图。可以看出酵母菌菌体浓度呈现先升高后缓慢下降的趋势,基本符合经典“S型”生长曲线中各阶段的特征。[4]0-6h左右菌体生长缓慢,浓度几乎没有增加,为生长延迟期,即酵母菌接种到新的培养基后,其代谢系统需要适应新的环境,同时需要合成酶、辅酶、其他代谢中间代谢产物等,所以此时期的细胞数目基本没有增加;6-30h左右为对数生长期,此阶段适应了新环境的酵母菌生长速率最快、代谢旺盛、酶系活跃、菌液浓度快速增加,同时外界环境也是最佳状态;30-33h为稳定期,酵母菌经对数生长的大量繁殖,消耗了培养基的大量营养及氧气,所产生的大量代谢产物使得酵母的繁殖受到抑制,并开始出现衰老死亡,死亡数量与增殖的酵母数基本持平,此时达到酵母菌生物量的峰值。33h以后菌液浓度开始下降,此阶段为衰亡期,经过前面的不断消耗,使得培养基中的营养物质越来越少,酵母菌的繁殖得不到充分的营养,同时外界环境对继续生长越来越不利,大量代谢产物的抑制,细胞的分解代谢大于合成代谢,导致此阶段酵母死亡数量高于增殖数量,酵母总数不断减少,整个群体出现负增长。
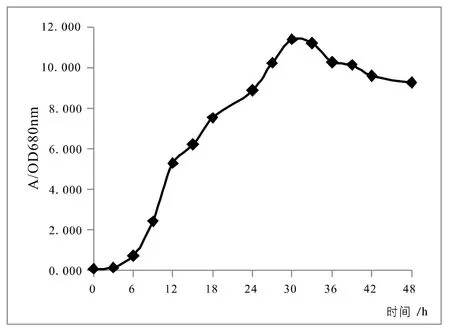
图1 酿酒酵母生长曲线
在一定体积的液体培养基中,接种后的少量酵母迅速形成一个酵母种群,由于养分、空间、温度和有毒排泄物等的影响,使酵母种群的数量有着类似于自然界中资源和空间有限的其他生物种群的增长规律,能够一定程度上模拟自然条件下微生物的生产规律。[5]由于微生物的生长受到多方面因素的影响,培养基中糖的种类和浓度均对酵母的生长有影响,因此在指定培养基中酵母的生长曲线具有一定的特殊性,仅能代表一定培养条件下酵母的生长特性。[6]实验中3个平行组的平均值得到的生长曲线基本符合“S型”曲线特征,能够清晰地看出各时间段酿酒酵母在液体培养基中的群落动态变化,达到了实验的预期目标。
4 总结
本实验对高中课程要求试验进行了丰富和改进,更加符合目前高中生的能力水平与教学要求,并且提高了实验的准确性和可操作性,符合高中课程的时间安排与实际需求。改进后的实验作为果酒制作以及酵母筛选培养的后续实验,能够从多方面锻炼学生的时间安排能力与问题解决能力,使其认识到科学研究不仅需要严谨细致的脑力劳动,而且需要艰辛刻苦的体力付出,并利于学生理解微生物的生长特性同时培养学生探究分析能力和实验操作技能。
