复合营养素对凡纳滨对虾的养殖效果评价
2020-08-12徐晓丽叶红梅丁子元钟文慧
徐晓丽 蔡 琰 叶红梅 郝 俊 丁子元 钟文慧
(天津市水产研究所,天津300221)
凡纳滨对虾(Litopenaeus vannamei)是世界范围内养殖产量最高的三种虾类之一,也是中国重要的水产养殖经济种类[1]。水是对虾赖以生存的环境,在对虾养殖过程中,良好稳定的水质是对虾健康生长的基础,为对虾提供充足溶解氧、钙、镁、磷、钾及各种微量元素等。钙、镁、磷、钾及各种微量元素是维持对虾正常内在环境、物质代谢正常进行、促进生长等必需的营养物质,是对虾蜕壳及机体激素和酶合成的必需组成部分。当养殖水体的营养物质含量不能满足对虾快速生长的需求时,将导致对虾换壳困难、生长速度缓慢和极易白浊等问题。微量元素在对虾的生长过程中发挥着至关重要的作用,任何一种营养元素的缺乏都有可能成为对虾生长的限制因子,同时限制池塘微生物、藻类的生长繁殖,影响整个水域生态系统的平衡[2-8]。
目前市场上补充微量元素的产品种类较多,配方各异,实际应用效果差别很大。为探明复合营养素在对虾养殖中的实际应用效果,作者在天津地区对虾养殖池塘进行应用试验,从池塘水质、浮游生物种类组成及优势种群多样性之间的差异、对虾体内免疫相关酶和最终产量等方面分析了在相同管理条件下,复合营养素对凡纳滨对虾养殖过程中的影响,为广大凡纳滨对虾养殖户提供微量元素实际应用的技术示范及理论支持,为养殖过程中水体调控提供依据,为探索科学合理的养殖模式提供基础资料。
1 材料与方法
1.1 试验池塘概况
试验基地位于天津市西青区王稳庄镇小泊村天津恒兴富民水产养殖专业合作社,选择3 个临近池塘,其中试验池2个,使用复合营养素;对照池1个,不使用复合营养素。池塘为泥质底,平均水深2 m,每年清淤,养殖用水来源于附近的独流减河,2018年5月12日投放凡纳滨对虾虾苗,虾苗来源于天津立达海水资源开发有限公司,并投放一定量的斑点叉尾鮰和鳙,详见表1。饲料选用天津通威股份有限公司生产的凡纳滨对虾配合饲料,蛋白含量40%。
1.2 复合营养素
试验所用复合营养素为天津傲绿神农科技有限公司生产,浅黄色或微绿色粉状,为21 种有机、无机营养成分和部分中草药配制而成,见表2。
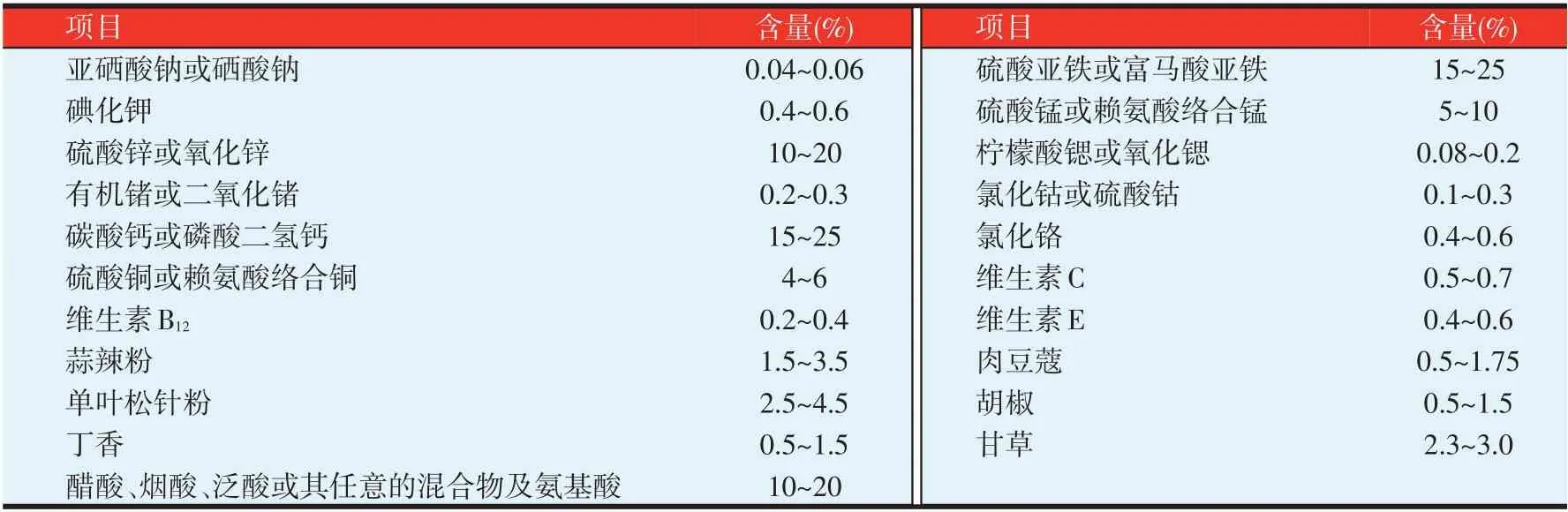
表2 复合营养素主要组成成分及其含量
1.3 试验设计
5月12日投放虾苗之前,采集水样1次,自5月24日试验池塘首次使用复合营养素(用量为1 kg/亩·m)时开始再次采样,每10 d 采样1 次,6 月15 日第二次使用复合营养素,7月17日第三次使用复合营养素,8月初开始陆续出虾。共采样8 次,用于水质测定,水样采集及保存遵循《地表水和污水监测技术规范》(HJ/T 91—2002),浮游生物采集参照《中华人民共和国国家标准-海洋调查规范》(GB/T 12763—2007)、《内陆水域渔业自然资源调查手册》、《水库渔业自然资源调查手册》进行,现场记录采样时间、天气、水温、水色、透明度、pH 值、溶解氧(DO)、盐度。实验室检测氨氮(TAN)、亚硝酸盐氮(NO2-N)、磷酸盐、总硬度、总碱度、弧菌、气单胞菌、总菌数量以及浮游生物定性定量9 个水质指标[9],氨氮检测按照《HJ 536—2009 水质氨氮的测定——水杨酸分光光度法》进行,亚硝酸盐氮的检测按照《GB/T 7493—87 水质亚硝酸盐氮的测定分光光度法》进行,磷酸盐、总碱度、总硬度的检测按照《GB/T 8538—2008 饮用天然矿泉水检验方法》进行。弧菌、气单胞菌、总菌数分别采用TCBS 培养基、RS培养基以及营养琼脂进行平板计数。
1.4 对虾抗病力对比
分别随机取试验池塘和对照池塘饥饿24 h 的凡纳滨对虾各10 尾,使用无菌注射器抽取500 μl 抗凝剂,从对虾头胸甲插入围心腔抽取血淋巴至1 000 μl(稀释倍数为2 倍),置于无菌离心管。4 ℃下静置3~4 h, 在4 ℃、10 000 r/min 离心10 min, 吸取上清液用作血清非特异性免疫指标——总抗氧化能力(TAOC)、溶菌酶(LZM)、多酚氧化酶(PPO)、总超氧化物歧化酶(SOD)和碱性磷酸酶(ALP)的测定。另外剥离对虾肝胰腺并制备肝胰腺匀浆液,提取上清液用于肝胰腺中非特异性免疫指标——总抗氧化能力(TAOC)、溶菌酶(LZM)、总超氧化物歧化酶(SOD)、碱性磷酸酶(ALP)的测定[10]。试验结果数据采用SPSS 21.0进行单因素方差分析,差异显著水平为P<0.05。
2 结果与分析
2.1 水质检测结果
池塘水温的变化范围为21.5~33.3 ℃,盐度为3.0‰~3.7‰。对虾生长适宜水温为22~35 ℃,本年度5、6月份气温不稳,有两次降温,但对虾生长未受明显影响,6月下旬水温平稳升高,对虾进入快速生长阶段。
试验池塘和对照池塘于4月17日进水沉降,水体较为浑浊,至5 月4 日采样水体透明度较低。5 月12日放虾苗,5 月25 日检测水体透明度升高,水质清瘦。5 月24 日使用复合营养素,10 d 后试验池塘浮游生物生长较快,透明度迅速降低至20~30 cm,水色转为茶褐色。试验池1和试验池2的水色稳定在15~16;对照池透明度至6月14日降至35 cm,浮游生物生长较慢。试验池和对照池溶解氧在整个养殖过程中的变化规律相似,呈波动变化,但均保持在5 mg/l以上,且多次检测,试验池溶解氧多高于对照池,但差异不显著(P>0.05)(见图1)。
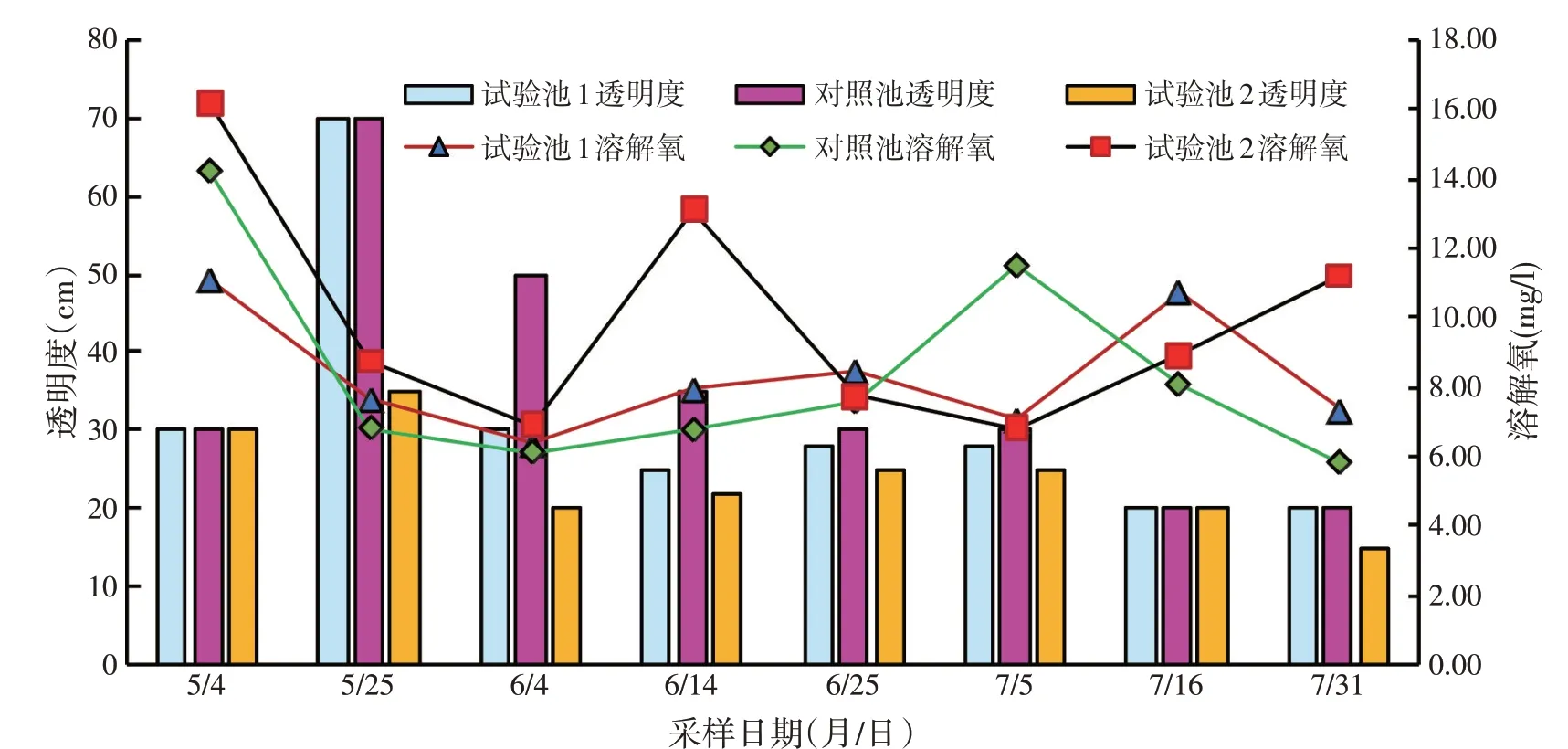
图1 池塘透明度/溶解氧检测结果
采样期间水体中氨氮含量极低。亚硝酸盐氮整体维持在较低水平,6月14日试验池和对照池检测数值较高,且对照池显著高于试验池(P<0.05),6月15日施用复合营养素,6月25日检测结果显示试验池塘亚硝酸盐氮降至0.1 mg/l以下,对照池直至7月5日降至0.1 mg/l以下,但仍显著高于试验池(P<0.05)。水体中磷酸盐含量多在0.1 mg/l 以下,仅7 月16 日试验池2磷酸盐含量异常升高(见图2)。
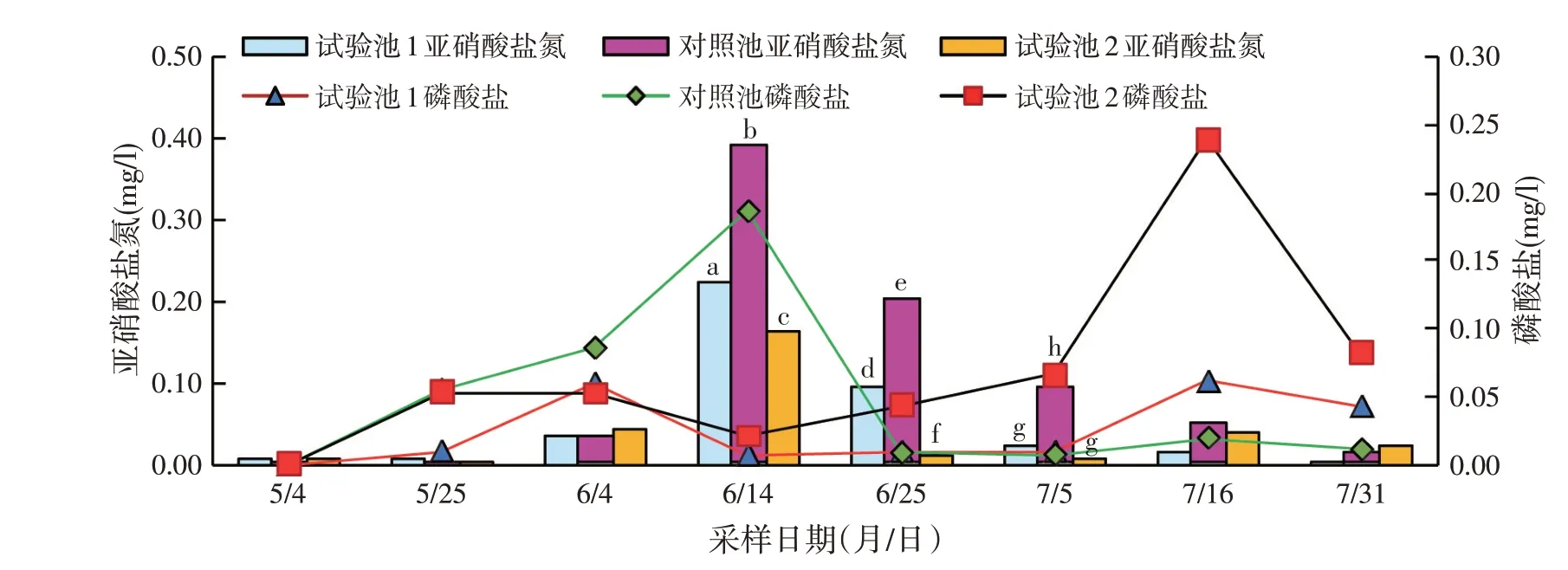
图2 池塘亚硝酸盐氮/磷酸盐检测结果
三个池塘总硬度在整个养殖过程中的变化规律相似,初期水体硬度较低,随着池塘底泥中物质的释放,同时使用复合营养素等,6 月14 日水体硬度上升,后期水体中总硬度维持在500~600 mg/l 左右,为对虾生长脱壳提供了充足的钙镁等离子。三个试验池塘的总碱度在整个养殖过程中的变化规律相似,都呈波动变化状态,进水初期较高至1 500 mg/l,6 月14 日水体硬度上升,总碱度下降至约200 mg/l,池塘水体缓冲能力较强,试验池和对照池差异不显著(P>0.05)(见图3)。整个养殖周期中,水体pH 值为7.66~9.29。试验池和对照池弧菌及气单胞菌数量变化无规律,均在103cfu/ml 以下,试验池与对照池差异不显著(P>0.05)。三个池塘中总菌数在整个养殖周期中变化呈波动状态,试验池总菌数多高于对照池,6 月14 日至7 月5 日和7 月31 日差异显著(P<0.05)(见图4)。
2.2 浮游植物组成与优势种
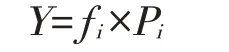
式中:Y——优势度(Y≥0.02时,定为优势种);
Pi——第i种个体数量在总个体数量中的比例;
fi——第i种的出现频率。
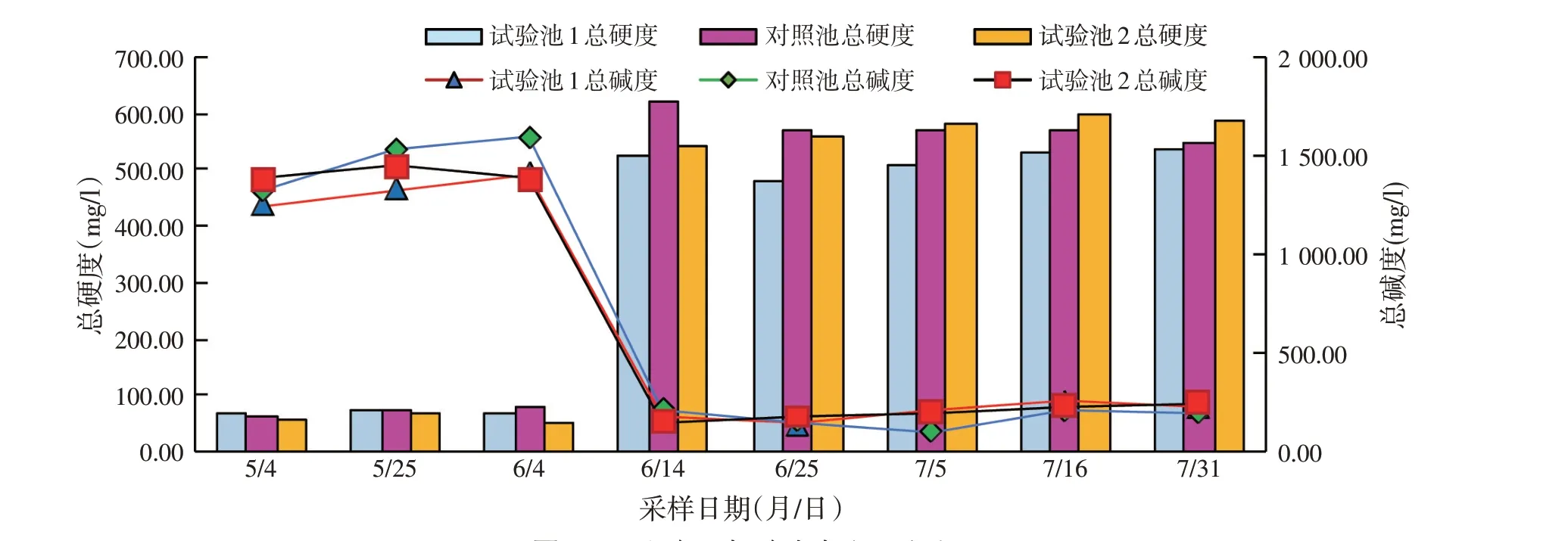
图3 池塘总硬度/总碱度检测结果

图4 池塘总菌数/pH值检测结果
本次试验池塘浮游植物共鉴定7 门64 属。其中硅藻门9 属(14.1%)、绿藻门34 属(53.1%)、蓝藻门13 属(20.3%)、金藻门1 属(1.6%)、甲藻门2 属(3.1%)、裸藻门3 属(4.7%)、隐藻门2 属(3.1%);优势种21 种。对照池塘浮游植物共鉴定7 门57 属,其中硅藻门10 属(17.5%)、绿藻门27 属(47.4%)、蓝藻门12 属(21.1%)、金 藻 门1 属(1.8%)、甲 藻 门1 属(1.8%)、裸藻门4 属(7.0%)、隐藻门2 属(3.5%),优势种14 种。
根据表3,养殖前中期(5月25日至7月5日),试验池塘在使用复合营养素后,浮游植物种类多以绿藻门(空星藻、栅藻、小球藻、卵囊藻、衣藻、盘星藻、绿球藻、肾形藻、蹄形藻、肾爿藻、纤维藻、四鞭藻)为主优势种,硅藻门(菱形藻、小环藻)、蓝藻门(微囊藻、席藻、平裂藻、螺旋藻)、隐藻门(蓝隐藻、隐藻)等为次优势种,对照池以蓝藻门为主优势种,其中微囊藻为常见的水华藻属,绿藻门、硅藻门、裸藻门(裸藻)、隐藻门等为次优势种。7 月下旬进入高温期,试验池与对照池藻类优势种主要都是蓝藻门、绿藻门,符合藻类生长特点。整个养殖周期,试验池塘和对照池塘均未发生蓝藻水华,未出现倒藻,水体清爽。

表3 浮游植物优势种组成
本研究中对照池浮游植物shannon-wiener 多样性指数变化范围为1.98~2.70,呈现波动变化无明显趋势;试验池(试验池1 和试验池2 合并计算)浮游植物shannon-wiener 多样性指数变化范围为1.85~2.74,自6月14日至7月5日,shannon-wiener多样性指数呈现平稳上升趋势且高于对照池,其中6月25日和7月5日差异显著(P<0.05)。对照池浮游植物种类均匀度(Pi⁃lou均匀度指数)变化范围为0.60~0.83,呈现波动变化无明显趋势;试验池浮游植物种类均匀度变化范围为0.58~0.82,其变化趋势与shannon-wiener 多样性指数变化情况相似。对照池浮游植物种类丰富度(mar⁃galef 指数)变化范围为1.89~4.29,试验池浮游植物种类丰富度变化范围为2.29~3.74,对照池与试验池浮游植物种类丰富度总体平稳,略有上下波动,整体差异不显著(P>0.05)(图5)。

表3(续) 浮游植物优势种组成
2.3 池塘浮游动物的组成与优势种
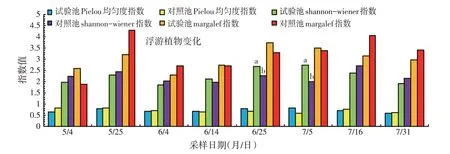
图5 池塘浮游植物多样性/均匀度/丰富度指数变化
对试验池塘和对照池塘中枝角类、桡足类、轮虫三大类浮游动物进行了定量分析,结果显示试验池塘枝角类平均密度变化范围为0~566 ind/l、对照池为0~24 ind/l,桡足类平均密度变化范围试验池为2~46 ind/l、对照池为0~16 ind/l,轮虫平均密度变化范围试验池为0~22 ind/l、对照池为0~12 ind/l(见表4),对照池与试验池三类浮游动物平均密度无明显变化规律,差异不显著,表明养殖池塘浮游动物种类组成与数量变化影响因素较多,非单一条件改变(复合营养素应用)而产生规律性变化。

表4 池塘浮游动物组成(ind/l)
2.4 免疫相关酶活性变化
对虾血清中酶活性检测结果见表5、表6,试验组PPO 和LZM 活性均显著高于对照组(P<0.05),ALP 活性稍高于对照组,但差异不显著(P>0.05),SOD活性、T-AOC 活性试验组和对照组差异不显著(P>0.05)。肝胰腺中ALP 活性明显高于对照组,差异显著(P<0.05),SOD 活性稍高于对照组但差异不显著,LZM、T-AOC活性试验组和对照组差异不显著。

表5 血清免疫相关酶活性

表6 肝胰腺免疫相关酶活性
2.5 产量统计
养殖期结束后,统计试验池与对照池对虾产量、亩投入、养殖成本等指标,见表7。

表7 养殖产量与投入统计
从养殖结果来看,试验池平均亩产275 kg,亩效益为5 985.57元,平均成本为21.40元/kg,而对照池平均亩产210 kg,亩效益为3 919.74 元,平均成本为23.33元/kg。试验池比对照池平均亩产提高65 kg,亩增效2 065.83 元,亩投入减少664.17 元,平均对虾养殖成本降低1.93元/kg。
3 分析与讨论
高密度养殖凡纳滨对虾,会大量消耗水体中常量和微量矿物质,钙、镁、锰、铁、锌、铜等营养盐离子不足均可导致对虾不能正常脱壳,容易形成软壳和脱壳不遂,生长速度缓慢,是水体养殖容量的限制因子,需要经常性的外源补充[2-6]。营养盐也是影响浮游生物重要因素,营养盐增多会引起浮游植物数量的快速增加,但营养盐浓度过高也会对浮游植物的生长产生抑制[7]。适量加富营养盐能够促进浮游植物生物量的增加和群落结构的变化。不同浮游植物类群对营养盐添加的敏感性不同,丰富的营养盐有利于硅藻生长,竞争能力强的浮游植物类群比如甲藻、蓝藻、隐藻等在低营养条件下可占据优势[8]。本试验中,施用复合营养素的试验池塘,亚硝酸盐氮整体维持在较低水平,水体中浮游植物优势种多为绿藻。但6月14日试验池和对照池检测数值均较高,分析认为随着气温升高,对虾摄食增加代谢加快,此时投饵量也相应增加,池塘残饵粪便的积累和分解,导致水体有机质增加,亚硝酸盐氮增加,同时对照池磷酸盐含量也显著升高,水体浮游植物优势种为蓝藻。对照池亚硝酸盐氮含量显著高于试验池(P<0.05),分析认为由于试验池溶解氧高于对照池,6 月14 日至7 月5 日,shannonwiener 多样性指数呈现平稳上升趋势且高于对照池,其中6 月25 日和7 月5 日差异显著(P<0.05),同时水体中总菌数也显著高于对照池(P<0.05),水体微生态系统代谢活跃,有机质被迅速分解,施用复合营养素10 d后(6月25日),试验池塘亚硝酸盐氮降至0.1 mg/l以下,对照池直至7 月5 日降至0.1 mg/l 以下,但仍显著高于试验池(P<0.05)。另对照池塘多次总菌数显著低于试验池也与消毒剂的使用有关。
浮游植物是水体中主要的初级生产力,可作为对虾下塘初期直接或间接饵料,兼具物质循环和能量供应的功能,浮游生物多样性指数、丰富度指数和均匀度指数可综合反映生物物种的丰富性和均匀性,直接反映水体营养状况,是常用的水质评价指标之一,其数值越大一般说明水质越好,物种群落结构越稳定,养殖水环境及生态系统越稳定,水体受污染程度越低,对外来变化的缓冲能力较强,多样性过低容易导致对虾出现不同程度的病害[11-13]。因此,有必要对浮游植物进行研究并评价养殖池塘水质与养殖效果,而营养盐是影响浮游植物变化的间接因素[14]。本研究施用复合营养素的试验池中,前中期以绿藻门为主优势种,后期以蓝藻门为优势种,试验池多样性指数和均匀度指数分别在1.85~2.74 和0.58~0.82 之间,养殖初期较低,生物种类较少,后稍有升高。随着养殖的进行,生物量增加,多样性指数增大,水体缓冲能力增强。根据多样性指数>3为轻度或无污染,在1~3之间为中度污染,在0~1之间为重度污染[15-17],本次试验池处于中度污染,说明养殖池中水环境质量仍有待改善。但浮游植物的群落结构及其动态演替规律受多种因素如阳光、水温、营养盐、pH 值及水中各种生物的影响,各个因子相互作用,相互影响,每个因子反映的只是水体的一方面,并不十分准确,应该综合分析各种因子,才能客观地反映水体的状况[18]。
对试验池塘对虾免疫相关酶指标的检测结果发现,试验组对虾血清中酚氧化酶PPO、LZM 活性显著高于对照组(P<0.05)。酚氧化酶系统在对虾的防御系统中起着重要的异物识别和防御功能[19]。试验组对虾酚氧化酶提高可能与复合营养素中的Se元素和VE有关,Se能促进PPO的活性,但随着使用时间的延长,对PPO的作用不显著,而VE在整个养殖过程中对PO活性都有影响。溶菌酶是甲壳类非特异性免疫系统的主要成分,在免疫中发挥重要的作用[19]。试验组对虾血清中LZM 活性提高,说明对虾抗病力提高,抗应激能力提高。
碱性磷酸酶ALP是巨噬细胞溶酶体的标志酶, 在体内直接参与磷酸基团的转移与代谢,具有促进水解和转磷酸的作用,是参与动物体内免疫活动重要的水解酶类[20]。本研究发现,使用复合营养素的池塘,对虾血清中ALP活性与对照组差异不显著(P>0.05),而在肝胰腺中,试验组对虾ALP活性与对照组差异显著(P<0.05)。肝胰腺是对虾体内重要的消化器官,在复合营养素的作用下,凡纳滨对虾肝胰腺中ALP表现较为敏感,可能通过提高ALP的活性这一途径来增强免疫作用。这可能与复合营养素中所含Se及VE有关。据报道,连续投喂含Se饲料能显著提高仿刺参(Apos⁃tichopus japonicus Selenka)体内ACP和ALP活性[21]。适当补充Se能显著提高凡纳滨对虾血清中ALP活性[22]。适量的Se 可调节机体的生理生化反应,促进血细胞和各种非特异性免疫因子的生物合成,从而增强机体的免疫功能。试验组对虾血清及肝胰腺中抗氧化相关酶SOD、总抗氧化能力与对照组差异不显著,可能复合营养素主要不是通过提高对虾体内抗氧化能力这一途径增强免疫作用的。一般调节对虾体内抗氧化能力的多为抗菌肽、β-葡聚糖等。
综上,复合营养素用于对虾养殖,能够迅速降解水体亚硝酸盐氮,优化藻类组成,促进水体中微生物代谢,稳定水质及池塘生态系统,提高对虾血清中酚氧化酶、溶菌酶活性及肝胰腺中碱性磷酸酶的活性,增强对虾抗病力,本试验池塘比对照池塘平均亩产提高65 kg,平均养殖成本降低1.93 元/kg,亩增效2 065.83元,经济效益较为可观。
