miRNA-145过表达增强卵巢癌顺铂化疗敏感性的机制分析
2020-08-12丁照黎谷见法张飞翔
丁照黎,谷见法,张飞翔
郑州大学附属郑州中心医院肿瘤科,郑州 450003
卵巢癌是女性常见的生殖系统恶性肿瘤,发病率仅次于子宫颈癌及子宫体癌,其中有超过90%的患者属于卵巢上皮癌,而卵巢上皮癌是妇科生殖系统恶性肿瘤中病死率最高的疾病[1]。顺铂是卵巢癌常用化疗药物,但是抗肿瘤效果并不理想,而影响卵巢癌患者顺铂化疗效果的危险因素有患者依从性、用药剂量和频率以及恶性肿瘤细胞对顺铂的耐药性等。卵巢癌细胞对顺铂的耐药性是其重要的自我保护机制,但是对患者的近期疗效及远期生存均可带来严重的不良影响,需要积极探讨耐药机制的产生原因及增强敏感性的方案才能增强卵巢癌顺铂化疗的效果[2]。miRNA是近年来恶性肿瘤领域研究的热点,越来越多的研究证实其与抑癌/促癌存在紧密的关系[3-5]。miRNA-145最初是在结肠癌中被发现,并且其表达水平明显低于癌旁正常组织,推测其与恶性肿瘤细胞的增殖、凋亡有关[6]。另有研究显示,miRNA-145的表达与肝癌患者化疗效果存在紧密关联,推测其表达能够调控肝癌化疗的敏感性[7]。多药耐药基因1(multi-drug resistance gene 1,MDR1)为常见的多药耐药基因,在人卵巢癌顺铂耐药中发挥重要的作用,有研究认为MDR1能够调节P-糖蛋白(P-glycoprotein,P-gp)表达,进而影响肿瘤细胞对顺铂的耐药性[8]。P-gp蛋白位于人类7号染色体长臂上,相对分子量高达170 000,由2个分子结构基本相同的亚基组成,各包含1个ATP结合位点和6个跨膜区,在卵巢癌顺铂化疗中也有参与且发挥重要作用[9]。但是miRNA-145在卵巢癌中的表达、其与顺铂化疗敏感性的关系及对MDR1、P-gp蛋白的表达是否有调控作用仍需要进一步探讨。故此,本研究特选取人卵巢癌顺铂耐药细胞株A2780/DDP进行体外实验,现报道如下。
1 材料与方法
1.1 材料
人卵巢癌顺铂耐药细胞株A2780/DDP购自中国医学科学院肿瘤医院细胞中心。
1.2 主要试剂及设备
胎牛血清、RPMI1640培养基均购自江苏恩莫阿赛生物技术有限公司;磷酸盐缓冲液(phosphate buffered solution,PBS)购自武汉博士德生物工程有限公司;四唑盐(methyl thiazolyl tetrazolim,MMT)溶液、二甲亚砜溶液均购自齐一生物科技(上海)有限公司;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)购自上海睿铂赛生物科技有限公司;RNA及蛋白提取试剂盒均购自美国Bio-Rad公司;Lipofectamine 2000脂质体、无关干扰序列、miRNA-145-5p mimics均购自宝生物(大连)科技有限公司;人抗鼠P-gp单克隆抗体、鼠抗兔P-gp多克隆抗体均购自亚诺法生技股份有限公司。3111型二氧化碳(CO2)培养箱购自美国Thermo公司;DMIL型倒置荧光显微镜购自德国Leica公司;FV1200型激光共聚焦显微镜购自日本Olympus公司;5810R型台式高速冷冻离心机购自德国Eppendorf公司;6孔细胞培养板购自美国Fisher Scientific公司;1500型酶标仪购自美国Thermo公司;CFX-96型聚合酶链反应扩增仪购自美国Bio-Rad公司;凝胶成像分析系统购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 细胞的传代培养、分组及干预方法 人卵巢癌顺铂耐药细胞株A2780/DDP用含10%胎牛血清的RPMI1640培养基于37℃、5% CO2培养箱中培养。倒置显微镜观察细胞生长情况,直至对数生长期时,以1.5×106/孔分装至6孔板,分为Blank组、Mock组、NC组和转染组4组,每组均设置5个复孔,均给予75 μmol/L(半数抑制浓度)的顺铂。采用Lipofectamine 2000脂质体转染法进行转染,严格按照说明书步骤操作,Mock组加入转染试剂即Lipofectamine 2000,NC组加入无关干扰序列,转染组逐滴加入miRNA-145-5p mimics质粒、脂质体混合液,Blank组加入等量生理盐水,分别在RPMI1640培养基中培养24 h后更换细胞培养液,继续培养24 h。
1.3.2 转染情况观察 分别于培养24、48 h后采用倒置荧光显微镜观察各组细胞的转染情况。
1.3.3 miRNA-145、MDR1mRNA表达水平检测于培养48 h后对各组细胞采用实时定量聚合酶链反应(real time-polymerase chain reaction,RT-PCR)检测,首先用PBS液冲洗,分别加入200 μl PBS+500 μl Buffer RLT,混合均匀后加入 5 μl β-巯基乙醇。加入 600 μl浓度为 70%的乙醇,采集 1000 μl混合液离心分离(12 000 r/min,15 min),取所得样品加入Buffer RW1,再次相同方法离心,加入500 μl RPE液再次相同方法离心,转移滤柱后离心(13 000 r/min,2 min),转移滤柱,加入Rnase-free水,静置后离心(12 000 r/min,15 min)。采用RNA提取试剂盒处理并进行逆转录,待合成cDNA后,将β-actin作为参照实施扩增实验。miRNA-145引物,上游:5'-TACTGATATCGTAGGACGCTACGTGCT-3',下游:5'-GTGTACCTGATGTATTACGACTGGCCA-3';MDR1引物,上游:5'-TGTAATCTTGCGAACGCGTCAAGTCTG-3',下游:5'-TGTACGC-TATATGTTGGACTAGCCAGC-3';β-actin引物,上游:5'-GAGTACTCTCTAAGGCGTCGTATAGCT-3',下游:5'-TACGTATAGCTCGGGTTAACTCTACGG-3'。利用PCR扩增仪进行扩增反应,50℃预变性 1 min,95 ℃变性30 s,56 ℃反应50 s,72 ℃反应30 s,合成互补链,进行35个循环。利用PCR仪内置功能获取实验数据。实验重复3次,取均值。
1.3.4 细胞增殖活性检测 采用MTT比色法检测细胞培养24、48 h后的增殖活性,每孔分别加入20 μl MTT溶液,培养4 h后将培养液撇去,加入150 μl二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,轻轻吹打直至溶液澄清,测定490 nm处的光密度值(optical density,OD),即为增殖活性。实验重复3次,取均值。
1.3.5 细胞核形态学变化及凋亡率检测 分别于细胞培养24、48 h后采用DAPI检测细胞核形态学变化并计算凋亡率,在细胞达到80%融合时继续培养,放去培养液,并用 PBS 洗涤,加入 1 μg/ml的DAPI,37℃培养于CO2培养箱中,避光孵育后再次用PBS冲洗,注意遮光操作,利用激光共聚焦显微镜观察细胞核的形态学变化,并计算细胞凋亡率,细胞凋亡率=凋亡细胞数/细胞总数×100%。实验重复3次,取均值。
1.3.6 P-gp 蛋白表达检测 采用蛋白质免疫印迹法(Western blot,WB)检测,以试剂盒提取总蛋白并进行定量,上样,每孔上样量为20 μl,进行电泳分离,然后转膜1.5 h,用脱脂奶粉摇床,4℃封闭24 h,加入一抗,27℃摇床孵育,2 h后洗涤,并加入二抗,27℃孵育1 h,暗室中显色。以P-gp蛋白灰度值与β-actin灰度值的比值记为P-gp蛋白的相对表达量。实验重复3次,取均值。
1.4 统计学分析
采用SPSS 24.0软件进行统计分析,计数资料以例数及率(%)表示;计量资料以均数±标准差(±s)表示,多组比较采用方差分析,组间两两比较采用SNK-q检验,两组比较采用配对t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-145转染情况的比较
培养24、48 h时NC组、Blank组、Mock组均无转染阳性细胞,而转染组阳性细胞转染率均较高(图1),分别为(28.12±1.86)%、(85.41±2.01)%,差异有统计学意义(t=46.778,P=0.000)。
2.2 培养48h时miRNA-145、MDR1mRNA表达水平的比较
各组细胞培养48 h时miRNA-145、MDR1mRNA表达水平比较,差异均有统计学意义(P<0.01);其中NC组、Blank组、Mock组细胞miRNA-145表达水平均低于转染组,而MDR1mRNA表达水平均高于转染组,差异均有统计学意义(P<0.05)。(表1)
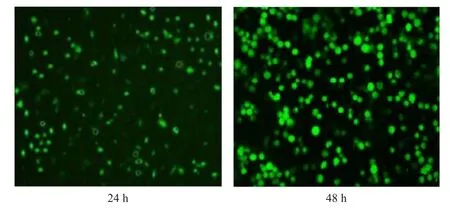
图1 转染组转染24、48h的荧光结果(×100)
表1 各组细胞培养48 h时miRNA-145、MDR1 mRNA表达水平的比较(±s)

表1 各组细胞培养48 h时miRNA-145、MDR1 mRNA表达水平的比较(±s)
注:*与转染组比较,P<0.05
m i R N A-1 4 5表达0.7 8±0.1 1 0.5 0±0.1 1*0.5 2±0.1 0*0.5 1±0.1 2*7.5 2 7 0.0 0 2 0.4 2±0.1 1 0.5 6±0.1 2*0.5 8±0.1 3*0.5 7±0.1 2*7.4 0 1 0.0 0 4转染组N C组B l a n k组M o c k组F值P值M D R 1 m R N A表达组别
2.3 细胞增殖活性的比较
各组细胞培养24、48 h时OD值比较,差异均有统计学意义(P<0.05);各组细胞培养48 h时OD值均高于培养24 h时,且同一时刻转染组OD值均低于NC组、Blank组、Mock组细胞,差异均有统计学意义(P<0.05);而同一时刻NC组、Blank组、Mock组OD值比较,差异均无统计学意义(P>0.05)。(表2)
表2 培养24、48 h时各组细胞OD值的比较(±s)
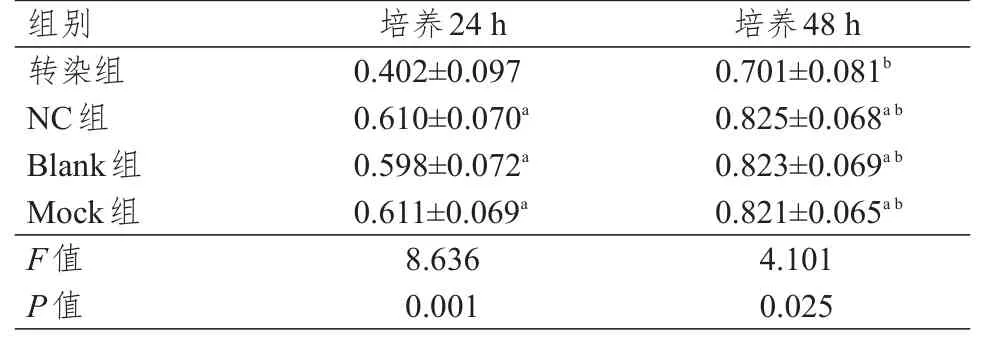
表2 培养24、48 h时各组细胞OD值的比较(±s)
注:a与同时间转染组比较,P<0.05;b与本组培养24 h比较,P<0.05
培养4 8 h 0.7 0 1±0.0 8 1 b 0.8 2 5±0.0 6 8 a b 0.8 2 3±0.0 6 9 a b 0.8 2 1±0.0 6 5 a b 4.1 0 1 0.0 2 5 0.4 0 2±0.0 9 7 0.6 1 0±0.0 7 0 a 0.5 9 8±0.0 7 2 a 0.6 1 1±0.0 6 9 a 8.6 3 6 0.0 0 1转染组N C组B l a n k组M o c k组F值P值培养2 4 h组别
2.4 细胞核形态学变化、细胞凋亡率的比较
各组细胞均有细胞核浓缩、变小等形态学表现,且染色质无规律分布、边界不清或染色质集中于核膜且呈新月状,细胞膜不完整,培养48 h时细胞核形态学变化均比培养24 h时更为严重,同一时刻细胞核形态学变化比较,NC组、Blank组、Mock组细胞形态学相近,转染组细胞核形态学变化均较上述3组严重改变(图2)。培养48 h时各组细胞凋亡率均明显高于培养24 h时,且各时间NC组、Blank组、Mock组细胞凋亡率均低于转染组,差异均有统计学意义(P<0.05)(表3)。
2.5 培养48h时P-gp 蛋白相对表达量的比较
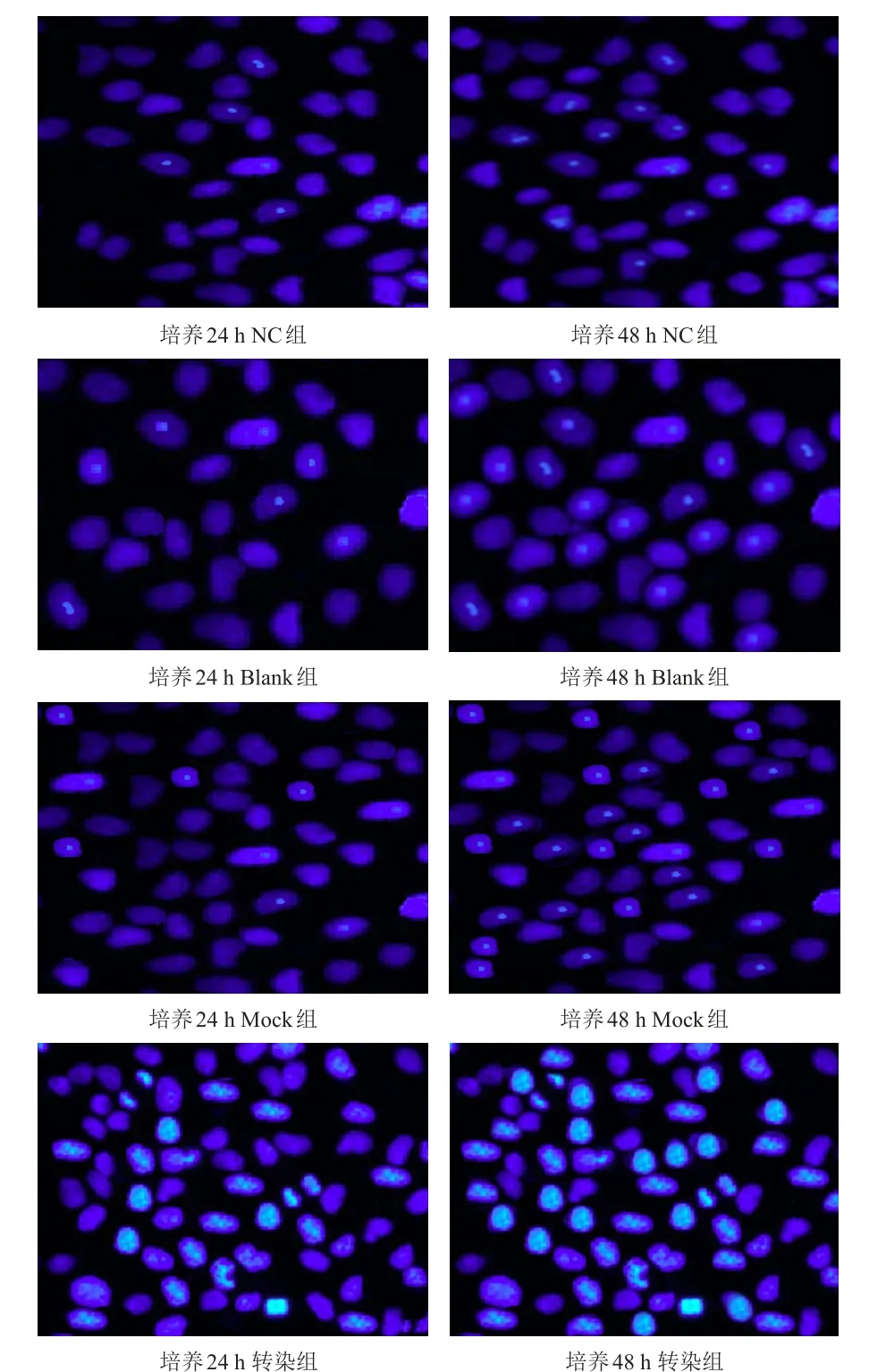
图2 培养24、48h 各组细胞核形态学变化(DAPI染色,×200)
表3 培养24、48 h时各组细胞凋亡率的比较(%,±s)
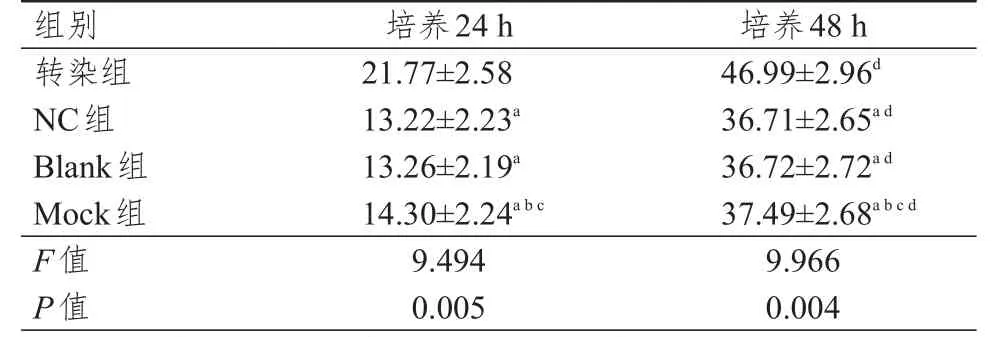
表3 培养24、48 h时各组细胞凋亡率的比较(%,±s)
注:a与同时间转染组比较,P<0.05;b与同时间NC组比较,P<0.05;c与同时间Blank组比较,P<0.05;d与本组培养24 h比较,P<0.05
组别转染组N C组B l a n k组M o c k组F值P值2 1.7 7±2.5 8 1 3.2 2±2.2 3 a 1 3.2 6±2.1 9 a 1 4.3 0±2.2 4 a b c 9.4 9 4 0.0 0 5 4 6.9 9±2.9 6 d 3 6.7 1±2.6 5 a d 3 6.7 2±2.7 2 a d 3 7.4 9±2.6 8 a b c d 9.9 6 6 0.0 0 4培养2 4 h 培养4 8 h
各组细胞培养48 h后P-gp蛋白相对表达量比较,差异有统计学意义(P<0.01);且NC组、Blank组、Mock组细胞P-gp蛋白相对表达量均高于转染组,差异均有统计学意义(P<0.05)。(表4、图3)
表4 各组细胞培养48 h时P-gp蛋白相对表达量的比较(±s)
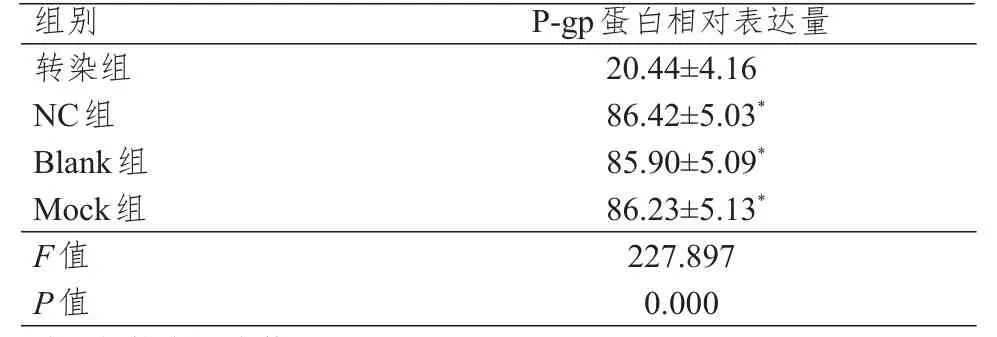
表4 各组细胞培养48 h时P-gp蛋白相对表达量的比较(±s)
注:*与转染组比较,P<0.05
组别转染组NC组Blank组Mock组F值P值P-gp蛋白相对表达量20.44±4.16 86.42±5.03*85.90±5.09*86.23±5.13*227.897 0.000
3 讨论

图3 各组细胞培养48h后P-gp 蛋白表达情况
目前人们对卵巢癌的发生机制认识尚浅,大致可以将其分为外部因素和内部因素,其中前者主要包括物化致癌因子接触,后者主要包括遗传、基因突变、精神因素以及免疫功能异常等,需进行深入研究。卵巢癌化疗耐药性一直是国内外医学研究人员普遍关注的重点。既往研究表明,卵巢癌化疗耐药是恶性肿瘤细胞的自我保护机制,能够减轻细胞受损甚至是避免细胞损伤,使得恶性肿瘤细胞异常增殖,并且难以有效控制[10-11]。因此如何采取有效手段以增强卵巢癌细胞对化疗的敏感性仍是目前亟待解决的问题。目前临床常用的增敏剂有甘氨双唑钠、奥拉帕尼等,虽然有确切的近期疗效,但是远期效果仍不甚理想,究其原因主要为对卵巢癌化疗耐药的机制认识尚浅且缺乏特异性的干预手段。
本研究中,转染组在培养24、48 h时经过荧光倒置显微镜观察可知,细胞转染率明显升高,而其余3组均未见细胞转染,证实转染组miRNA-145转染成功。此外,本研究还显示转染组miRNA-145的表达水平明显高于NC组、Blank组、Mock组,与上述倒置荧光显微镜观察转染的结果相一致,证实转染组miRNA-145的表达水平的确较高。转染组细胞培养24、48 h时增殖活性均低于NC组、Blank组、Mock组,细胞凋亡率均高于NC组、Blank组、Mock组,且转染组细胞培养48 h时的增殖活性和细胞凋亡率均高于本组培养24 h时,表明转染miRNA-145、滴加顺铂化疗药物的人卵巢癌顺铂耐药细胞株的增殖活性可显著降低,细胞凋亡率则会明显升高,证实miRNA-145过表达能够增强卵巢癌顺铂化疗的敏感性,从而抑制恶性肿瘤细胞增殖,促进恶性肿瘤细胞凋亡。miRNA-145属于一种抑癌基因,对恶性肿瘤细胞生长和增殖的抑制作用可能是通过抑制癌基因表达、促进肿瘤细胞凋亡、调控细胞周期实现的[12]。原癌基因激活是卵巢癌细胞快速增殖的重要条件,而miRNA-145能够多靶向抑制多个癌基因的表达,包括佛氏白血病病毒整合蛋白1(friend leukemia integration 1 transcription factor,FLI1)、胰岛素受体底物 1(insulin receptor substrate-1,IRS-1)等[13]。有研究表明,miRNA-145能够发挥周期阻滞的环路作用,有助于调控细胞之间的增殖和凋亡平衡[14-15]。由此可知,miRNA-145对卵巢癌细胞具有抑制增殖、促进凋亡的作用,但是关于其对卵巢癌顺铂化疗敏感性的研究尚鲜有报道。本次研究通过对各组细胞不同时间的细胞核形态学变化观察结果显示,miRNA-145转染后细胞核出现严重的形态学改变,且培养48 h时的形态学改变明显较培养24 h后的形态学改变严重,而顺铂杀灭卵巢癌细胞的作用机制便是诱导细胞核发生形态学改变[16],促进其凋亡,抑制增殖。故此,结合上述分析和本研究结果可以发现,miRNA-145过表达本身具有抑制卵巢癌细胞增殖、促进其凋亡的作用,但与此同时该干预方法还可增强卵巢癌细胞对顺铂化疗的敏感性,间接抑制恶性肿瘤细胞增殖、促进其凋亡。
本研究中,各组MDR1mRNA表达水平比较有显著性差异,其中转染组水平最低,推测miRNA-145过表达能够降低MDR1的表达水平;在P-gp蛋白相对表达量的比较结果中,转染组最低,而NC组、Blank组、Mock组均高于转染组,推测miRNA-145过表达的人卵巢癌顺铂耐药细胞株中P-gp蛋白表达可能受到显著抑制。P-gp蛋白主要存在于耐药恶性肿瘤细胞的细胞膜上,能够与ATP结合,并且据此获得能量,进而发挥药物泵的功能,促进细胞内存在的化疗药物快速排出,减少恶性肿瘤细胞内化疗药物的积聚,减轻甚至避免细胞核由于受到损伤而发生形态学变化[17]。既往研究显示,在人肝癌细胞株SMMC-7721中,在添加顺铂后给予增敏剂干预,结果发现增敏剂干预组细胞的P-gp蛋白表达量显著降低,而空白对照组的P-gp蛋白持续处于较高水平,证实P-gp蛋白的表达水平越高,恶性肿瘤细胞对顺铂化疗的敏感性越差,而P-gp蛋白的表达水平越低,恶性肿瘤细胞对顺铂化疗的敏感性越高[18]。由此可知,P-gp蛋白表达与恶性肿瘤细胞顺铂化疗的敏感性呈明显负相关。类似的结论在国外Falzone等[19]的报道中也得到证实。miRNA-145过表达能够下调MDR1基因的表达,而该基因的表达产物便是P-gp蛋白,因此miRNA-145过表达能够降低P-gp蛋白的表达水平,从而增强细胞株对顺铂的敏感性,改善抗肿瘤效果。结合本研究结果与上述分析,推测miRNA-145过表达很可能是通过降低P-gp蛋白的表达增强人卵巢癌顺铂耐药细胞株A2780/DDP对顺铂的敏感性,但是具体调控机制仍有待深入探讨。
综上所述,miRNA-145过表达能够抑制人卵巢癌顺铂耐药细胞株A2780/DDP增殖,促进其凋亡,还可导致细胞核出现严重的形态学改变,推测与降低P-gp蛋白表达、增强肿瘤细胞对顺铂化疗的敏感性有关,但是具体机制仍有待深入探讨,可作为进一步研究的方向。
