雷帕霉素联合肝动脉化疗栓塞术对兔肝移植瘤模型中相关因子表达的影响△
2020-08-12张君娜蔡静宋华勇吴涛
张君娜,蔡静,宋华勇,吴涛
河南大学第一附属医院1病理科,2肿瘤内科,3影像科,河南 开封 475001
肝癌是常见的消化系统恶性肿瘤。数据显示,2015年,全球因肝癌死亡病例达81.0万人,仅次于肺癌[1]。雷帕霉素(rapamycin,RAPA)是一种从吸水链霉菌发酵液中分离的抗真菌抗生素[2]。近年来,研究证实RAPA在肺癌、肝癌、胃癌、胰腺癌及妇科肿瘤等多种肿瘤中具有较强的抑制肿瘤生长、诱导细胞凋亡的作用[3]。另外,RAPA具有不良反应少的特点,可在不损伤正常组织细胞的情况下,阻断雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)信号通路,抑制肿瘤细胞的增殖[4]。目前,仅在移植手术后的免疫抑制等方面展开了RAPA相关临床试验,而RAPA对恶性肿瘤抑制作用的具体机制尚不完全清楚[5]。本文拟通过建立肝移植瘤兔模型,研究RAPA通过经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)给药时,肝癌组织中缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、血管内皮生 长因 子(vascular endothelial growth factor,VEGF)及基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)3种肿瘤生长相关因子的表达情况,现报道如下。
1 材料与方法
1.1 实验材料
选择购自河南省疾病预防控制中心的健康新西兰大白兔,共21只,雌雄不限,体重(2.7±0.3)kg,实验动物许可证号:SYXK(豫)2017-0009。兔VX2肿瘤细胞购自通派(上海)生物科技有限公司。雷帕霉素由杭州中美华东制药有限公司生产,表柔比星由山东新时代药业有限公司生产,丝裂霉素由海正辉瑞制药有限公司生产。HIF-1α、VEGF和MMP2免疫组化试剂盒均购自上海雅吉生物科技有限公司。实时荧光定量逆转录聚合酶链反应(reverse transcription-quantitative real-time polymerase chain reaction,RT-qPCR)所需试剂和引物均购自南京金斯瑞生物科技有限公司。
1.2 实验方法
1.2.1 建立兔肝移植模型 恒温37℃水浴解冻冰冻的VX2肿瘤组织,取鱼肉样解冻组织于由青霉素和生理盐水配制的溶液(160万U/dl)中,剪碎成约2 mm大小,用粗针穿刺注射入一只健康大白兔后腿肌肉深部。两周后,取出新鲜VX2肿瘤组织剪碎成约2 mm大小,开始建模。水合氯醛麻醉后,实验兔仰卧位固定,利多卡因局部浸润,于剑突下切开约2 cm,暴露肝左叶,粗针穿刺置入2~3颗VX2肿瘤组织,使用明胶海绵止血。术后抗感染3 d。2周后行计算机断层扫描(CT)检查,20只实验兔全部建模成功,肝脏内存在肿瘤。
1.2.2 分组及治疗方案 采用随机数字表法将20只建模成功的实验兔随机均分为研究组和对照组。对照组给予表柔比星1 mg/kg+丝裂霉素0.2 mg/kg;研究组在对照组基础上给予RAPA 1 mg/kg。所有实验兔均以碘化油溶解药物制成乳剂,经TACE途径给药。TACE的具体操作方法:实验兔常规麻醉(氯胺酮22 mg/kg)后固定于操作台,穿刺股动脉,置入微导管,进行肝总动脉造影,明确肝移植瘤大小、位置及滋养血管位置。再配合微导丝,将微导管置于肿瘤滋养血管,然后灌注化疗栓塞药物,当肿瘤滋养血管完全栓塞、肿瘤内造影剂浓集则停止注射。退出导管,压迫穿刺点止血。
1.2.3 CT 测量肿瘤体积 分别于治疗当天、治疗后3天及治疗后7天,对模型兔肝肿瘤进行CT平扫,测量最大截面的长径和短径,计算肿瘤体积。
1.2.4 免疫组化染色法检测蛋白表达 第3次CT扫描后处死实验兔,解剖肝脏,严格按照免疫组化试剂盒操作,检测肝癌组织中HIF-1α、VEGF和MMP2蛋白的表达水平,当肝细胞内出现棕黄颗粒即为阳性。采用图像分析软件分析相应的光密度(optical density,OD)值,选择图像中的阳性区域,得出这些区域的平均OD值。每只实验兔取3份标本,每个切片随机选择5个视野进行测量,取平均值。
1.2.5 RT-qPCR法检测mRNA表达 取兔移植瘤组织100 mg充分剪碎研磨,然后加入1 ml Trizol匀浆,提取总RNA,然后经逆转录生成cDNA,置于-20℃冷冻备用。严格按照聚合酶链反应(polymerase chain reaction,PCR)扩增操作流程绘制工作曲线、扩增目的基因。3种待测的mRNA(HIF-1α、VEGF和MMP2mRNA)均以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)mRNA 作为内参基因,采用 2-ΔΔCt值表示目的mRNA的相对表达量。引物序列:GAPDH的上游引物为5'-CACCCACTCCTCTA CCTTCG-3',下游引物为5'-TGCTGTAGCCAAATTCGTTG-3';HIF-1α的上游引物为5'-CATGTTCCCTTCATCCAATG-3',下游引物为5'-TGCAGGGTCAGCACTACTTC-3';VEGF的上游引物为5'-AGGAGACAATAAAC CCCACG-3',下游引物为 5'-CACACTCCAGGCTTTCATCAT-3';MMP2的上游引物为 5'-ATGACATCAAGGGCATTCAA-3',下游引物为5'-ACGATGTCCTGTGTGCAGAT-3'。
1.3 观察指标
观察给药后两组肝癌实验兔的肿瘤体积,检测并比较两组肝癌实验兔移植瘤组织中HIF-1α、VEGF、MMP2蛋白及相应mRNA的相对表达量。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,连续测量数据的比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组肝癌实验兔肿瘤体积的比较
治疗后,两组肝癌实验兔的肿瘤体积组间比较,差异有统计学意义(F组间=3.461,P组间<0.01);两组肝癌实验兔不同时间点(治疗当天、治疗后3天、治疗后7天)的肿瘤体积比较,差异均有统计学意义,且肿瘤体积均随着时间的延长而逐渐增大(F时间=107.335,P时间<0.01);两组肝癌实验兔的肿瘤体积在时间和组间上存在交互作用,差异均有统计学意义(F交互=35.103,P交互<0.01)。(表1)
表1 两组肝癌实验兔的肿瘤体积变化(cm³,±s)

表1 两组肝癌实验兔的肿瘤体积变化(cm³,±s)
组别对照组(n=1 0)研究组(n=1 0)4.6 5±0.7 5 4.6 9±0.6 3 7.4 0±0.5 2 6.4 0±0.3 9 9.6 5±0.8 8 7.9 0±0.4 6治疗当天治疗后3天治疗后7天
2.2 HIF-1α、VEGF和MMP2蛋白及mRNA相对表达量的比较
免疫组化染色结果显示,研究组兔肝移植瘤模型肝癌组织中HIF-1α、VEGF和MMP2蛋白的相对表达量均明显低于对照组,差异均有统计学意义(P<0.01)(表2)。RT-qPCR结果显示,研究组兔肝移植瘤模型肝癌组织中HIF-1α、VEGF和MMP2的mRNA的相对表达量均低于对照组,差异均有统计学意义(P<0.05)(表3)。
表2 两组兔肝移植瘤模型肝癌组织中HIF-1α、VEGF和MMP2蛋白相对表达量的比较(±s)
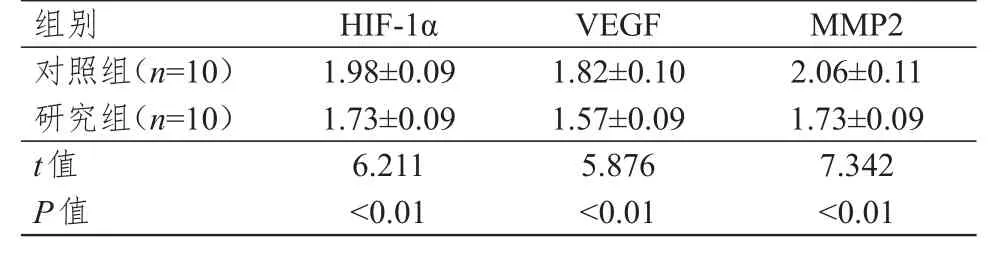
表2 两组兔肝移植瘤模型肝癌组织中HIF-1α、VEGF和MMP2蛋白相对表达量的比较(±s)
组别对照组(n=1 0)研究组(n=1 0)t值P值1.9 8±0.0 9 1.7 3±0.0 9 6.2 1 1<0.0 1 1.8 2±0.1 0 1.5 7±0.0 9 5.8 7 6<0.0 1 2.0 6±0.1 1 1.7 3±0.0 9 7.3 4 2<0.0 1 H I F-1 α V E G F M M P 2
表3 两组兔肝移植瘤模型肝癌组织中H-IF-1α、VEGF和MMP2 mRNA相对表达量的比较(±s)

表3 两组兔肝移植瘤模型肝癌组织中H-IF-1α、VEGF和MMP2 mRNA相对表达量的比较(±s)
组别对照组(n=1 0)研究组(n=1 0)t值P值1.2 5±0.0 9 1.1 4±0.1 2 2.3 1 9<0.0 5 1.1 8±0.0 8 1.0 9±0.0 7 2.6 7 7<0.0 5 1.2 2±0.1 1 1.0 6±0.0 8 3.7 2 0<0.0 5 H I F-1 α m R N A V E G F m R N A M M P 2 m R N A
3 讨论
2015年,中国肝癌新发病例数占全球肝癌新发病例总数的54.58%(46.61万/85.40万),但是,被明确诊断时,多数患者已错过直接手术的机会,造成严重的社会健康负担[1,6]。对于中晚期肝癌,介入治疗成为了越来越重要的手段,临床对介入方法和药物的探索从未停止[7]。有研究发现,RAPA不仅具有免疫抑制作用,还对包括肝癌在内的多种肿瘤细胞具有增殖抑制作用,成为研究热点[8]。然而,国内外对RAPA抑制肝癌细胞增殖的作用机制的研究还相对较少,因此,本研究选取了HIF-1α、VEGF和MMP2三个常见的肿瘤相关因子进行研究。
TACE是肝癌介入治疗的经典方法,可以选择性中断肿瘤血供,造成肿瘤组织缺血、缺氧,是减小肿瘤体积、提高手术切除率的重要方法,并有利于肝内微小病灶的诊断和治疗[9]。但是,缺血仅能暂时控制肿瘤的进展,必须配合化疗药物,杀死肿瘤细胞,才能发挥更好的治疗效果。本研究中,治疗后,两组的肿瘤体积均有所增大,Manjulika[10]的研究指出,肝癌组织边缘与正常组织呈交错生长,边缘肿瘤细胞可以通过正常肝脏血窦汲取营养,提示通过TACE不可能完全阻断肝癌的生长。本研究中,治疗后,两组肝癌实验兔的肿瘤体积比较,差异有统计学意义(F=3.461,P<0.01),且均随着时间的延长而逐渐增大(F=107.335,P<0.01)。两组肝癌实验兔的肿瘤体积在时间和组间上存在交互作用(F=35.103,P<0.01),提示研究组的肿瘤增长速率明显低于对照组,RAPA可以使TACE抑制肿瘤的效果更好。
HIF-1α在正常细胞中会被迅速分解,在肿瘤等缺氧细胞中能较稳定地存在,是多种信号通路的重要物质,能促进缺氧状态时肿瘤细胞中VEGF表达的上调,而后者可特异性增加血管通透性,改变血管基质,促进内皮细胞迁移、增殖,从而促进肿瘤新生血管的形成[11]。既往研究证实,TACE治疗后,兔移植瘤模型中HIF-1α、VEGF蛋白及mRNA的表达水平均明显下降[12]。这是由于TACE可以阻断肿瘤血供,抗肿瘤药物可杀灭大部分活跃的肿瘤细胞,虽然术后肿瘤组织的乏氧情况加剧,但活跃的细胞数量却明显减少,从而总体下调了肿瘤生长相关细胞因子的表达[13]。本研究中,研究组肝癌组织中 HIF-1α、VEGF、MMP2蛋白及mRNA的相对表达量均低于对照组,提示RAPA联合常规化疗方案经TACE给药能更好地抑制肿瘤细胞的增殖活性,这符合TACE治疗中晚期肝癌效果的理论基础[14]。
MMP2是一种蛋白水解酶,其催化位点包含3个纤维连接蛋白Ⅱ型重复序列,可以使变性Ⅳ型胶原、Ⅴ型胶原与弹性蛋白相结合,从而使细胞外基质和基底膜降解,进而为肿瘤的侵袭与转移创造条件[15]。本研究中,研究组移植瘤组织中MMP2蛋白及mRNA的表达水平均低于对照组(P<0.05),提示RAPA可能具有抑制肿瘤细胞转移的作用,与Dai等[16]的研究结果类似。
综上所述,RAPA联合常规化疗药物在抑制兔肝移植瘤生长及HIF-1α、VEGF、MMP2因子的表达方面优于仅用常规化疗方案。但是,本研究尚存在不足之处,一是未能检测两组实验兔治疗前后肝功能的变化情况,无法了解联合治疗是否会增加肝衰竭的发生风险;二是未对治疗后移植瘤边缘的浸润情况进行形态学分析,无法了解联合治疗是否会增加肿瘤转移的发生风险。本研究在分子水平变化方面的结果为临床提高肝癌TACE的治疗效率提供了参考,在下一步实验中争取弥补不足,取得进展。
