原钙黏蛋白10对胃癌顺铂化疗敏感性的影响及作用机制初探
2020-08-12郭锦涛李俊岳德亮
郭锦涛,李俊,岳德亮
信阳市中心医院普通外科,河南 信阳 464000
胃癌是一种上消化道恶性肿瘤,发病率和病死率均居恶性肿瘤前列,随着生活节奏的加快及饮食结构的转变,胃癌发病率逐年升高[1],严重威胁患者的生命健康。目前,临床常采用规范化手术、放化疗等综合治疗方案治疗胃癌,但部分中晚期患者仍可发生远处转移,预后不良[2]。肿瘤细胞多药耐药是预后不良的重要因素,顺铂作为胃癌化疗的一线药物,其耐药性受到临床广泛关注。原钙黏蛋白10(procadherin 10,PCDH10)属于钙黏蛋白超家族亚群成员,多项研究表明,PCDH10是一种肿瘤细胞抑制基因[3-5],在舌鳞状细胞癌、胰腺癌、乳腺癌等肿瘤细胞中均呈异常低表达,参与肿瘤发生发展进程。目前,关于PCDH10对顺铂化疗敏感性影响及机制的研究较少。多种恶性肿瘤中均存在磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB,又称AKT)通路异常激活,且该通路存在一个重要的下游信号分子,即哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,MTOR),而p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6)是MTOR的直接底物,该通路在促进肿瘤放化疗抵抗上具有重要作用[6-7],由此推测,PCDH10可通过调控PI3K/AKT/MTOR/p70S6通路参与胃癌对顺铂的耐药进程。为验证该猜想,本研究通过建立过表达PCDH10的人胃癌BGC823细胞株,探讨PCDH10对顺铂化疗敏感性的影响及作用机制,现报道如下。
1 材料与方法
1.1 细胞、主要试剂和仪器
人胃癌BGC823细胞株购自中国科学院上海生命科学研究院细胞资源中心,pcDNA3.1+PCDH10质粒、pcDNA3.1+空质粒均购自云舟生物科技(广州)有限公司。RPMI-1640培养基、胎牛血清、lipofectamineTM2000试剂盒均购自美国Amresco公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量分析试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)均购自美国Sigma公司,荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒、逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒均购自日本TCI公司,lipofectamineTM2000试剂盒购自日本Takara公司。NIB900-FL型倒置荧光显微镜购自广州市明慧科技有限公司,7500 Real-Time定量PCR仪购自美国Thermo Fisher Scientific-CN公司,Spectra Max iD5酶标仪购自美国molecular devices公司,PE2400电泳仪、GelDOC2000型凝胶成像分析系统均购自美国Bio-Rad中国公司。
1.2 实验方法
1.2.1 细胞培养及转染 人胃癌BGC823细胞株接种于含10%胎牛血清的RPMI-1640培养基中,37℃恒温、恒湿箱,5% CO2环境中孵育培养。取对数期细胞接种于24孔板,细胞长满75%瓶底面积时,更换为无双抗的完全培养基。严格按照LipofectamineTM2000脂质体说明书进行转染,将pcDNA3.1+PCDH10质粒、pcDNA3.1+空质粒转染至人胃癌BGC823细胞株,分别作为转染组、空载组,转染36 h后采用荧光显微镜观察转染效果,将未作任何处理的BGC823细胞株作为空白组。
1.2.2 实时荧光定量RT-PCR检测PCDH10mRNA 的相对表达量 收集转染36 h后的转染组、空载组和空白组人胃癌BGC823细胞,Trizol法裂解提取总RNA,取1 μg经逆转录试剂盒逆转录获取互补DNA(complementary DNA,cDNA)。按照Takara SYBR Green荧光定量试剂盒要求进行反转录,反应条件:94℃ 10 min,1个循环;52℃ 28 s,72℃28 s,共30个循环,以U6为内参,共22个循环,最后70℃延伸2 min。PCDH10正向引物:5'-TTGACCAGTTGCAGCATGAACG-3',反向引物 :5'-GTGAACCTGACTTAGGCACGCC-3';U6正向引物:5'-TAGCCAGTTGCAGCACCTTATA-3',反向引物:5'-GGTAGAGACGCCGTGCGCATAC-3'。实验重复3次取平均值。
1.2.3 蛋白质印记法(Western blot)检测PCDH10蛋白的相对表达量 按照蛋白提取试剂盒要求获取转染36 h后的转染组、空载组和空白组人胃癌BGC823细胞总蛋白,BCA法定量,常规变性后经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,经电转仪转至硝酸纤维膜上,5%脱脂奶粉封闭过夜,加入一抗(稀释浓度为1∶500)、二抗(稀释浓度为1∶1000)孵育1 h,二氨基联苯胺(diaminobenzidine,DAB)显色,以β-actin为内参,采用Fusion软件计算目的蛋白的相对表达量。实验重复3次取平均值。
1.2.4 噻唑蓝(methyl thiazolyl tetrazolium,MTT)法检测细胞增殖情况 取稳定转染的转染组、空载组、空白组人胃癌BGC823细胞,重新调整细胞密度,以1.0×104/ml接种于96孔板,每孔200 μl,每组设置5个复孔。培养至24、48、72 h时,每孔加入20 μl新制备MTT溶液(浓度为5 μg/μl),继续培养4 h后丢弃上层培养液,每孔加入150 μl的DMSO溶液,震荡均匀后采用酶标仪测定570 nm波长处光密度(optical density,OD)值。实验重复3次取平均值。
1.2.5 划痕试验检测细胞迁移能力 取稳定转染的转染组、空载组及空白组人胃癌BGC823细胞,胰蛋白酶消化、重悬;采用无血清培养基洗涤2次后,以2.0×104/ml接种于6孔板,孵育过夜,细胞铺满底壁后丢弃培养基;采用2 μl无菌枪头划痕,磷酸盐缓冲液(phosphate buffered solution,PBS)轻吹去除划下细胞,加入完全培养基孵育24 h后取样、拍照。细胞迁移率(%)=(初始划痕宽度-24 h后划痕宽度)/初始划痕宽度×100%。
1.2.6 Transwell小室检测细胞侵袭能力 收集稳定转染的转染组、空载组及空白组人胃癌BGC823细胞,加入无血清培养基培养12 h,调整各组细胞浓度为2.0×105/ml。于孔径8 μm、24孔的Transwell小室的上室中加入200 μl各组细胞悬液,下室中加入含10%胎牛血清的RPMI-1640培养液,置于孵箱中孵育24 h后取出小室。取少量悬液置于计数板中,于显微镜下观察穿过滤膜进入下室下腔的细胞数量。
1.2.7 PCDH10对不同浓度顺铂的敏感性 取稳定转染的转染组、空载组及空白组人胃癌BGC823细胞,胰蛋白酶消化,重悬,以5.0×103/孔接种于96孔板,每组设置5个复孔。依次分别向转染组、空载组及空白组细胞中加入顺铂,使终浓度分别为0.500、1.000、2.000、4.000、8.000 μg/ml。采用 MTT法测定570 nm处OD值,细胞存活率(%)=(各浓度OD值-空白组OD值)(/0 μg/ml OD值-空白组OD值)。根据曲线计算顺铂对BGC823细胞的半数抑制浓度(half inhibitory concentration,IC50)。
1.2.8 实时荧光定量PCR检测PI3K、AKT、MTOR、p70S6mRNA 的相对表达量 取部分稳定转染的转染组、空白组人胃癌BGC823细胞,胰蛋白酶消化,重悬,以5.0×103/孔接种于96孔板。分别加入IC50浓度的顺铂溶液,即浓度为4.000 μg/ml的顺铂溶液,分别作为转染+顺铂组、顺铂组。培养48 h后,胰蛋白酶消化,重新收集稳定转染的转染组、空白组细胞及转染+顺铂组、顺铂组细胞,采用实时定量RT-PCR法测定4组细胞中PI3K、AKT、MTOR、p70S6mRNA的相对表达量,以β-actin为内参,重复3次取Ct平均值,以2-△△CT计算目的基因的相对表达量。引物序列见表1。

表1 引物序列
1.2.9 Western blot检 测PI3K、AKT、MTOR、p70S6蛋白的相对表达量 重新收集稳定转染的转染组、空白组细胞、顺铂组、转染+顺铂组细胞,PBS冲洗后,加入裂解液冰上裂解35 min,4℃以11 000 r/min离心25 min,取上清;每孔加入200 μl的BCA混合液,经SDS-PAGE电泳分离,转膜后封闭1.5 h,加入一抗、二抗孵育,取出条带漂洗,避光显影,以β-actin为内参采用Fusion软件计算各条带灰度值。
1.3 统计学方法
采用SPSS 25.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 PCDH10mRNA及PCDH10蛋白相对表达量的比较
转染组细胞PCDH10mRNA及PCDH10蛋白的相对表达量,均高于空载组和空白组细胞,差异均有统计学意义(P<0.05);空白组和空载组PCDH10mRNA及PCDH10蛋白的相对表达量比较,差异均无统计学意义(P>0.05)。(表2)
2.2 增殖能力的比较
稳定转染转染组、空载组和空白组人胃癌BGC823细胞重新接种并培养24、48、72 h时,转染组细胞OD值均低于空载组和空白组细胞,差异均有统计学意义(P<0.05);空白组和空载组细胞OD值比较,差异均无统计学意义(P>0.05)。(表3)
表2 转染组、空载组和空白组人胃癌BGC823细胞PCDH10 mRNA及PCDH10蛋白相对表达量的比较(±s)
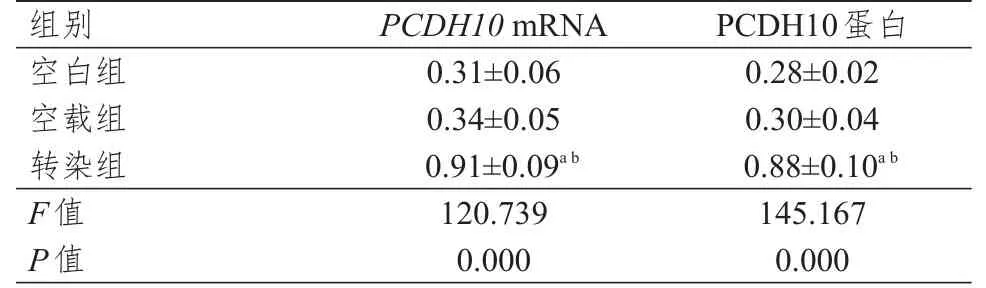
表2 转染组、空载组和空白组人胃癌BGC823细胞PCDH10 mRNA及PCDH10蛋白相对表达量的比较(±s)
注:a与空白组细胞比较,P<0.05;b与空载组细胞比较,P<0.05
组别空白组空载组转染组F值P值0.3 1±0.0 6 0.3 4±0.0 5 0.9 1±0.0 9 a b 1 2 0.7 3 9 0.0 0 0 0.2 8±0.0 2 0.3 0±0.0 4 0.8 8±0.1 0 a b 1 4 5.1 6 7 0.0 0 0 P C D H 1 0 m R N A P C D H 1 0蛋白
表3 转染组、空载组和空白组人胃癌BGC823细胞增殖能力比较(±s)
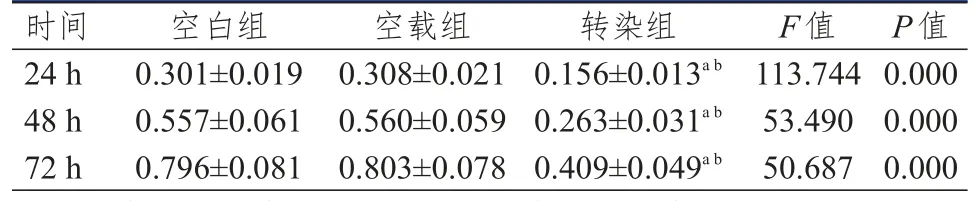
表3 转染组、空载组和空白组人胃癌BGC823细胞增殖能力比较(±s)
注:a与空白组细胞比较,P<0.05;b与空载组细胞比较,P<0.05
空载组0.3 0 8±0.0 2 1 0.5 6 0±0.0 5 9 0.8 0 3±0.0 7 8时间2 4 h 4 8 h 7 2 h空白组0.3 0 1±0.0 1 9 0.5 5 7±0.0 6 1 0.7 9 6±0.0 8 1转染组0.1 5 6±0.0 1 3 a b 0.2 6 3±0.0 3 1 a b 0.4 0 9±0.0 4 9 a b F值1 1 3.7 4 4 5 3.4 9 0 5 0.6 8 7 P值0.0 0 0 0.0 0 0 0.0 0 0
2.3 迁移和侵袭能力的比较
培养24 h时,转染组细胞迁移率和穿膜细胞数均低于空载组、空白组细胞,差异均有统计学意义(P<0.05);空载组和空白组细胞迁移率和穿膜细胞数比较,差异均无统计学意义(P>0.05)。(表4)
表4 转染组、空载组和空白组人胃癌BGC823细胞迁移率和穿膜细胞数的比较(±s)

表4 转染组、空载组和空白组人胃癌BGC823细胞迁移率和穿膜细胞数的比较(±s)
注:a与空白组细胞比较,P<0.05;b与空载组细胞比较,P<0.05
组别空白组空载组转染组F值P值8 1.0 2±5.9 4 8 3.1 1±5.2 6 5 3.9 7±4.5 8 a b 4 7.2 2 0 0.0 0 0 1 1 4.8 6±1 8.9 0 1 1 9.3 3±1 9.0 4 4 1.0 6±5.9 1 a b 3 8.4 0 3 0.0 0 0迁移率(%)穿膜细胞数
2.4 不同顺铂浓度细胞存活率及IC50的比较
顺铂浓度分别为 0.500、1.000、2.000、4.000、8.000 μg/ml时,转染组细胞存活率均低于空载组和空白组细胞,差异均有统计学意义(P<0.05);空载组和空白组细胞存活率比较,差异均无统计学意义(P>0.05)(表5)。转染组顺铂对细胞的IC50值(1.52±0.29)μg/ml,均低于空白组(4.31±0.40)μg/ml和空载组(3.98±0.37)μg/ml,差异均有统计学意义(P<0.05);空白组与空载组顺铂对细胞的IC50值比较,差异均无统计学意义(P>0.05)。
表5 不同顺铂浓度人胃癌BGC823细胞存活率比较(%,±s)
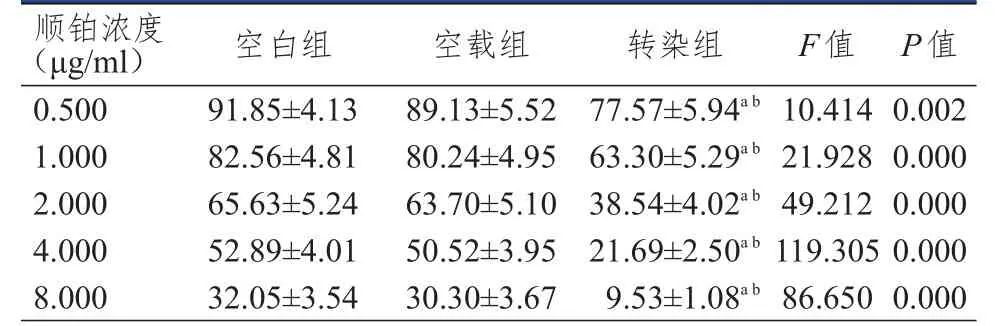
表5 不同顺铂浓度人胃癌BGC823细胞存活率比较(%,±s)
注:a与空白组细胞比较,P<0.05;b与空载组细胞比较,P<0.05
顺铂浓度(μ g/m l)0.5 0 0 1.0 0 0 2.0 0 0 4.0 0 0 8.0 0 0空白组9 1.8 5±4.1 3 8 2.5 6±4.8 1 6 5.6 3±5.2 4 5 2.8 9±4.0 1 3 2.0 5±3.5 4空载组8 9.1 3±5.5 2 8 0.2 4±4.9 5 6 3.7 0±5.1 0 5 0.5 2±3.9 5 3 0.3 0±3.6 7转染组7 7.5 7±5.9 4 a b 6 3.3 0±5.2 9 a b 3 8.5 4±4.0 2 a b 2 1.6 9±2.5 0 a b 9.5 3±1.0 8 a b F值1 0.4 1 4 2 1.9 2 8 4 9.2 1 2 1 1 9.3 0 5 8 6.6 5 0 P值0.0 0 2 0.0 0 0 0.0 0 0 0.0 0 0 0.0 0 0
2.5 PI3K、AKT、MTOR、p70S6mRNA相对表达量的比较
各组细胞PI3K、AKT、MTOR、p70S6mRNA相对表达量的组间比较,差异有统计学意义(P<0.05),其中转染组、顺铂组、转染+顺铂组细胞PI3K、MTOR、p70S6mRNA相对表达量均低于空白组细胞,转染+顺铂组细胞PI3K、MTOR、p70S6mRNA相对表达量均低于转染组和顺铂组细胞,差异均有统计学意义(P<0.05);转染组和空白组细胞PI3K、MTOR、p70S6mRNA相对表达量比较,差异均无统计学意义(P>0.05)。各组细胞AKT mRNA的相对表达量比较,差异无统计学意义(P>0.05)。(表6)
表6 各组细胞PI3K、AKT、MTOR、p70S6 mRNA相对表达量的比较(±s)
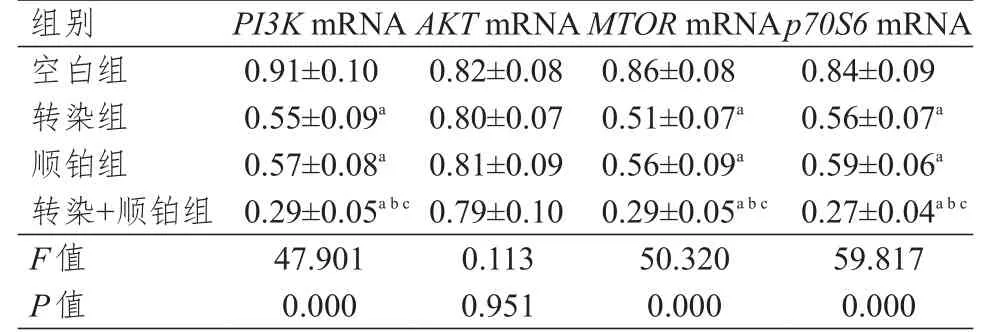
表6 各组细胞PI3K、AKT、MTOR、p70S6 mRNA相对表达量的比较(±s)
注:a与空白组细胞比较,P<0.05;b与转染组细胞比较,P<0.05;c与顺铂组细胞比较,P<0.05
P I 3 K m R N A 0.9 1±0.1 0 0.5 5±0.0 9 a 0.5 7±0.0 8 a 0.2 9±0.0 5 a b c 4 7.9 0 1 0.0 0 0 0.8 2±0.0 8 0.8 0±0.0 7 0.8 1±0.0 9 0.7 9±0.1 0 0.1 1 3 0.9 5 1 0.8 6±0.0 8 0.5 1±0.0 7 a 0.5 6±0.0 9 a 0.2 9±0.0 5 a b c 5 0.3 2 0 0.0 0 0 0.8 4±0.0 9 0.5 6±0.0 7 a 0.5 9±0.0 6 a 0.2 7±0.0 4 a b c 5 9.8 1 7 0.0 0 0空白组转染组顺铂组转染+顺铂组F值P值A K T m R N A M T O R m R N A p 7 0 S 6 m R N A组别
2.6 PI3K、AKT、MTOR、p70S6蛋白相对表达量的比较
各组细胞PI3K、AKT、MTOR、p70S6蛋白相对表达量的组间比较,差异有统计学意义(P<0.05),其中转染组、顺铂组、转染+顺铂组细胞PI3K、MTOR、p70S6的相对表达量和pAKT/AKT均低于空白组细胞,转染+顺铂组细胞PI3K、MTOR、p70S6的相对表达量和pAKT/AKT均低于转染组和顺铂组细胞,差异均有统计学意义(P<0.05);转染组和空白组细胞PI3K、MTOR、p70S6的相对表达量和pAKT/AKT比较,差异均无统计学意义(P>0.05)。(表7)
表7 各组细胞PI3K、AKT、MTOR、p70S6蛋白相对表达量的比较(±s)
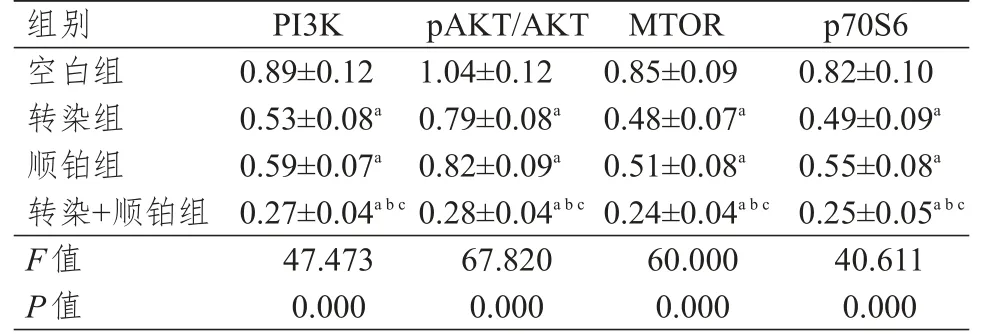
表7 各组细胞PI3K、AKT、MTOR、p70S6蛋白相对表达量的比较(±s)
注:a与空白组细胞比较,P<0.05;b与转染组细胞比较,P<0.05;c与顺铂组细胞比较,P<0.05
组别空白组转染组顺铂组转染+顺铂组F值P值P I 3 K 0.8 9±0.1 2 0.5 3±0.0 8 a 0.5 9±0.0 7 a 0.2 7±0.0 4 a b c 4 7.4 7 3 0.0 0 0 p A K T/A K T 1.0 4±0.1 2 0.7 9±0.0 8 a 0.8 2±0.0 9 a 0.2 8±0.0 4 a b c 6 7.8 2 0 0.0 0 0 M T O R 0.8 5±0.0 9 0.4 8±0.0 7 a 0.5 1±0.0 8 a 0.2 4±0.0 4 a b c 6 0.0 0 0 0.0 0 0 p 7 0 S 6 0.8 2±0.1 0 0.4 9±0.0 9 a 0.5 5±0.0 8 a 0.2 5±0.0 5 a b c 4 0.6 1 1 0.0 0 0
3 讨论
胃癌是多基因、多因素综合作用导致的恶性肿瘤,环境、遗传、生活习惯及幽门螺杆菌感染等均是其危险因素[8]。由于该病早期症状隐匿且缺乏特异性,多数患者在确诊时已处于中晚期,仅能采用以化疗为主的保守治疗手段。顺铂是直接作用于DNA的铂类化疗药,已被广泛应用在胃癌的治疗中,可延长患者生存期,但由于易发生耐药,整体疗效不佳。目前,细胞耐药的相关机制并未明确,有学者认为,可能与细胞增殖及凋亡失衡相关[9],且是多基因、多种调控机制联合作用的结果。刘蒙等[10]研究显示,下调CDH10的表达可抑制顺铂耐药细胞的增殖能力,增强胃癌细胞对顺铂的敏感性。PCDH10与肝肠钙黏蛋白17(liver-intestinecadherin,LI-cadherin,又称 CDH17)同属钙黏蛋白超家族成员,二者生理功能相似,因此,可推测PCDH10与胃癌患者顺铂耐药相关,探讨其对顺铂的敏感性及相关机制对逆转胃癌细胞耐药、改善预后至关重要。
PCDH10主要表达于中枢神经系统,在细胞内信号传导、细胞间黏附中发挥重要作用。有报道证实[11-12],PCDH10基因启动子区的CpG岛异常甲基化,可破坏细胞信号转导通路,促使细胞向恶性转化发生癌变,且该机制在多种恶性肿瘤中均存在。田浩等[13]研究显示,胃癌组织中PCDH10蛋白相对表达量明显低于癌旁组织,且其表达水平与胃癌TNM分期、淋巴结转移及远期预后关系密切。本研究通过建立过表达PCDH10的人胃癌BGC823细胞,结果发现,稳定转染各组细胞重新接种,转染组培养24、48、72 h时的OD值、培养24 h时的迁移率和穿膜细胞数均降低,表明过表达PCDH10可降低胃癌细胞的增殖、迁移及侵袭能力,与Ye等[14]关于PCDH10在肝癌细胞中作用机制的研究结果相似。近年来,临床对肿瘤迁移侵袭与化疗多药耐药间的研究逐渐深入,有学者认为,肿瘤细胞在产生耐药性的同时,迁移侵袭相关信号通路被激活,导致细胞迁移侵袭能力增强[15]。由此可见,肿瘤转移与耐药性的产生可能并非孤立事件,二者在功能上存在某种联系。本研究结果显示,不同顺铂浓度下,转染组细胞存活率、顺铂对细胞的IC50值均低于空白组和空载组细胞,表明过表达PCDH10可增强细胞对顺铂的敏感性。
PI3K为蛋白激酶家族成员,AKT为其下游直接效应蛋白。细胞表面的PI3K被胞外刺激信号激活后,AKT位点被磷酸化,磷酸化蛋白激酶B(phosphorylated protein kinase B,pAKT)进入细胞中,开启转导PI3K始动生物信息功能,激活下游效应基因,启动炎性反应。研究显示,多种恶性肿瘤中普遍存在PI3K/AKT信号通路的活化[16-17],广泛参与肿瘤细胞的增殖、迁移和侵袭等过程。李沐涵等[18]使用PI3K/AKT通路抑制剂阻断该通路后,胃癌MGC-803细胞的侵袭能力明显受抑制。MTOR为高度保守进化的丝/苏氨酸蛋白激酶,可调控细胞分裂与合成代谢,与PI3K/AKT通路密切相关[19],可直接被AKT激活或接收生长因子信号而活化,进一步激活下游蛋白p70S6,进而加快肌动蛋白细丝重构与mRNA的翻译过程,调控蛋白生成,促进细胞增殖。付汉东等[20]研究显示,MTOR、p70S6在胃癌组织中呈异常高表达状态,且与疾病临床与病理特征相关。本研究中,人胃癌BGC823细胞经PCDH10转染及顺铂干预后,PI3K、MTOR、p70S6mRNA的相对表达量均下调,且PI3K、MTOR、p70S6蛋白的相对表达量及pAKT/AKT均降低,且转染+顺铂对其表达调控作用更加显著,表明过表达PCDH10增强细胞顺铂敏感性的机制可能与下调PI3K、MTOR、p70S6mRNA及PI3K、MTOR、p70S6蛋白表达、抑制AKT磷酸化相关,推测PCDH10可作为临床增强胃癌细胞顺铂敏感性的靶向基因。
综上所述,PCDH10过表达可抑制人胃癌BGC823细胞的增殖、迁移、侵袭能力,并可增强细胞顺铂化疗敏感性,其作用机制可能与下调PI3K、MTOR、p70S6mRNA 及 PI3K、MTOR、p70S6蛋白表达、抑制AKT磷酸化相关。本研究为临床进一步明确PCDH10信号通路在胃癌多药耐药中的作用机制、逆转胃癌耐药提供了理论依据。
